miR-199a-3p抑制卵巢癌SK0V3细胞增殖侵袭能力及其机制
2018-01-02张丽娟张旭力
张丽娟,张旭力,王 娟,王 芳
miR-199a-3p抑制卵巢癌SK0V3细胞增殖侵袭能力及其机制
张丽娟,张旭力,王 娟,王 芳
目的探讨miR-199a-3p对卵巢癌SK0V3细胞增殖、侵袭能力的影响及其作用机制。方法以卵巢癌SK0V3细胞系为研究对象,将进入对数生长期的细胞按照生长情况分为miR-199a-3p过表达组、miR-199a-3p抑制组和对照组,观察miR-199a-3p过表达和抑制效率及其对卵巢癌SK0V3细胞增殖、侵袭及c-Met、MMP-2和CD44蛋白表达的影响。结果与对照组比较,miR-199a-3p过表达组SK0V3细胞中miR-199a-3p呈高表达状态,且SK0V3细胞与细胞克隆数量、侵袭细胞数量、c-Met及其下游蛋白MMP-2和CD44的表达水平均降低,而miR-199a-3p抑制组SK0V3细胞中miR-199a-3p表达下降,SK0V3细胞与细胞克隆数量、侵袭细胞数量、c-Met及其下游蛋白MMP-2和CD44的表达水平均显著增加,差异均有统计学意义(P<0.05)。结论miR-199a-3p可能通过抑制c-Met、MMP-2和CD44蛋白的表达进而影响卵巢癌SK0V3细胞的侵袭和迁移,可能成为治疗卵巢癌的新方法。
卵巢癌;miR-199a-3p;癌基因;细胞增殖;肿瘤浸润
卵巢癌是女性癌症死亡的第五大原因,5年生存率仅为30%,是最致命的妇科恶性肿瘤之一[1]。在卵巢癌传播过程中,癌细胞漂浮在腹膜腔而不进入血管,因此,缺氧可能导致癌细胞获得更具侵袭性的恶性表型[2],并通过腹膜表面转移进而侵袭其他器官。microRNA(miRNA)是最新发现的通过降解mRNA或翻译抑制下调靶基因表达的一类非编码短序列RNA。miRNAs作为癌基因或抑癌基因调控肿瘤的发生、发展[3]。有研究表明,缺氧可显著下调卵巢癌细胞miR-199a-3p水平[4]。本研究通过四甲基偶氮唑盐(MTT)细胞增殖实验、软琼脂集落形成实验和Transwell侵袭等方法,进一步分析miR-199a-3p的过表达和抑制对卵巢癌SK0V3细胞增殖、侵袭及迁移能力的影响,并探讨其可能的分子作用机制,现将结果报告如下,为临床治疗提供参考依据。
1 材料与方法
1.1细胞培养 人卵巢癌SK0V3细胞为美国ATCC公司产品,置于RPMI 1640培养基中[10%特级胎牛血清(FBS)、0.1 mg/ml青霉素和1×105U/L硫酸链霉素,均来自美国GIBCO公司],置于37℃、5%二氧化碳(CO2)、湿度95%培养箱中培养,至细胞达90%~100%汇合时,予0.125%胰蛋白酶常规消化,按1∶3进行细胞传代。将进入对数生长期的细胞按照生长情况分为miR-199a-3p过表达组、miR-199a-3p抑制组和对照组,全部细胞培养过程均在武汉大学医学院分子生物学中心完成。
1.2miRNA前体和抑制剂的转染及鉴定 选取对数生长期的卵巢癌SK0V3细胞,以每孔2×105均匀接种于6孔板中,至生长汇合度达70%~80%时进行细胞转染,转染浓度为100 nM的miR-199a-3p前体(Life Techonologies公司,批号PM11779)或浓度为200 nM的miR-199a-3p抑制物(Life Techonologies公司,批号AM11779),用相应浓度的荧光素标记的无意义miRNA为对照组,转染操作流程按照Lipofectamine 2000说明书进行。细胞转染48 h后,弃培养液,使用D-Hank's液清洗。荧光显微镜(Olympus BX51)下观察不同浓度转染组的阳性细胞率,以确定有效的转染浓度。miRNA前体和抑制剂的转染效率用miRNA特异性实时荧光定量聚合酶链反应(PCR)鉴定。
1.3RT-qPCR分析 miR-199a-3p的RT-qPCR应用StepOnePlusReal-Time PCR System系统(Applied Biosystems, FosterCity, CA, USA),按Trizol试剂盒(美国GIBCO/BRL公司)说明书提取总RNA,并按照TaqMan MicroRNA Reverse Transcription Kit试剂盒说明书合成cDNA。应用hsa-miR-199a-3p assay试剂盒(TaqMan,批号002304)检测miR-199a-3p水平,以RNU6B作为内参基因(TaqMan,批号001093),相对定量PCR操作流程参照文献进行[5]。
1.4体外软琼脂克隆实验 按每孔1×105个细胞接种于含有0.5%琼脂糖的6孔板基底层中,过夜贴壁后待细胞生长到70%~80%汇合后,分别转染相应的miRNA模拟物前体和(或)抑制剂。10 d后在40倍显微镜下计数直径>100 μm的菌落。
1.5Transwell侵袭实验 各组细胞用0.125%的胰蛋白酶消化后计数,使用含1%牛血清蛋白(BSA)的无血清RPMI 1640培养液重悬细胞,调整浓度为5×104细胞/ml。每组取300 μl细胞悬液加入Transwell中,37℃培养箱孵育,约24~48 h后终止实验,4%甲醛固定,结晶紫染色5 min,非侵入细胞用棉签剔除。显微镜下随机选取5个视野进行拍照,计算每个视野的平均细胞数量。
1.6免疫印迹法检测蛋白表达 免疫印迹法检测c-Met蛋白表达水平,β-actin作为内参蛋白,在转染成功培养72 h后收集卵巢癌SK0V3细胞,磷酸盐缓冲液(PBS)洗涤3次,每次5 min,加入细胞匀浆液(50 mmol/L This-HCl pH=7.4,0.2 mmol/L PMSF,1%Triton X-100,1 mmol/L EDTA),4℃下以12000 r/min离心10 min,取上清,上样量为10 μl/well,使用10%聚丙烯酰胺凝胶电泳蛋白进行分离,将蛋白从凝胶转印至转聚偏二氟乙烯(PVDF)膜上,室温封闭1 h,加入Anti-c-Met多克隆抗体(Abcam,1∶800)、Anti- MMP-2(Abcam,1∶800)或Anti-CD44多克隆抗体(Abcam,1∶1000)4℃孵育过夜,辣根过氧化物酶(HRP)标记抗鼠/兔IgG二抗常温孵育1 h,再经ECL孵育,暗室内X线胶片成像,GelPro软件进行图像分析。每组重复6次,结果取算数平均数。
1.7统计学分析 采用SPSS 19.0统计学软件进行数据处理,组间比较采用单因素方差分析。每组实验至少重复3次,以α=0.05为检验水准。
2 结果
2.1miR-199a-3p过表达和抑制效率鉴定 与对照组比较,miR-199a-3p过表达组SK0V3细胞中miR-199a-3p呈高表达状态,而miR-199a-3p抑制组SK0V3细胞中miR-199a-3p表达下降,差异均有统计学意义(P<0.01),见图1。提示本实验采用的miR-199a-3p过表达和抑制方法具有较高效率,完全可用于后续实验。
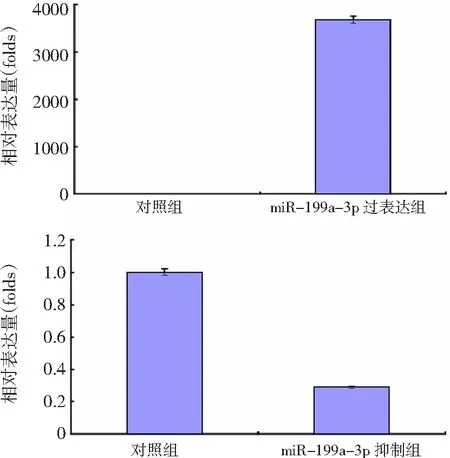
图1卵巢癌SK0V3细胞miR-199a-3p过表达和抑制效率鉴定
2.2miR-199a-3p对卵巢癌SK0V3细胞增殖能力的影响 与对照组比较,miR-199a-3p过表达组SK0V3细胞与细胞克隆数量显著减少,而miR-199a-3p抑制组SK0V3细胞与细胞克隆形成数量明显增加,差异均有统计学意义(P<0.05),见图2。提示miR-199a-3p的表达水平与SK0V3细胞增殖能力呈负相关。

图2miR-199a-3p对卵巢癌SK0V3细胞增殖能力的影响
2.3miR-199a-3p对卵巢癌SK0V3细胞侵袭能力的影响 与对照组比较,miR-199a-3p过表达组SK0V3细胞中侵袭细胞数量显著减少,而miR-199a-3p抑制组SK0V3细胞中侵袭细胞数量显著增加,差异有统计学意义(P<0.05),见图3。说明miR-199a-3p表达上调能显著抑制SK0V3细胞侵袭能力,反之则促进SK0V3细胞发生侵袭。
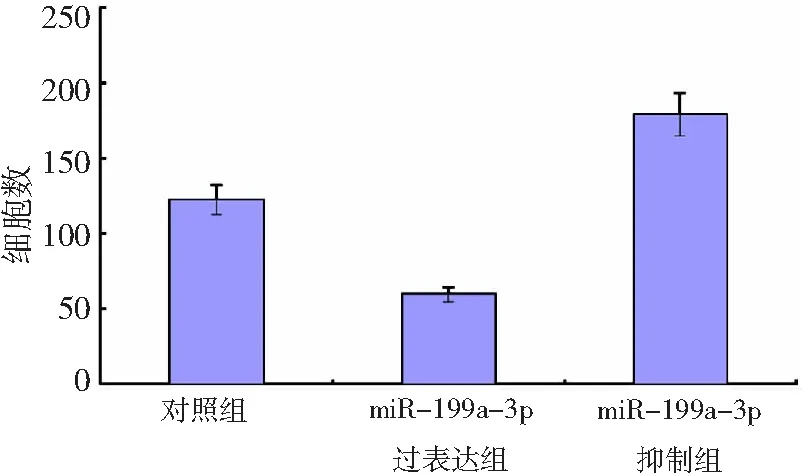
图3miR-199a-3p对卵巢癌SK0V3细胞侵袭能力的影响
2.4miR-199a-3p对卵巢癌SK0V3细胞c-Met、MMP-2、CD44蛋白表达的影响 与对照组比较,miR-199a-3p过表达组SK0V3细胞c-Met及其下游蛋白MMP-2和CD44的表达水平均显著减少,而miR-199a-3p抑制组SK0V3细胞c-Met及其下游蛋白MMP-2和CD44的表达水平均显著增加,差异均有统计学意义(P<0.05),见图4。说明miR-199a-3p表达上调能显著抑制SK0V3细胞中c-Met及其下游蛋白MMP-2和CD44的表达,反之则促进c-Met及其下游蛋白MMP-2和CD44的表达,推测miR-199a-3p可能通过影响c-Met及其下游蛋白MMP-2和CD44的表达而参与卵巢癌SK0V3细胞的生物学行为。
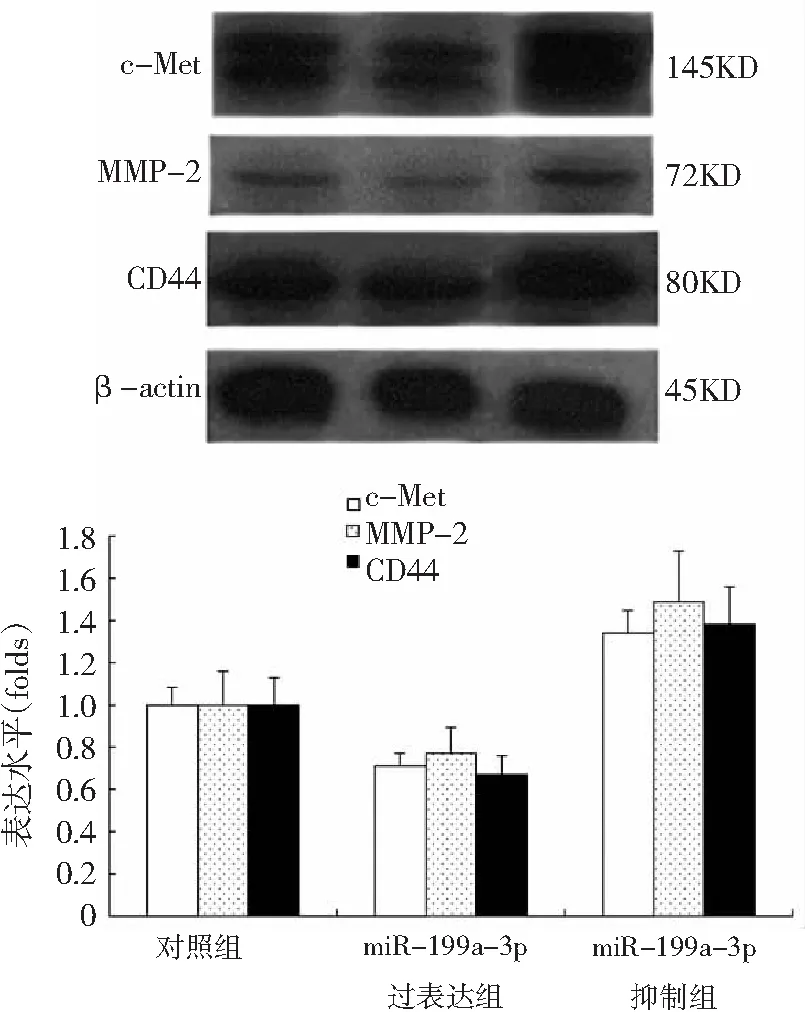
图4miR-199a-3p对卵巢癌SK0V3细胞c-Met、MMP-2、CD44蛋白表达的影响
3 讨论
相关研究表明,miRNA在癌症发生、发展中发挥重要作用,是潜在的治疗靶标[6-8]。有研究证实,多种miRNA在卵巢癌中异常表达,可能涉及卵巢癌的启动和发展[9]。人基因组相关位点编码的miR-199a-5p和miR-199a-3p前体,其中一种位于1号染色体(miR-199a-2, miRBase Accession MI0000281),编码dynamin 3;一种位于19号染色体(miR-199a-1, miRBase Accession MI0000242),编码dynamin 2[10]。miR-199a在人类不同的肿瘤中有不同的表达模式,并发挥着截然相反的作用,如胃癌患者miR-199a-3p表达上调,且与患者无进展生存期相关[11],而结直肠癌高表达miR-199a-3p可能与患者总存活率下降有关[12]。此外,有文献报道miR-199a-3p在骨肉瘤、膀胱癌、前列腺癌和乳头状甲状腺癌中亦呈表达下调趋势[13-14]。Minna等[15]研究证实,卵巢癌组织或细胞系miR-199a-5p的表达水平下调,其通过CD44蛋白抑制卵巢癌启动细胞的致瘤性和耐药性[16]。
本研究探讨miR-199a-3p在卵巢癌SK0V3细胞增殖、侵袭中的作用及其可能的分子机制,结果显示,miR-199a-3p过表达可显著降低卵巢癌SK0V3细胞的增殖和侵袭能力,反之则提高卵巢癌细胞的增殖和侵袭能力,提示miR-199a-3p在卵巢癌SK0V3细胞增殖和侵袭等生物学行为中发挥重要作用。
正常组织中c-Met蛋白表达非常低,但由于基因扩增、活化突变、过表达二聚化及自分泌或旁分泌刺激机制,其在多种类型的肿瘤组织中表达失调[17]。研究表明,抑制c-Met蛋白可减少卵巢癌细胞的黏附、侵袭和转移[18],且在多种癌细胞系中被确定为miR-199a-3p重要靶标分子[19]。本文研究发现,上调miR-199a-3p可显著抑制c-Met蛋白的表达,进而抑制在卵巢癌发生、发展过程中发挥重要作用的MMP-2和CD44蛋白的表达,提示miR-199a-3p可能通过调控c-Met、MMP-2和CD44蛋白的表达进而影响卵巢癌SK0V3细胞的增殖及侵袭能力。
综上,以miR-199a-3p为靶点的干预治疗有望成为抑制卵巢癌SK0V3细胞侵袭和转移的新方法,值得临床进一步深入研究探讨。
[1] Siegel R, Ma J, Zou Z,etal. Cancer statistics, 2014[J].CACancer J Clin, 2014,64(1):9-29.
[2] Tan D S, Agarwal R, Kaye S B. Mechanisms of transcoelomic metastasis in ovarian cancer[J].Lancet Oncol, 2006,7(11):925-934.
[3] Shen G, Li X, Jia Y F,etal. Hypoxia-regulated microRNAs in human cancer[J].Acta Pharmacol Sin, 2013,34(3):336-341.
[4] Kinose Y, Sawada K, Nakamura K,etal. The hypoxia-related microRNA miR-199a-3p displays tumor suppressor functions in ovarian carcinoma[J].Oncotarget, 2015,6(13):11342-11356.
[5] Schmittgen T D, Livak K J. Analyzing real-time PCR data by the comparative C(T) method[J].Nat Protoc, 2008,3(6):1101-1108.
[6] Cho W C. Exploiting the therapeutic potential of microRNAs in human cancer[J].Expert Opin Ther Targets, 2012,16(4):345-350.
[7] 刘淑娟,辛晓燕.多肿瘤抑制基因对卵巢癌细胞周期的影响[J].西北国防医学杂志,2001,15(2):151-153.
[8] 朱爱萍,张洁,吴小华,等.miRNA与卵巢癌关系的研究进展[J].临床误诊误治,2015,28(2):113-116.
[9] Calin G A, Croce C M. MicroRNA-cancer connection: the beginning of a new tale[J].Cancer Res, 2006,66(15):7390-7394.
[10] Gu S, Chan W Y. Flexible and versatile as a chameleon-sophisticated functions of microRNA-199a[J].Int J Mol Sci, 2012,13(7):8449-8466.
[11] Brenner B, Hoshen M B, Purim O,etal. MicroRNAs as a potential prognostic factor in gastric cancer[J].World J Gastroenterol, 2011,17(35):3976-3985.
[12] Wan D, He S, Xie B,etal. Aberrant expression of miR-199a-3p and its clinical significance in colorectal cancers[J].Med Oncol, 2013,30(1):378.
[13] Feber A, Xi L, Pennathur A,etal. MicroRNA prognostic signature for nodal metastases and survival in esophageal adenocarcinoma[J].Ann Thorac Surg, 2011,91(5):1523-1530.
[14] Qu Y, Huang X, Li Z,etal. miR-199a-3p inhibits aurora kinase A and attenuates prostate cancer growth: new avenue for prostate cancer treatment[J].Am J Pathol, 2014,184(5):1541-1549.
[15] Minna E, Romeo P, De Cecco L,etal. miR-199a-3p displays tumor suppressor functions in papillary thyroid carcinoma[J].Oncotarget, 2014,5(9):2513-2528.
[16] Cheng W, Liu T, Wan X,etal. MicroRNA-199a targets CD44 to suppress the tumorigenicity and multidrug resistance of ovarian cancer-initiating cells[J].FEBS J, 2012,279(11):2047-2059.
[17] Munshi N, Jeay S, Li Y,etal. ARQ 197, a novel and selective inhibitor of the human c-Met receptor tyrosine kinase with antitumor activity[J].Mol Cancer Ther, 2010,9(6):1544-1553.
[18] Sawada K, Radjabi A R, Shinomiya N,etal. c-Met overexpression is a prognostic factor in ovarian cancer and an effective target for inhibition of peritoneal dissemination and invasion[J].Cancer Res, 2007,67(4):1670-1679.
[19] Migliore C, Petrelli A, Ghiso E,etal. MicroRNAs impair MET-mediated invasive growth[J].Cancer Res, 2008,68(24):10128-10136.
InhibitionAbilityofmiR-199a-3pinProliferationandInvasionofSK0V3CellsinOvarialCancerandItsMechanism
ZHANG Li-juan1, ZHANG Xu-li2, WANG Juan3, WANG Fang4
(1. Department of Obstetrics and Gynecology, Maternal and Child Health Hospital of Wuxue, Wuxue, Hubei 435400, China; 2. Department of Pharmacy, the First People's Hospital of Wuxue, Wuxue, Hubei 435400, China; 3. Department of Obstetrics Tumor, Cancer Hospital of Hubei Province, Wuhan 430079, China; 4. Molecular Biology Center, Medical College of Wuhan University, Wuhan 430079, China)
ObjectiveTo investigate effects of miR-199a-3p in proliferation and invasion of SK0V3 cells in ovarial cancer and its mechanisms.MethodsSK0V3 cell line of ovarial cancer were recruited in this study, and SK0V3 cells in logarithmic growth phase were divided into miR-199a-3p overexpression, miR-199a-3p inhibition group and control groups. The miR-199a-3p overexpression and inhibition rates, and its effects on proliferation and invasion of SK0V3 cells and Met, MMP-2 and CD44 protein expressions were observed.ResultsCompared with those in control group, in miR-199a-3p overexpression group, miR-199a-3p in SK0V3 cancer cells was over expressed, and numbers of SK0V3 cells, cell clone formation and invasion cells, expressions of c-Met, MMP-2 and CD44 of c-Met downstream proteins were significantly decreased; in miR-199a-3p inhibition group, miR-199a-3p expression in SK0V3 cancer cells was decreased, and numbers of SK0V3 cells, cell clone formation and invasion cells,protein expressions of c-Met, MMP-2 and CD44 of c-Met downstream proteins were significantly increased (P<0.05).ConclusionThet miR-199a-3p can affect invasion and transference of SK0V3 cells in ovarial cancer by inhibiting c-Met, MMP-2 and CD44 protein expressions, and therefore miR-199a-3p may be used as a potential target in treatment of ovarian cancer.
Ovarian cancer; miR-199a-3p; Oncogene;Cell proliferation; Neoplasm invasiveness
湖北省卫生厅医学科研项目(QJX2010-401)
435400 湖北 武穴,武穴市妇幼保健院妇产科(张丽娟);435400 湖北 武穴,武穴市第一人民医院药剂科(张旭力);430079 武汉,湖北省肿瘤医院妇瘤科(王娟);430079 武汉,武汉大学医学院分子生物学中心(王芳)
张旭力,电话:13697141714;E-mail:13034480718@sina.com
R737.31
A
1002-3429(2017)12-0090-04
10.3969/j.issn.1002-3429.2017.12.034
2017-08-21 修回时间:2017-09-29)
