论如何提高多中心临床试验的审批效率
2018-01-02宋亚京
白 桦,孙 燕,宋亚京,钟 文
(北京协和医院临床药理研究中心,北京 100032,baih@pumch.cn)
论如何提高多中心临床试验的审批效率
白 桦,孙 燕,宋亚京,钟 文
(北京协和医院临床药理研究中心,北京 100032,baih@pumch.cn)
目的分析多中心临床试验项目审批环节的时间消耗情况,探讨提高审批效率的手段。方法回顾性分析2012年以来我院批准的多中心临床试验项目246项。我院为组长单位的为A组,参加单位的为B组,根据是否采用快速审查方式将B组分为B1(会议审查)和B2(快速审查)组。分析各组伦理审查时间、签署合同时间、启动试验时间和项目审批总时间,自组长单位批准后至参加单位材料递交的时间。结果在多中心临床试验审批中,签署合同耗时最多,约占41%。是否组长单位对审批环节的耗时未见明显影响。B1组与B2组项目总时间的平均值分别为180.94天和140.36天(P<0.05),B1组伦理审查的平均时间较B2组长约20天(P<0.01)。组长单位伦理批准后约96.54天,才向参加单位递交审查材料。结论对于组长单位已经审批通过的项目,尽快递交参加单位,并且采用快速审查方式可能明显缩短伦理审查时间,从而减少项目审批的总耗时。
多中心临床试验;审查效率;伦理审查
多中心试验是由多位研究者按同一试验方案在不同地点和单位同时进行的临床试验。各中心同期开始与结束试验,由一位主要研究者总负责,并作为临床试验各中心间的协调研究者[1]。虽然多中心临床试验具有减少资源浪费、高效收集受试者、了解医药前沿成果、提高研究水平等优势[2],但需要各中心分别审批,审批的效率一直是业内共同关注的问题。从项目立项到受试者入组,中间需要经历的主要环节有伦理审查、合同审批、启动试验等。有学者提出多中心临床试验中伦理审查耗时较长[3],但影响临床试验项目审批效率的并非伦理审查一个环节,其他环节对项目审批效率的影响鲜有研究。本研究旨在分析多中心临床试验的各个审批环节对审批效率的影响,从而提出提高审批效率的对策。
1 对象与方法
1.1 对象
本研究仅涉及以注册为目的的新药及医疗器械临床试验项目,不包括体外诊断试剂的临床研究。2012年以来,在本伦理委员会审查的符合上述条件的多中心临床试验项目中,剔除伦理审查未通过、尚未签署合同或入组受试者、时间信息不完整的项目后,本研究共分析246项,含我院为组长单位的项目74项,我院为参加单位的项目172项。我院为参加单位的项目中,采用会议审查方式的96项,采用快速审查方式的76项。
1.2 方法
1.2.1 分组。
回顾性分析多中心临床试验的审批各个环节的耗时情况。以我院为组长单位的项目为A组,我院作为参加单位的项目为B组。在B组中,采用会议审查方式的为B1组,采用快速审查方式的为B2组。项目一般情况信息来源于国家食品药品监督管理总局下发的临床试验批件或我院药物/医疗器械临床试验立项申请单。
1.2.2 项目审批的流程。
项目审批需经历立项、伦理审查、签署合同、启动试验等流程。本研究中用于分析时间消耗的信息来源于我院临床试验管理信息系统,项目审批总时间定义为从项目立项至首例受试者入组时间,伦理审查时间为立项至获得伦理批准的时间,签署合同时间为伦理批准至合同签署完成的时间,启动试验时间为合同签署完成至首例受试者入组时间(图1)。

图1 多中心临床试验项目审批流程
1.2.3 项目伦理审查方式。
所有项目均需经过我院伦理委员会审查。我院为组长单位的项目均采用会议审查方式。按照我院伦理委员会的审查规定,我院为参加单位且组长单位已审查通过的项目可采用快速审查方式,也可以应申办方要求或主审委员建议采用会议审查方式。
1.2.4 日期计算。
本研究中所有时间均根据自然日计算。时间比例为消耗时间占项目总时间的比例。
1.2.5 统计方法。
2 结果
2.1 项目一般情况
A组与B组项目在试验类型、类别、期别等方面大致相同。新药临床试验项目占本研究的绝大多数,医疗器械临床试验仅占10%~20%。试验药物性质大多为化学药物,少数生物制品,极少数中药/天然药。两组均以III期临床试验为主,约占2/3,其次依次为II期、IV期和I期临床试验。A组申办方性质为国内企业的占58.1%,B组国内企业占37.2%。我院作为参加单位的多中心临床试验,44.2%的项目伦理审查采用快速审查的方式,具体见表1。
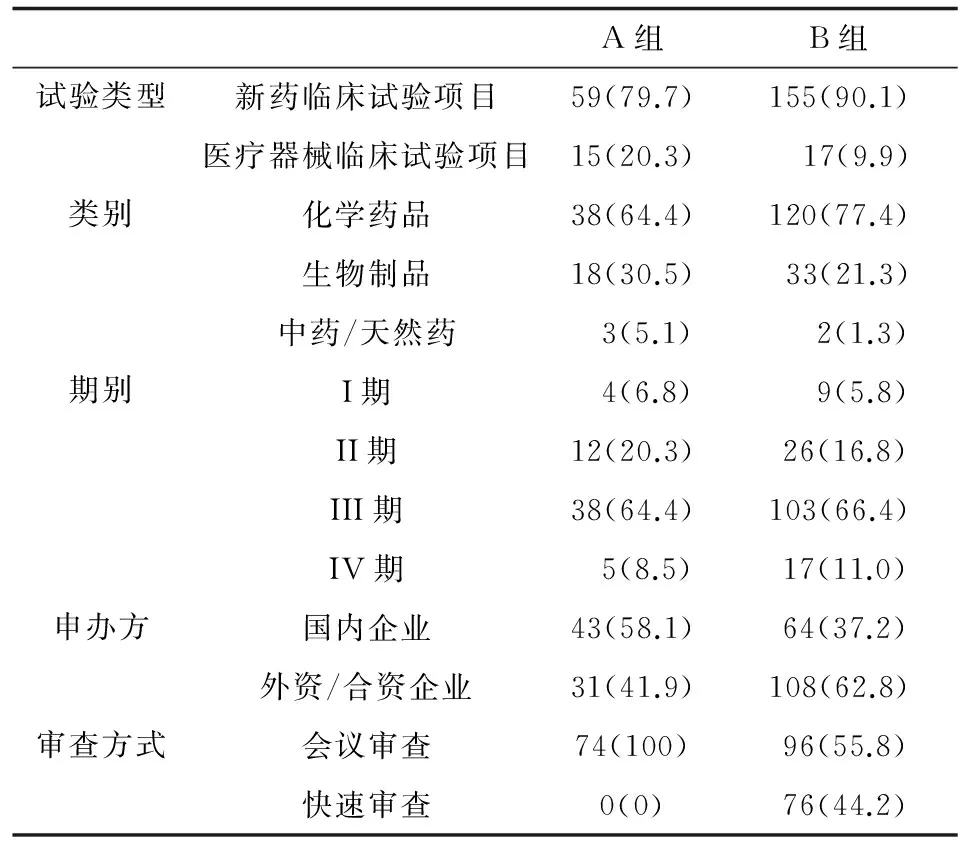
表1 项目一般情况[n(%)]
2.2 审查耗时情况
2.2.1 各阶段审查时间。
对于本研究分析的所有项目,在审批过程的三个环节中,签署合同耗费的时间最长,约占审批总时间的41%,伦理审查耗费的时间最短,约占审批总时间的23.2%。无论是否组长单位,各环节耗时的分布相似(图2)。是否组长单位对项目总时间、伦理审查、合同签署以及项目启动所需时间未见显著性影响 (表2) 。

图2 各阶段审查时间所占比例(%)
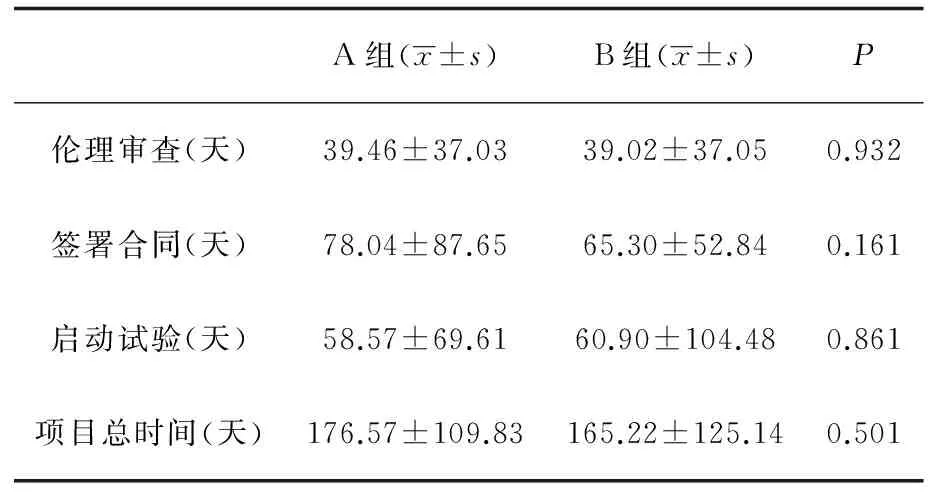
A组(x±s)B组(x±s)P伦理审查(天)39.46±37.0339.02±37.050.932签署合同(天)78.04±87.6565.30±52.840.161启动试验(天)58.57±69.6160.90±104.480.861项目总时间(天)176.57±109.83165.22±125.140.501
2.2.2 不同伦理审查方式对项目审批效率的影响。
在B组的项目中,采用快速审查方式的项目总时间明显缩短(P<0.05)。项目总时间的缩短主要是由于在伦理审查的环节,快速审查比会议审查耗时平均缩短20天,两组间具有显著性差异(P<0.01),而签署合同和启动项目的耗时与伦理审查方式无关(表3)。
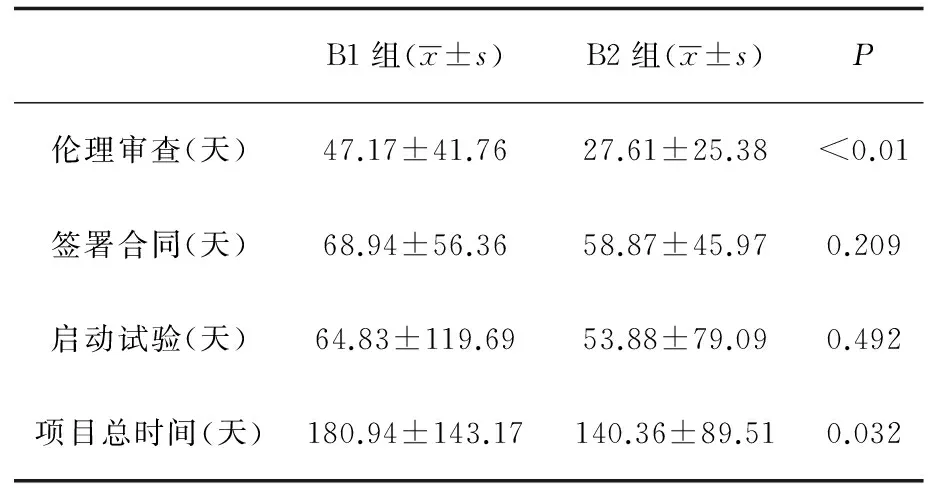
表3 不同伦理审查方式对审查时间的影响
2.2.3 组长单位审批通过至参加单位递交的时间。
在B2组的项目中,自组长单位伦理审查批准到资料递交至我院,平均耗时96.54天,相当于项目在我院项目审批平均总时间的69%,明显高于其他三个环节中的任何一个(图3)。
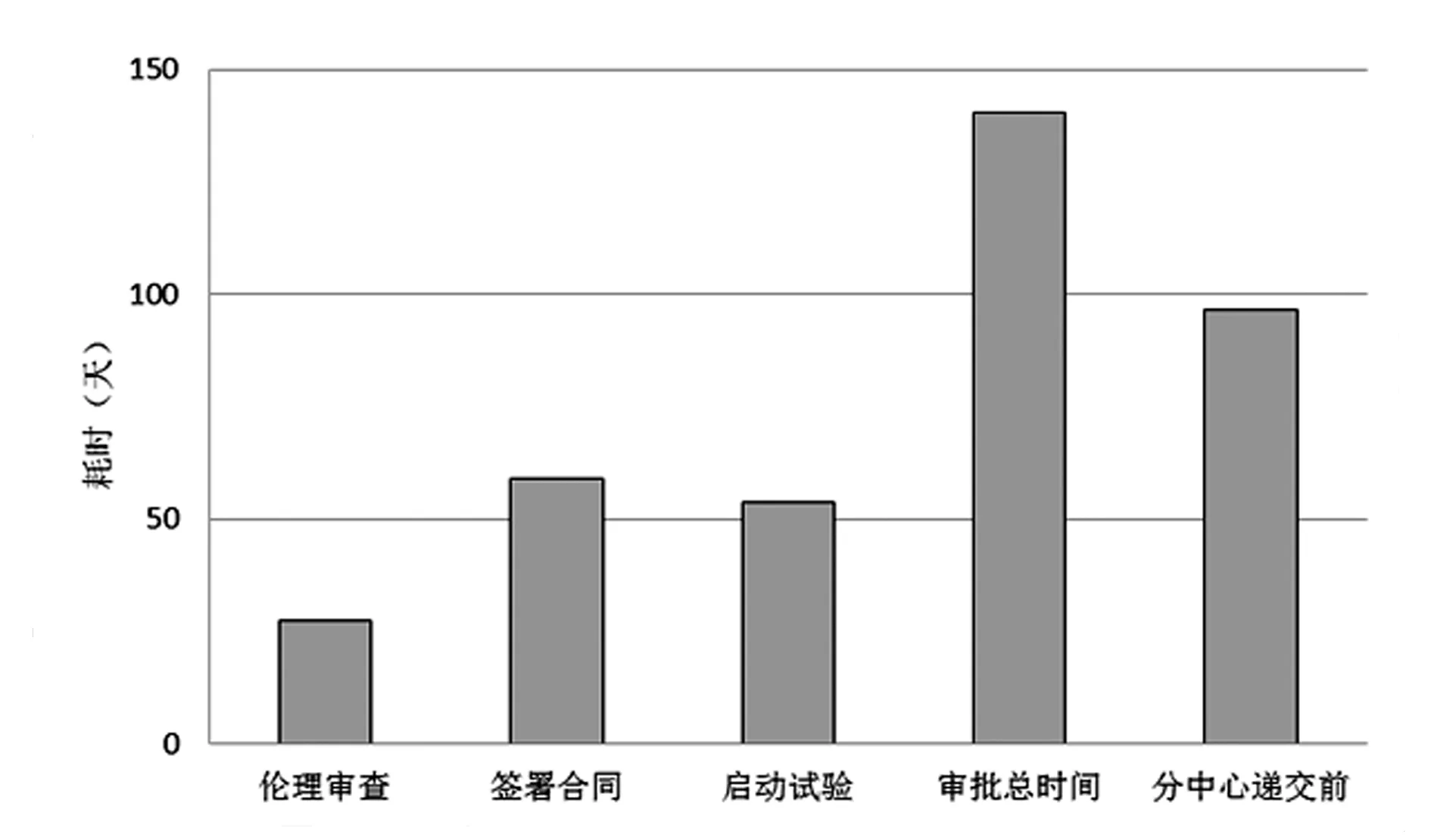
图3 参加单位伦理审查各阶段耗时
3 讨论
多中心试验中同一试验方案在不同中心进行,审批过程中既要保证方案在各中心之间保持一致,又要兼顾各中心的特殊性,其审批复杂性无疑会大大高于单中心试验。既往的研究中对多中心临床试验审批,大多重点关注伦理审查的环节。伦理审查固然是审批的一个重要环节,但影响审查效率的还有合同审批和项目启动的环节。
在纳入本研究的项目审批过程的三个环节中,签署合同耗费的时间最长,占项目审批总时间的41%,伦理审查耗费的时间最短仅占23.2%。国外的一项回顾性研究也同样发现签署合同消耗的时间对研究启动延迟影响最大,而伦理审查耗时仅占项目启动总时间的25%[5]。因此,本研究的结果提示从审批环节中耗时最长的环节入手,切实缩短合同审批耗时,可能对于提高项目审批效率起到事半功倍的作用。各临床试验机构可以制定合同模板、提供合同审批注意事项、设立专人负责合同审批、优化合同审批流程、建立良好的沟通反馈机制。同时申办方或合同研究组织应该关注各中心的合同审批要求、加强与机构的沟通、改善内部流程、减少无必要的反复修改以及在申办方内部的时间消耗,将会大大有利于缩短临床试验耗时。
此外,项目启动时间较长也不容忽视。在伦理审查已经通过、合同已经签署的前提下,目前启动项目仍需较长时间,成为项目审批中耗时第二多的环节,这往往是准备不足造成的,而这部分时间应该非常容易被缩短。只要申办方和研究者在筹备项目的过程中做好充分准备,以求在伦理和合同审批完成后尽快开始启动试验。
多中心临床试验中,现有的伦理审查体系导致资源浪费和审查延迟、审批效率不高一直被诟病[3]。甚至于在一项对于主要研究者的调查中,有1/3的研究者认为伦理委员会阻碍了医学创新[4]。因此,加速伦理审查,提高项目的审批效率成为研究参与各方的共同愿望。伦理审查是项目审批环节中的重要一环。多中心临床试验采用何种伦理审查模式,在国内外业界一直存在争议且无统一的法规规定。中心伦理审查的模式有助于提高多中心临床试验的审查效率并减少花费[6],而参加单位伦理委员会分别审查的最大优势就是熟悉本机构临床试验实施环境和流程,了解负责或参与临床试验研究者的资格与经验、了解他们是否有充分的时间开展临床试验、人员配备及设备条件等是否符合试验要求[7]。中心伦理审查模式虽然效率较高,但难免有“一言堂”的嫌疑,不利于采纳多方意见,在美国并未被广泛采用[8],国内采用的也较少[9]。目前国内多中心临床试验的伦理审查模式主要有:各中心分别审查、组长单位审批后分中心备案、组长单位审批后分中心再审。它们各有利弊,并且分别适合不同规模和能力的伦理委员会,受篇幅和内容的限制,本文不对哪种方式更为合理展开讨论。
由于在我中心,所有项目均需经过我院伦理委员会审查,同时为了在保证审查质量的前提下,提高审查效率,允许对已经被组长单位伦理委员会审查批准的项目采用快速审查,因此分析在这种审查模式下,是否能提高审批效率,可为探索多中心试验的审查提供一定依据。本研究发现,对于组长单位已经批准通过的项目,参加单位如果需要再审查,不同的伦理审查方式对项目的审批效率可产生显著的影响。在B组的172个项目中,有55.8%的项目采用会议审查,44.2 %的项目采用快速审查。而采用快速审查方式的项目,平均伦理审查时间比会议审查项目缩短20天,从而显著提高了总审查效率(P<0.05)。目前国内的法规对于多中心临床试验的伦理审查方式未做出明确规定。虽然2010版《药物临床试验伦理审工作指导原则》中规定的可采用快速审查方式的情形中并未包含这一情况[10],但在2016年颁布的《医疗器械临床试验质量管理规范》中对于多中心临床试验的伦理审查则规定,“参加试验的其他临床试验机构伦理委员会在接受牵头单位伦理委员会审查意见的前提下,可以采用会议审查或者文件审查的方式”[11],从而使参加单位在伦理审查时选择不同的审查方式有了一定的法规依据。我院伦理委员会依据法规的规定,结合审查项目的风险程度确定审查方式。国外的研究证实,多中心临床试验方案在不同中心分别审查时,几乎不会或很少对方案进行修改,我们也认为组长单位审查通过的项目,其科学性和伦理性应该已经有了基本的保证,因此,为简化审查流程、提高审查效率,对这类项目进行快速审查,在审查质量上,可以避免不审查直接备案带来的由于单中心审查局限性而导致的担忧,在审查效率上,又可以避免重复会议审查带来的时间浪费。
我们的研究中还发现,在我们医院作为参加单位的项目中,组长单位伦理审查批准后,平均需要 96.54天项目资料才递交到我院。这段时间虽然不是我中心可以控制的,但耗时之长,已相当于该类项目在我院总审批时间的2/3,显著长于项目到达我院后任何一个审批环节的耗时。既然组长单位伦理已经批准,说明项目的前期准备工作已经全部完成,在这个环节消耗时间完全没有必要,而这部分时间在既往的各种分析讨论中几乎从未被提及。无论是组长单位还是参加单位,申办方应该了解各分中心的递交要求,做好充分的准备,前期准备工作完成后及时递交伦理审查,也可以大大提高试验审批效率。
总之,多中心临床试验的审批环节中耗时最多的合同审批对于提高效率不容忽视。尽管多中心临床试验的伦理审批有其特殊性,哪种审查模式最优尚无定论,但在组长单位伦理批准后,各参加单位如果采用快速审查的方式,同时敦促申办方在准备工作完成后尽快提交审查将有望提高审查效率。
[1] 药物临床试验质量管理规范(2003)[EB/OL].(2003-08-06)[2016-12-30].http://www.sda.gov.cn/WS01/CL1031/24473.html.
[2] 李栋.国际多中心药物临床试验伦理审查的困境与对策研究[J].中国医学伦理学,2014,27(1):38-40.
[3] Stryjewski TP, Kalish BT, Silverman B,et al. The Impact of Institutional Review Boards (IRBs) on Clinical Innovation: A Survey of Investigators and IRB Members [J]. J Empir Res Hum Res Ethics,2015,10(5):481-487.
[4] Winkler SJ, Witte E, Bierer BE. The Harvard Catalyst Common Reciprocal IRB Reliance Agreement: an innovative approach to multisite IRB review and oversight [J]. Clin Transl Sci,2015,8(1):57-66.
[5] Alice M. Mascette. Are Central Institutional Review Boards the Solution? The National Heart, Lung, and Blood Institute Working Group's Report on Optimizing the IRB Process [J]. Acad Med,2012,87(12): 1710-1714.
[6] Wagner TH, Murray C, Goldberg J,et al. Costs and benefits of the National Cancer Institute Central Institutional Review Board [J]. J Clin Oncol 2010, 28(4):662-666.
[7] 梁伟雄. 药物临床试验中不同伦理审查模式的比较[J].中国医学伦理学,2014,27(3):330-332.
[8] Christian MC, Goldberg JL, Killen J, et al. A central institutional review board for multi-institutional trials [J]. N Engl J Med,2002, 346(18):1405-1408.
[9] 黄瑾,刘厚臣,胡晋红.中国大陆部分多中心临床试验伦理审查模式现状调查[J].第二军医大学学报,2009,30(10):1182-1185.
[10] 药物临床试验伦理审查工作指导原则[EB/OL].(2010-11-02)[2016-12-30].http://www.sda.gov.cn/WS01/CL0055/55613.html.
[11] 医疗器械临床试验质量管理规范(2016)[EB/OL].(2016-03-26)[2016-12-20]. http://www.sda.gov.cn/WS01/CL0051/148080.html.
DiscussiononHowtoImprovetheApprovalEfficiencyofMulticenterClinicalTrials
BAIHua,SUNYan,SONGYajing,ZHONGWen
(ClinicalPharmacologyResearchCenter,PekingUnionMedicalCollegeHospital,Beijing100032,China,E-mail:baih@pumch.cn)
Objective: To analyze the time consumption in the review of multicenter clinical trials and to explore the methods of improving the approval efficiency.MethodsWe retrospectively analyzed 246 multicenter clinical trials approved by our hospital from 2012. Group A were trials that our hospital was the leading site while group B were those not. In group B, trials were divided into group B1 (conference review) and B2 (expeditedreview)according to the ethical review methods. Each group’s ethical review time, contract signature time, starting experiment time, the total time consumption of review, and the time from the leading site approving to the participating site submitting application were analyzed.ResultsIn the review of multicenter clinical trials, contract signature cost the most time, accounting for 41%.There was no significant difference in terms of whether to be the leading site. The total time consumption of group B1 and group B2 was 180.94 days and 140.36 days (P<0.05), respectively. The average ethical review time of group B1 was about 20 days longer than group B2 (P<0.01). There were 96.54 days that the leading site submitted review materials to the participating site after approved.ConclusionsIn multicenter clinical trials, for those the leading site has already approved, immediate submission to participating site and choosing the expedited review method may improve the ethical review efficiency, thereby shorten the total approval time consumption.
Multicenter Clinical Trials; Approval Efficiency; Ethical Review
R197.32
A
1001-8565(2017)07-0859-05
10.12026/j.issn.1001-8565.2017.07.15
2017-03-31〕
2017-05-20〕
〔编 辑 吉鹏程〕
