CKLF1-C19对昆明小鼠的急性毒性研究
2018-01-02陈晓雯石燕情谭亚夏
朱 琦,陈 涛,刘 蓉,,孙 红,陈晓雯,龙 航,石燕情,谭亚夏*
(1.呼吸疾病国家重点实验室,广州医科大学附属第一医院,广州 510120; 2.广州医科大学附属第一医院检验科,广州 510120; 3.广州医科大学附属第一医院病理科,广州 510120)
CKLF1-C19对昆明小鼠的急性毒性研究

(1.呼吸疾病国家重点实验室,广州医科大学附属第一医院,广州 510120; 2.广州医科大学附属第一医院检验科,广州 510120; 3.广州医科大学附属第一医院病理科,广州 510120)
目的研究趋化素样因子1(CKLF1)的多肽CKLF1-C19对昆明小鼠的急性毒性作用。方法以25 mL/kg的CKLF1-C19(100 μg/mL、1 mg/mL、10 mg/mL三种浓度)剂量注射实验组小鼠,对照组则给予同等体积生理盐水,给药后隔天记录小鼠的体重变化,密切观察实验组小鼠的一般状况。结束实验后留取小鼠腹主动脉血检测肝肾功能;留取肝、肾、脾、肺组织观察外观、做HE染色及常规组织病理学检查。结果两组小鼠一般状况良好,体重缓慢增长,两组小鼠体重变化差异无显著性(P> 0.05),14 d后均无死亡情况;两组小鼠肝肾功能相关的血液生化结果差异无显著性(P> 0.05);肉眼观察两组小鼠心脏、肝、肾、脾、肺等脏器正常, 肝、肾、脾、肺组织HE染色后结构清晰,未见异常。结论CKLF1-C19对小鼠无急性毒性作用。
CKLF1;急性毒性;小鼠
趋化素样因子1(chemokine-like factor 1,CKLF1)是我国北京大学人类疾病基因研究中心在国际上首次报道的一个新的人类细胞因子[1],具有自主知识产权。CKLF1具备趋化因子CC亚家族的特征性结构[1],含有两个CKLF1的分泌型多肽CKLF1-C19和C27[2]。CKLF1及其两个多肽的功能性受体都是CCR4[2, 3]。我们的前期研究发现CKLF1在哮喘患者的气道黏膜中高表达[4],CKLF1基因导入可引发小鼠支气管肺的炎性损伤改变,其部分病变极似哮喘气道重塑的病理表现[5, 6]。进一步的研究发现CKLF1-C19具有抑制哮喘小鼠肺部炎症及降低小鼠过敏性鼻部炎症反应的作用[7, 8],因而推测CKLF1-C19可能通过与CKLF1竞争CCR4受体而达到抑制炎症的作用。本试验通过单次尾静脉注射CKLF1-C19,观察动物的急性毒性反应,以探讨CKLF1-C19使用的安全性,从而为生产具有我国自主知识产权的新药奠定实验基础。
1 材料和方法
1.1实验动物
SPF级昆明小鼠,体重21~24 g,雌雄各半,来源于广东省医学实验动物中心 [SCXK (粤) 2013-0002],动物合格证号:00002006。小鼠分笼饲养于广州医科大学呼吸疾病国家重点实验室的动物实验室屏障环境 [SYXK (粤) 2013-0093]。小鼠的饲养温度为25℃~28℃,相对湿度为50%~60%。实验前进行适应性饲养1周。并按实验动物使用的3R原则给予人道主义关怀。
1.2主要试剂与仪器
CKLF1-C19多肽,深圳瀚宇药业股份有限公司合成。
DM 4000B显微镜,RM2235石蜡切片机,染色盖片工作站ST5020均购自德国Leica公司;全自动生化分析仪购自美国Beckman公司。
1.3实验方法
1.3.1 预实验
取雌性昆明小鼠15只,随机均分为3组,实验前禁食12 h,自由饮水[9]。将CKLF1-C19用生理盐水配置成100 μg/mL、1 mg/mL、10 mg/mL三组不同浓度的试药。按25 mL/kg给药体积单次尾静脉注射给药后,连续观察14 d,记录各小鼠的一般情况和不良反应。
1.3.2 急性毒性试验
预实验结果显示,各组小鼠均无死亡,无法计算其半数致死量(median lethal dose)LD50值,遂采用最大耐受量实验。依据小鼠最大耐受量0.5 mL/20 g[10]及注射浓度20 mg/mL计算,实验组小鼠CKLF1-C19用量为0.5 mL/20 g,相当于8 mg/只。前期报道CKLF1-C19治疗哮喘小鼠的有效浓度为1~100 μg/只[7],则本实验的给药浓度已达到最高有效浓度的80倍。
实验选取40只昆明小鼠,随机均分为给药组和对照组,雌雄各半。小鼠禁食不禁水12 h后,给药组按上述用量给药,对照组予同等体积生理盐水。给药后隔天记录小鼠体重,密切观察小鼠的皮毛、行为活动、进食饮水、眼口鼻分泌物、呼吸等一般状况,及有无竖毛、步伐不稳、四肢瘫痪、惊厥、呼吸抑制等不良反应甚至死亡现象。连续观察14 d[11]。
1.3.3 生化指标检测
给药后第15天,麻醉小鼠进行腹主动脉采血,全血离心后取上清,应用全自动生化仪检测小鼠血清中肝肾功能相关的生化指标,即血清尿素氮(blood urea nitrogen,BUN)、肌酐(creatinine,CRE)、谷丙转氨酶(alanine transaminase,ALT)、谷草转氨酶(aspertate aminotransferase,AST)、总蛋白(total protein,TP)、白蛋白(albumin,ALP)、总胆固醇(total cholesterol,TCHO)、甘油三酯(triglyceride,TG)。
1.3.4 病理学检查
实验期间无小鼠死亡现象,实验结束后处死小鼠并解剖,肉眼观察小鼠心脏、肝、肾、脾、肺等器官有无明显病变。将肝、肾、脾、肺组织置于4%中性甲醛中固定,梯度乙醇脱水,石蜡包埋,5 μm连续切片,HE染色,常规组织病理学检查。
1.4统计学方法
2 结果
2.1小鼠一般体征观察及体重变化情况
实验过程中,两组小鼠均皮毛光洁、无竖毛现象。小鼠活动自如,未见步伐不稳、烦躁不安、肌肉震颤、僵直或强迫运动。无呼吸急促或过缓,眼口鼻无异常分泌物,大便结实,进食量及摄水量正常无改变,两组小鼠均无死亡情况。
两组小鼠体重均缓慢增长,趋势基本一致,组间差异无显著性(P> 0.05)(图1)。
2.2血液生化指标
实验组小鼠的BUN、CRE、ALT、AST、TP、ALP、TCHO、TG与对照组比较,组间差异无显著性(P> 0.05)(表1)。
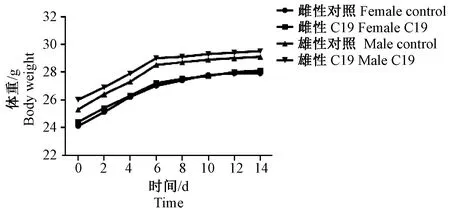
图1 14 d急性毒性试验对小鼠体重的影响Fig.1 Effect of CKLF1-C19 on body weight of mice observed for 14 days during the acute toxicity test

Tab.1Comparison of blood biochemical indexes in the mice

组别Groups尿素氮/mmol/LUreanitrogen肌酐/μmol/LCreatinine谷丙转氨酶/U/LAlaninetransaminase谷草转氨酶/U/LAspartateaminotransferase总蛋白/g/LTotalprotein白蛋白/g/LAlbumin总胆固醇/mmol/LTotalcholesterol甘油三酯/mmol/LTriglyceride实验组Experimentalgroup10.2±3.1*21.5±8.5*39.9±10.3*111.7±20.4*41.3±4.0*21.5±8.4*1.63±0.4*0.65±0.28*对照组Controlgroup9.1±3.721.9±8.040±11.2101.2±27.437.5±8.222.0±8.01.63±0.40.70±0.20
注:与对照组相比,*P> 0.05。
Note. Compared with the control group,*P> 0.05.
2.3小鼠主要脏器肉眼观察及组织病理改变
肉眼观察实验组小鼠心脏、肝、肾、脾、肺等器官色泽明亮,质地鲜嫩,未见脏器明显的肿大、萎缩、充血、出血、水肿或坏死及其他病理改变,与对照组比较未见明显差异。小鼠肝、肾、脾、肺的石蜡切片采用HE染色,光学显微镜下观察肝、肾、脾、肺的组织形态结构:实验组小鼠肝小叶结构清晰,中央静脉结构正常,肝窦和肝索清晰可见;肾小球轮廓清晰,结构完整,系膜未见增宽,未见炎性细胞浸润;脾结构完整,脾索、脾血窦及脾内淋巴小结均清晰可见;肺组织结构清晰,肺泡结构完整,肺泡腔内未见渗出,肺间质未见炎性细胞浸润。上述各组织学观察均与对照组无明显差异(图2)。

注:实验组肝(A)、肾(C)、脾(E)、肺(G);对照组肝(B)、肾(D)、脾(F)、肺(H)。标尺长度为5 μm。图2 14 d急性毒性试验小鼠肝、肾、脾及肺组织HE染色结果Note. Tissues of liver (A), kidney (C), spleen (E) and lung (G) in the experimental group; Tissues of liver (B), kidney (D), spleen (F) and lung (H) in the control group. Bars=5 μm.Fig.2 Pathological changes of liver, kidney, spleen and lung tissues in the mice at 14 days during the acute toxicity test. HE staining
3 讨论
近50年来,过敏性疾病的发病率一直不断上升。大多数发达国家已有超过20%的人口罹患过敏性疾病[12]。其中,支气管哮喘和过敏性鼻炎是发病率上升最快的疾病[10],全球患病人数已分别高达4亿人和3亿人[12],已然成为严重威胁公众健康的主要慢性病之一。目前临床上治疗过敏性疾病的药物绝大多数是糖皮质激素和各种免疫抑制剂,但这些药物长期使用易导致患者免疫功能的损伤,增加感染风险。此外对激素抵抗的过敏性疾病仍缺乏有效的治疗手段。因此,开发有效且副作用少的新型药物实为必要。
CKLF1是我国学者首次报道的一个新的人类细胞因子[1],对人中性粒细胞、淋巴细胞和单核细胞均有明显的趋化活性[1],其功能性受体为CCR4[3]。本课题组的前期研究显示CKLF1在哮喘患者的气道黏膜中高表达[4]。将CKLF1基因导入小鼠体内,可引发小鼠类似哮喘气道重塑的病理变化[5, 6]。CKLF1-C19是CKLF1的C端衍生肽,其功能性受体亦是CCR4[2]。相关研究表明,CKLF1-C19可显著抑制哮喘小鼠肺部炎症及降低小鼠过敏性鼻部炎症反应[7, 8]。此外,新近研究发现,CKLF1-C19还可减轻特应性皮炎小鼠表皮增厚、真皮血管扩张充血、炎性细胞浸润等症状,上调小鼠皮损中部分调节炎症细胞因子特定基因表达的microRNA[13]。推测CKLF1-C19是通过部分地抑制其它趋化因子与CCR4受体的结合,从而抑制了小鼠体内的炎症和超敏反应,因此有望在治疗过敏性疾病所致的炎症中发挥作用。
药物临床前安全性评价是判断其能否进入临床研究的关键,是评估药物临床研究的风险程度及其开发价值的重要参考依据[14-18]。而急性毒性试验是研究和确认药物对机体毒效性的第一步,它指在24 h内单次或多次大剂量给予受试物后,观察实验动物发生的各种中毒表现及严重程度,以测定药物的半数致死量LD50及相关参数的试验[19]。因预实验中无小鼠死亡,无法计算CKLF1-C19半数致死量LD50值,故本实验采用最大耐受量测定法,即用最大给药浓度和最大给药容量单次或24 h内数次给药,观察动物出现的毒性反应[10]。本实验中CKLF1-C19给药量为8 mg/只,是CKLF1-C19最大有效剂量100 μg/只的80倍。实验期间,小鼠活动饮食等一般情况无异常,体重正常增长。
肝脏和肾脏是参与药物代谢与排泄的主要器官,也是药物毒副作用的主要靶器官,药物源性的肝肾毒性是制约药物开发和临床应用的最大障碍。为了考察CKLF1-C19的肝肾毒性,本实验进行了肝肾及其它重要器官的病理切片观察以及与肝肾功能相关的生化指标检测。实验结束后,肉眼观察小鼠脏器均未发现明显病变现象,肝、肾、脾、肺的病理切片也未发现组织结构的异常。BUN、CRE、ALT、AST等多项生化指标均未发现异常改变。综上所述,CKLF1-C19对小鼠无急性毒性作用。
多肽药物是一类以氨基酸为基本结构单位而发展起来的新型药物。与传统的化学合成药相比,多肽药物拥有良好的特异性和耐受性,药用效价比高,毒性反应弱,在体内不易产生蓄积等优势[20, 21],目前已成为新药研发和生产的热点之一。本实验所用CKLF1-C19多肽是受专利保护的具有良好应用前景的新结构新机制的生物技术药物,本实验结果为CKLF1-C19的合理开发与利用提供了有益的实验依据。
[1] Han W, Lou Y, Tang J, et al. Molecular cloning and characterization of chemokine-like factor 1 (CKLF1), a novel human cytokine with unique structure and potential chemotactic activity [J]. Biochem J, 2001, 357: 127-135.
[2] Wang Y, Zhang Y, Han W, et al. Two C-terminal peptides of human CKLF1 interact with chemokine receptor CCR4 [J]. Int J Biochem Cell Biol, 2008, 40(5): 909-919.
[3] Wang Y, Zhang Y, Yang X, et al. Chemokine-like factor 1 is a functional ligand for CC chemokine receptor 4 (CCR4) [J]. Life Sci, 2006, 78(6): 614-621.
[4] Tan Y, Ma D, Han W, et al. Chemokine-like factor 1, a novel human cytokine, contributes to the airway remodeling in asthma [C]. Abstract Book, 3rd Triennial World Asthma Meeting. Chicago, 2001.
[5] 谭亚夏, 钟南山. 趋化素样因子1在支气管肺损伤与重建中的作用 [J]. 中华结核和呼吸杂志, 2002, 25(7): 433.
[6] Tan Y, Han W, Chen Y, et al. Chemokine-like factor 1, a novel cytokine, contributes to airway damage, remodeling and pulmonary fibrosis [J]. Chin Med J (Engl), 2004, 117(8): 1123-1129.
[7] Tian L, Li W, Wang J, et al. The CKLF1-C19 peptide attenuates allergic lung inflammation by inhibiting CCR3- and CCR4-mediated chemotaxis in a mouse model of asthma [J]. Allergy, 2011, 66(2): 287-297.
[8] Zheng Y, Guo C, Zhang Y, et al. Alleviation of murine allergic rhinitis by C19, a C-terminal peptide of chemokine-like factor 1 (CKLF1) [J]. Int Immunopharmacol, 2011, 11(12): 2188-2193.
[9] 俞发荣, 张诗爽, 张振南, 等. 玛咖提取物对小鼠毒性及免疫器官的影响 [J].中国实验动物学报, 2016, 24(3): 279-282.
[10] 周立国. 药物毒理学 [M]. 第2版. 北京: 中国医药科技出版社, 2009: 131-148.
[11] 贺银丽, 郭珣, 赵显莉, 等. PPARα转基因小鼠在药物毒性评价中的应用 [J]. 中国实验动物学报, 2015, 23(3): 316-320.
[12] Pawankar R, Canonica GW, Holgate ST, et al. WAO White Book on Allergy Exacutive Summary: Update 2013 [Z]. World Allergy Organization, 2013.
[13] 赵娟, 马晨丽, 兰元翎, 等. CKLF1拮抗肽C19在小鼠特应性皮炎中的作用研究 [J]. 临床和实验医学杂志, 2014, 13(21): 1748-1752.
[14] 任进. 国际毒性病理学研究的新趋势新要求 [J]. 中国药理学与毒理学杂志, 2013, 27(3): 451.
[15] 廖明阳. 与时俱进应对药物毒理学模式转变的机遇与挑战 [J]. 中国药理学与毒理学杂志, 2013, 27(3): 452.
[16] 马璟, 李华. 纳米药物的安全性评价 [J]. 中国药理学与毒理学杂志, 2013, 27(3): 452-453.
[17] 汪巨峰. 新药临床前心血管毒理学评价研究 [J]. 中国药理学与毒理学杂志, 2013, 27(3): 453.
[18] 岑小波. 生物仿制药临床前安全研究与评价 [J]. 中国药理学与毒理学杂志, 2013, 27(3): 454.
[19] To T, Stanojevic S, Moores G, et al. Global asthma prevalence in adults: findings from the cross-sectional world health survey [J]. BMC Public Health, 2012, 12: 204.
[20] Fosgerau K, Hoffmann T. Peptide therapeutics: current status and future directions [J]. Drug Discov Today, 2015, 20(1): 122-128.
[21] 厉保秋. 多肽药物研究与开发 [M]. 第1版. 北京: 人民卫生出版社, 2011: 1-50.
ExplorationofacutetoxicityeffectofCKLF1-C19onKMmice

(1.State Key Laboratory of Respiratory Disease; 2.Department of Clinical Laboratory; 3.Department of Pathology; the First Affiliated Hospital of Guangzhou Medical University, Guangzhou 510120, China)
ObjectiveTo explore the acute toxicity effect of CKLF1-C19, a polypeptide of chemokine-like factor 1 (CKLF1), on the KM mice.MethodsA total of 40 KM mice, half male and half female, were randomly divided into 2 groups. The mice in the experimental group were injected with CKLF1-C19 at a dose of 25 mL/kg (100 μg/mL, 1 mg/mL and 10 mg/mL) through the tail vein, and those in the control group
an equal volume of sterile saline solution. Changes in the body weight of the mice were recorded the day after treatment, and the general conditions of mice in the experimental group were observed closely and compared with the normal group. Then blood samples were taken from the abdominal aorta to measure liver and kidney function. Tissue samples of liver, kidney, spleen and lung were taken for histopathological examination by HE staining.ResultsIn the maximum tolerance test, the mice of the two groups were in good condition, and their body weight was increased gradually, without significant difference between the experimental group and the control group (P> 0.05). There was no death within 14 days. The blood biochemical indexes of liver and kidney function showed no significant differences between the two groups (P> 0.05). The gross appearances of heart, liver, kidney, spleen and lung were normal in the two mouse groups, and the pathological examination with HE staining showed normal clear structure with no obvious changes in these organs of each group.ConclusionsOur results demonstrate that CKLF1-C19 has no acute toxicity effect on mice.
CKLF1; Acute toxicity; Mice
广州呼吸疾病国家重点实验室开放课题项目(编号:2014SKLRD-O04)。
朱琦(1986 -),男,硕士,住院医师,研究方向:肺炎性损伤与重塑。E-mail: negu@163.com
谭亚夏(1955 -),女,教授,研究方向:肺炎性损伤与重塑。E-mail: yaxiatan@vip.163.com
R-33
A
1671-7856(2017) 11-0019-05
10.3969.j.issn.1671-7856. 2017.11.005
2016-12-14
