卡介苗对膀胱肿瘤细胞及代谢产物的作用影响
2017-11-29吴金生郑传秋王清明孙立江
吴金生,郑传秋,王清明,纪 萌,孙立江*
(1.青岛大学,山东 青岛 266071; 2.潍坊医学院,山东 潍坊 261053)
卡介苗对膀胱肿瘤细胞及代谢产物的作用影响
吴金生1,郑传秋2,王清明2,纪 萌2,孙立江1*
(1.青岛大学,山东 青岛 266071; 2.潍坊医学院,山东 潍坊 261053)
目的探究 卡介苗对膀胱肿瘤细胞及代谢产物的作用和影响,对卡介苗治疗膀胱肿瘤细胞的可能机制进行初步的探索。方法通过膀胱灌注N-甲基亚硝基脲(MNU)诱导并建立大鼠的膀胱肿瘤模型,将膀胱肿瘤细胞和正常移行上皮细胞进行原代培养。按照培养液的不同成分将其分为5组,利用酶联免疫吸附试验(ELISA)法检测各组细胞上清液中的肿瘤坏死因子-α(TNF-α)、白细胞介素-10(IL-10)的浓度。利用噻唑蓝(MTT)法测定卡介苗抑制肿瘤细胞生长的药物浓度。利用末端脱氧核苷酸转移酶介导缺口末端标记法(TUNEL)检测细胞凋亡情况。结果在灌注的15只大鼠中,2只大鼠在灌注2次后死亡,3只大鼠灌注3次后死亡,解剖死亡大鼠均未发现明显的肿瘤。再对其余10只大鼠完成膀胱灌注后,其中8只大鼠解剖后发现有明显的肿瘤。MTT结果显示:卡介苗对膀胱肿瘤细胞的生长具有抑制作用,其抑制率与卡介苗的浓度呈现正相关。ELISA检测各组细胞上清液中TNF-α浓度在B组为(160.654±5.775) ng/L,D组为(124.443±4.972) ng/L的浓度,与其他三组相比差异有显著性;IL-10浓度在B组为(16.973±3.428) ng/L,E组为(20.327±2.721) ng/L,蛋白水平明显高于其他三组。各组细胞均未发现细胞凋亡。对原代膀胱肿瘤细胞的鉴定显示:利用HE染色可发现肿瘤细胞的细胞核体积增大,核浆比增高,有的可发现细胞核仁数目增加,有的细胞核呈现墨水滴样,核仁比较明显。结论卡介苗对大鼠膀胱肿瘤细胞的增长具有抑制作用,没有发生细胞凋亡,且肿瘤细胞自身分泌的IL-10、TNF-α可以参与调节。
卡介苗;膀胱肿瘤细胞;IL-10;TNF-α
膀胱癌发病率在全部肿瘤发病率中占到第八位,是位居第二的男性泌尿生殖系统肿瘤,仅次于前列腺癌,占全部恶性肿瘤的3.2%。在我国,膀胱癌在男性泌尿生殖系统肿瘤中,其发病率和死亡率均居首位,严重威胁我国人民的生命身体健康[1],且膀胱肿瘤具有高复发性。大量研究证实膀胱恶性肿瘤术后给予药物膀胱灌注治疗可以有效降低膀胱恶性肿瘤的复发率;而卡介苗(bacillus Calmette-Guérin,BCG)在目前所有的膀胱癌灌注药物中被认为是术后预防复发的最佳药物之一。卡介苗可以使肿瘤复发率降低20% ~ 65%,平均可达40%左右。国际上的一些专家将卡介苗膀胱灌注治疗称为原位癌灌注治疗中的“金标准”,但是卡介苗对肿瘤细胞的作用机制尚不明确[2]。本实验目的就是要探究卡介苗对膀胱肿瘤细胞及其代谢产物的作用影响。通过N-甲基亚硝基脲(MNU)诱导并建立了大鼠膀胱肿瘤模型,将膀胱肿瘤细胞和正常移行上皮细胞进行原代培养,按照培养液的不同成分将其分为5组,然后运用各种检测方法测定各种指标的浓度,以此来了解卡介苗对肿瘤细胞及其代谢产物产生的作用和影响,从而进一步探索卡介苗对治疗肿瘤细胞的作用机制。
1 材料和方法
1.1实验动物
SPF级SD雄性8周龄大鼠15只,体重190 ~ 210 g,由济南朋悦实验动物繁育有限公司提供 [SCXK (鲁) 2014-0007],按实验动物使用的3R原则给予人道主义关怀。
1.2主要试剂与仪器
卡介苗(BCG)(赛诺菲巴斯德,法国);N-甲基亚硝基脲(MNU)(Sigma,美国);二甲基亚砜(DMSO)(Sigma,美国);噻唑蓝(MTT)(Sigma,美国);Ⅳ型胶原酶、胰蛋白酶(Sigma,美国);1640培养液、胎牛血清(Hyclone,美国);PBS(北京索莱宝科技有限公司,中国);大鼠TNF-α ELISA试剂盒(北京欣博盛生物科技有限公司,中国);大鼠IL-10 ELISA试剂盒(北京欣博盛生物科技有限公司,中国)。
大鼠膀胱癌细胞株BIU-87(购自上海细胞库)、0.25%胰蛋白酶、MTT溶液(5 mL/mL),封闭液、固定液、通透液和工作液等,需新鲜配制。
倒置显微镜、荧光显微镜(Olympus,日本);超净工作台(大连瑞欣公司,中国);细胞培养箱(Blnder,德国);酶标仪(Bio-Rad,美国);低温离心机(Eppendorf,德国);电子天平(Sartorius,德国)。
1.3实验方法
将大鼠固定在手术台,在常规麻醉、消毒和导尿后,对大鼠进行膀胱灌注浓度为20 mg/mL的MNU溶液,每只大鼠每次灌注2 mg MNU溶液,每两周进行一次,一共四次[3]。对肿瘤细胞进行分离获取和原代培养,并按照其培养液的成分分为5组。使用含10%胎牛血清的1640基础培养液培养的肿瘤细胞为A组,使用含有卡介苗+基础培养液培养的肿瘤细胞为B组,使用基础培养液培养正常移行上皮细胞后的上清液培养的肿瘤细胞为C组,使用含卡介苗+基础培养液培养正常移行上皮细胞后的上清液培养的肿瘤细胞为D组,使用含卡介苗+基础培养液培养肿瘤细胞后的上清液培养的肿瘤细胞为E组(阴性对照组为A组和C组)。利用MTT法测定不同浓度卡介苗影响大鼠膀胱肿瘤细胞的生长情况,利用ELISA法[4]检测细胞培养液中的TNF-α和IL-10的浓度,最后利用TUNEL法进行细胞凋亡检测[5]。
1.4统计学方法
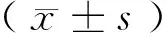

Tab.1Concentrations of IL-10 and TNF-α in the supernatant of each group

组别GroupsIL-10浓度ConcentrationofIL-10TNF-α浓度ConcentrationofTNF-αA组GroupA10.486±1.623*△△29.653±2.676B组GroupB16.973±3.428160.654±5.775△△▲▲※※C组GroupC10.479±1.807*△△25.687±2.143D组GroupD10.975±2.749*△△124.443±4.972△△▲▲※※E组GroupE20.327±2.72150.119±3.317▲▲※※
注:与B组相比,*P< 0.05;与E组相比,△△P< 0.01;与A组相比,▲▲P< 0.01;与C组相比,※※P< 0.01。
Note. Compared with group B,*P< 0.05; Compared with group E,△△P< 0.01; Compared with group A,▲▲P< 0.01; Compared with group C,※※P< 0.01.
2 结果
2.1建立大鼠膀胱肿瘤细胞模型,原代细胞培养
在灌注的15只大鼠中,2只大鼠在灌注2次后死亡,3只大鼠灌注3次后死亡,解剖死亡大鼠均未发现有明显的肿瘤。对其余10只大鼠完成膀胱灌注后,其中有8只大鼠在解剖后发现明显的肿瘤,肉眼可见膀胱壁黏膜充血,局部有米粒样或乳头样肿物;显微镜下可见膀胱上皮细胞层次增多,排列紊乱。
2.2MTT检测卡介苗对膀胱肿瘤细胞生长的抑制作用
由各孔的吸光度来计算肿瘤细胞的生长抑制率(见图1)。MTT检测的结果显示,卡介苗可以有效地抑制膀胱肿瘤细胞的生长,且其抑制作用与药物浓度呈正相关。在低浓度时(0.0625 mg/L)时抑制能力较弱,当药物浓度≥ 0.5 mg/L时呈现明显的抑制作用(P< 0.01)。

图1 卡介苗不同浓度对膀胱肿瘤细胞生长的抑制作用Fig.1 Inhibitory effects of BCG at different concentrations on the growth of bladder cancer cells
2.3利用ELISA法检测IL-10和TNF-α的浓度
在IL-10浓度的比较中,B组与A、C、D组相比差异有显著性(P< 0.05),E组与A、C、D组相比差异有显著性(P< 0.01)。见表1。
在TNF-α浓度的比较中,含有卡介苗的组(B、D、E组)和不含卡介苗的组(A、C组)间的比较,其差异有显著性(P< 0.01);不含卡介苗的A组和C组相比,差异无显著性(P> 0.05)。此外,TNF-α浓度在B组为(160.654 ± 5.775) ng/L,D组为(124.443 ± 4.972) ng/L的浓度,与A、C、E组相比差异有显著性(P< 0.01)。见表1。
2.4显微镜下观察细胞情况
显微镜下观察细胞培养情况显示,原代培养的大鼠正常移行上皮细胞贴壁,呈上皮细胞样多形性生长;原代培养的大鼠肿瘤细胞体积大,呈铺路石样,细胞核仁明显;卡介苗作用后的肿瘤细胞体积缩小,胞浆有空泡;TUNEL法检测细胞凋亡情况发现细胞体积缩小,细胞出现核碎裂、溶解,呈凋亡现象。见图2。实验结果显示,卡介苗作用后膀胱肿瘤细胞增殖速度减慢。
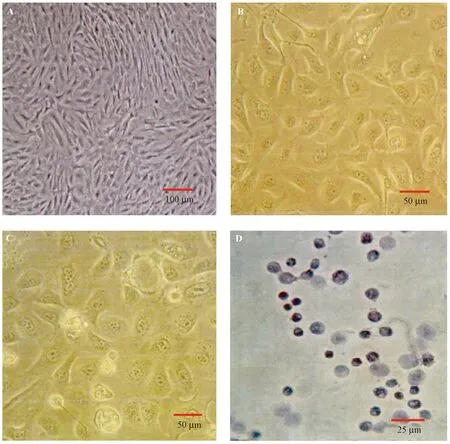
注:A:大鼠原代培养正常移行上皮细胞(× 100);B:大鼠原代培养肿瘤细胞(× 200); C:卡介苗作用后的肿瘤细胞(× 200);D:TUNEL法检测细胞凋亡(× 400)。图2 细胞培养图Note. A: Primarily cultured normal transitional epithelial cells of rats (× 100); B: Primarily cultured tumor cells of rats (× 200); C: Tumor cells after BCG treatment (× 200); D: TUNEL detection of apoptosis (× 400).Fig.2 Images of cultured cells
3 讨论
目前,膀胱肿瘤手术后辅助以膀胱灌注的治疗方法成为预防肿瘤复发的主要措施。卡介苗在目前所有的膀胱癌灌注化疗药物中被认为是术后预防复发的最佳药物之一,它在浅表性膀胱肿瘤免疫治疗中的应用取得了重大的成功[6-10]。但是,膀胱肿瘤的发病机制和膀胱灌注治疗的作用机制尚不明确实验证明,利用MNU膀胱灌注诱发膀胱肿瘤建立动物模型,方法较为简单。在前期研究中具有可操作性和实用性,且成癌率较高[4,11]。目前普遍认为卡介苗作用于膀胱肿瘤细胞的作用机制主要在于其自身的结构,还有它对树突状细胞的独特作用。卡介苗通过激发机体免疫力来达到抵抗肿瘤的作用,至今医学界一致认为是通过CD4+T细胞介导的细胞免疫发挥了它抵抗肿瘤细胞的作用。
MMT结果显示,卡介苗对膀胱肿瘤细胞具有明显的抑制作用,且和它的浓度呈正相关。在对细胞培养后的上清液的检测中可以发现,TNF-α和IF-10均发生改变,这说明了卡介苗不仅激发了机体的免疫细胞因子,调节了免疫能力,而且还使自身产生细胞因子避免了进一步的伤害。在卡介苗初次刺激膀胱肿瘤细胞之后,IL-10的浓度明显增大(B组)。再一次卡介苗刺激后,E组的IL-10浓度比B组增高。但是,当含有卡介苗成分的细胞培养后的上清液再次刺激肿瘤细胞时,其IL-10浓度却没有发生改变。这说明卡介苗初次作用于肿瘤细胞时,可以产生IL-10。如果使用其代谢产物再次刺激肿瘤细胞,则能够产生更多的IL-10。在TNF-α的浓度变化方面,当卡介苗初次刺激肿瘤细胞时能产生大量的TNF-α,而再次刺激肿瘤细胞却不能产生TNF-α,这可能是其代谢产物抑制了TNF-α的产生,甚至抵消第一次产生的TNF-α。本次实验结果显示,在单一因素卡介苗条件下,肿瘤细胞自身会通过分泌不同的细胞因子,避开免疫细胞的伤害。
综上所述,卡介苗对膀胱肿瘤细胞的生长具有抑制作用,通过抑制增殖活跃的肿瘤细胞,使其发生病理性坏死,且随卡介苗药物浓度的增加,其抑制作用也越来越强,可能打破肿瘤生长平衡的体液环境,使肿瘤细胞缩小或延缓肿瘤生长,从而达到治疗肿瘤的目的。
[1] 韩苏军, 张思维, 陈万青, 等. 中国膀胱癌发病现状及流行趋势分析 [J]. 癌症进展, 2013, 11(1): 89-95.
[2] 李彩霞, 曾星, 黄羽, 等. 猪苓及猪苓多糖协同卡介苗对膀胱癌大鼠模型腹腔巨噬细胞功能的影响 [J]. 中国免疫学杂志, 2011, 27(6): 514-517.
[3] 吴金生, 王清明, 郑传秋, 等. 姜黄素对N-甲基亚硝基脲诱发膀胱癌大鼠化学干预作用及机制分析 [J]. 中国实验动物学报, 2017, 25(5): 567-571.
[4] 秦桂芳. 猪苓汤干预BCG防治MNU致大鼠膀胱癌作用研究 [D]. 河北大学, 2016.
[5] 田斌强, 赵应梅, 王德贵, 等. 姜黄素对大鼠膀胱肿瘤的预防与治疗作用 [J]. 肿瘤, 2011, 31(11): 1004-1009.
[6] 赵雷佐. 卡介苗对大鼠膀胱肿瘤细胞作用机制的探讨 [D]. 青岛大学, 2013.
[7] 刘晶, 韩国梁, 杨晓峰, 等. Ag85A和Ag85B DNA疫苗对大鼠膀胱癌免疫治疗的效果 [J]. 中国肿瘤生物治疗杂志, 2008, 15(2): 144-149.
[8] 田平贵, 韩国梁, 杨晓峰, 等. 试验剂量Ag85A与Ag85B DNA疫苗对膀胱癌大鼠血液系统及肝肾功能的影响 [J]. 中国药物与临床, 2009, 9(5): 384-387.
[9] Langle YV, Belgorosky D, Prack McCormick B, et al. FGFR3 down-regulation is involved in bacillus Calmette-Guérin induced bladder tumor growth inhibition [J]. J Urol, 2016, 195(1): 188-197.
[10] Liu X, Dowell AC, Patel P, et al. Cytokines as effectors and predictors of responses in the treatment of bladder cancer by bacillus Calmette-Guérin [J]. Future Oncol, 2014, 10(8): 1443-1456.
[11] Svatek RS, Zhao XR, Morales EE, et al. Sequential intravesical mitomycin plus bacillus Calmette-Guérin for non-muscle-invasive urothelial bladder carcinoma: translational and phase I clinical trial [J]. Clin Cancer Res, 2015, 21(2): 303-311.
EffectofBCGonbladdercancercellsandtheirmetabolitesinrats
WU Jin-sheng1, ZHENG Chuan-qiu2, WANG Qing-ming2, JI Meng2, SUN Li-jiang1 *
(Qingdao University, Qingdao 266071, China; 2. Weifang Medical University, Weifang 261053, China)
ObjectiveTo investigate the effect of bacillus Calmette-Guérin (BCG) on bladder cancer cells and their metabolites, and to preliminarily explore the possible mechanisms of BCG in the treatment of bladder cancer.MethodsThe rat model of bladder cancer was induced by intravesical instillation with N-methylnitrosourea (MNU). Bladder cancer cells and normal transitional epithelial cells were isolated and primarily cultured, and were divided into 5 groups according to the different components of the culture medium. The concentration of tumor necrosis factor-α (TNF-α) and interleukin-10 (IL-10) in the supernatant of each group was detected by enzyme linked immunosorbent assay (ELISA). The concentration of BCG to inhibit the cancer cell growth was determined by MTT assay. Apoptosis of bladder cancer cells was detected by terminal deoxynucleotidyl transferase-mediated dUTP nick-end labeling (TUNEL).ResultsAmong the 15 rats, 2 rats died after 2 times of instillation, and 3 rats died after 3 times of instillation, without obvious tumors found at autopsy. The other 10 rats were killed after completion of the intravesically instillation of MNU, and obvious tumors were found in 8 of them after dissection. The results of MTT assay showed that BCG had an inhibitory effect on the growth of bladder cancer cells, and the inhibitory rate was positively correlated with the concentration of BCG. The results of ELISA showed that the concentrations of TNF-α in the supernatant of groups B and D were (160.654±5.775) ng/L and (124.443±4.972) ng/L, respectively, with significant differences from those of the other three groups. The concentrations of IL-10 in the groups B and E were (16.973±3.428) ng/L and (20.327±2.721) ng/L, significantly higher than those of the other three groups. Apoptosis of cancer cells was not found in all groups. HE staining of the primary bladder cancer cells showed that the volume of cell nucleus was increased, and the nucleo-cytoplasmic ratio was increased. The number of nucleoli in some cells was increased and some nuclei appeared like ink drops with prominent nucleoli.ConclusionsBCG has an inhibitory effect on the growth of rat bladder cancer cells. IL-10 and TNF-α secreted by the tumor cells might be involved in this regulatory process. However, apoptosis does not show an obvious effect on this inhibitory process.
Bacillus Calmette-Guérin, BCG; Bladder cancer cells; IL-10; TNF-α
吴金生(1975 -),男,副教授,青岛大学在职博士研究生。E-mail: wjswfmc@163.com
孙立江(1963 -),男,教授。E-mail: slijiangqd@163.com
R-33
A
1671-7856(2017) 11-0056-04
10.3969.j.issn.1671-7856. 2017.11.011
2017-05-10
