牛病毒性腹泻病毒RT-PCR方法的建立及应用
2017-11-29李晓波王淑菁王莎莎岳秉飞贺争鸣
王 吉,付 瑞,李晓波,王淑菁,王莎莎,李 威,秦 骁,巩 薇,岳秉飞,贺争鸣
(中国食品药品检定研究院,国家实验动物微生物遗传检测中心,北京 100050)
牛病毒性腹泻病毒RT-PCR方法的建立及应用
王 吉,付 瑞,李晓波,王淑菁,王莎莎,李 威,秦 骁,巩 薇,岳秉飞*,贺争鸣
(中国食品药品检定研究院,国家实验动物微生物遗传检测中心,北京 100050)
目的建立用于牛源样本中牛病毒性腹泻病毒(BVDV)双重RT-PCR检测方法。方法选择已发表的BVDV 1型和BVDV 2型包含5’ UTR区高保守区域基因作为靶基因,分别设计合成引物,建立双重BVDV RT-PCR方法,并对方法的特异性、敏感性、稳定性等进行方法学评价。同时用建立的RT-PCR方法检测了小牛血清、小牛血清去蛋白提取液、脾多肽注射液等41批次牛源性样本和64份牛血浆样本。牛源样本和64份牛临床样本。结果建立的BVDV RT-PCR检测方法与牛副流感病毒III型(BPIV3)、猪瘟病毒(CSFV)、乙型脑炎病毒(JEV)均无交叉反应;检测BVDV 1型和BVDV 2型DNA模板最低浓度分别为每微升8.87 × 102拷贝和6.31 × 102拷贝,BVDV 1型和2型cDNA在-30℃冰箱放置12个月仍可检测出目的条带。应用建立的BVDV RT-PCR方法检测41批次牛源样本和64份牛血浆样本,核酸阳性率分别为14.6%和29.7%。结论建立的BVDV RT-PCR检测方法具有快速、特异、敏感及稳定的特点,可用于牛源样本携带BVDV核酸的检测。
牛病毒性腹泻病毒;RT-PCR;牛源样本
牛病毒性腹泻病毒(bovine viral diarrhea virus,BVDV)又称黏膜病病毒(mucosal disease virus,MDV),属黄病毒科(flaviviridae)瘟病毒属(pestivirus)。病毒粒子大小为40~60 nm,为有囊膜单股正链RNA病毒[1-2]。BVDV可引起许多临床症状及疾病,包括繁殖障碍、呼吸综合征、先天性缺陷、肠炎、持续感染(PI)和黏膜病(MD)等,患牛表现发热、白细胞减少、腹泻、流产、黏膜糜烂溃疡等急性感染症状及小牛先天持续性感染等症状。除牛以外,易感动物还包括骆驼、绵羊、山羊、猪、鹿及多种野生反刍动物。该病毒呈世界性分布,广泛分布于美国、澳大利亚、新西兰、匈牙利、加拿大、阿根廷、日本、印度及非洲和欧洲许多养牛发达国家,是危害养牛业的重要病原之一[2],给养牛业造成了严重的经济损失[2-4]。
随着生物医学技术的不断发展,动物源性生物制品的开发利用日益增多,尤其是牛源性生物制品的开发利用越来越广泛。同时伴随着科技及对药品生物制品质量发展的要求,人们对牛源性制品是否携带或潜在病毒污染,携带或潜在病毒是否会通过直接或间接途径对人造成危害或者传染病的扩散也越来越关注。为保障人民用药安全及避免传染病的扩散,最大限度地降低使用牛源性生物制品传播牛携带相关病毒的风险,本实验建立了快速、特异、敏感的BVDV双重RT-PCR方法,用于对牛及人用牛源性生物制品及原材料可能携带或潜在BVDV的检测,对保证牛源材料及牛源生物制品的使用安全性、保障人民用药安全具有重要意义。
1 材料和方法
1.1病毒与样品
牛病毒性腹泻病毒1型(bovine viral diarrhea virus type 1,BVDV1)、牛副流感病毒3型(bovine parainfluenza virus type 3,BPIV3)(编号分别为VR-1422、VR-281):购自美国ATCC公司;牛病毒性腹泻病毒2型(bovine viral diarrhea virus type 2,BVDV2)、猪瘟病毒(classical swine fever virus,CSFV):本室冻存;乙型脑炎病毒(Japanese encephalitis virus,JEV):由本院病毒一室提供;BVDV1和BVDV2 pGEM-T Easy-pol质粒标准品:委托宝生物工程(大连)有限公司合成;BVDV1和BVDV2引物:由生工生物工程(上海)股份有限公司合成;41批次人用牛源样本(编号:Ny1~Ny41):国内8省市12个厂家和国外2个厂家提供;64份牛肛拭子样本(编号:g1~g64):国内某单位提供。
1.2主要试剂与仪器
RNA快速提取试剂盒购自Qiagen公司;反转录试剂盒购自美国Promega公司;Taq DNA聚合酶和100 bp DNA ladder marker均购自宝生物工程(大连)有限公司。PCR仪:美国Bio-Rad公司;核酸琼脂糖凝胶电泳仪:美国Bio-Rad公司PowerPac Basic;凝胶成像分析仪:美国Kodak公司GL212 Pro。
1.3实验方法
1.3.1 引物设计
分析已报道的BVDV基因组序列,将不同株进行比对,根据GenBank中登录的BVDV 1型和2型毒株基因序列(序列号:M31182.1、AF502399.1)选择包含5’ UTR区高保守区域基因作为靶基因,用Primer Premier 5.0软件设计2组引物,建立双重RT-PCR检测方法。

表1 用于扩增5’ UTR区高保守区域2组引物序列及位置
1.3.2 病毒RNA提取
对牛病毒性腹泻病毒(BVDV)、牛副流感病毒3型(BPIV3)、猪瘟病毒(CSFV)、乙型脑炎病毒(JEV)、正常BT细胞按照RNA/DNA快速提取试剂盒操作方法进行RNA/DNA提取。提取后的RNA立即进行cDNA的合成,剩余的RNA及DNA冻存于-70℃冰箱备用。
1.3.3 反转录
通过对随机引物及AMV反转录酶浓度进行优化,确定反转录体系为:5× RNA PCR buffer 2.5 μL,dNTPs mixture 2.5 μL,RNase Free ddH2O 9.5 μL,随机引物1 μL,RNase Inhibitor 1 μL,AMV反转录酶0.5 μL,病毒RNA 8 μL。反应条件为:37℃,90 min;42℃,15 min;95℃,5 min。获得cDNA,保存备用。
1.3.4 RT-PCR检测方法的建立
以获得的BVDV1和BVDV2质粒为模板进行PCR扩增。对2组引物PCR反应体系的dNTPs浓度、10×buffer浓度、Taq HS酶浓度、引物、模板量及反应体系的退火温度及循环次数等进行优化,通过对正常BT细胞、BVDV1、BVDV2进行PCR扩增来确定RT-PCR反应的最佳模式[6]。
1.3.5 RT-PCR产物的检测
取5 μL扩增产物于1.5%琼脂糖凝胶(含0.5 μg/mL溴化乙锭)进行电泳鉴定。电泳缓冲液为1× TAE buffer(0.04 mol/L Tris-乙酸,0.001 mol/L EDTA,pH 8.0),110 V电泳30 min,在紫外成像仪下观察PCR产物条带在凝胶中的位置,以100 bp DNA ladder marker为参照物,判定结果。RT-PCR阳性扩增片段进行测序,通过与GenBank中BVDV1和BVDV2序列进行比对以确定PCR检测的准确性[6]。
1.3.6 特异性试验
用2组引物分别以正常BT细胞、BVDV1质粒标准品、BVDV2质粒标准品、牛副流感病毒3型(BPIV3)、猪瘟病毒(CSFV)、乙型脑炎病毒(JEV)cDNA为模板,用所建立的PCR方法进行扩增,扩增产物用琼脂糖凝胶电泳做初步鉴定[6]。
1.3.7 敏感性试验
将起始浓度为每微升8.87 × 1010拷贝和6.31 × 1010拷贝的BVDV1和BVDV2质粒样本做系列倍比稀释,分设10-3到10-9共7个浓度梯度进行RT-PCR扩增,扩增产物经1.5%琼脂糖凝胶电泳鉴定,判断所能扩增的最小DNA质粒模板浓度[6]。
1.3.8 稳定性和重复性实验
BVDV1和BVDV2质粒及同一批PCR检测试剂于-30℃冰箱放置3个月、6个月、12个月时,进行PCR检测。3次试验各做3个重复。扩增产物经1.5%琼脂糖凝胶电泳鉴定[5]。
1.3.9 方法的应用及验证
BVDV1、BVDV2、正常BT细胞、2份已知BVDV阴性对照牛血清、64份牛肛拭子样本(编号:g1~g64)、41批次人用牛源生物制品及原材料样本(编号:Ny1~Ny41),具体信息见表2。同时提取RNA,反转录,用2组引物进行PCR扩增。扩增产物用琼脂糖凝胶电泳做初步鉴定。
扩增到的阳性样品,需要对可见的特异性目的条带进行纯化测序。测序结果经BLAST分析,与GenBank中BVDV1和BVDV2核酸序列进行比对,验证检测结果的准确性。
2 结果
2.1PCR反应条件优化
通过对2组引物PCR反应条件及反应体系的优化,确定了PCR最佳反应体系为:10× Ex Taq buffer(含Mg2+)2 μL,dNTPs mixture(10 mmol/L)2 μL,Taq HS酶(5 U/μL)0.5 μL,上下游引物(10 pmol/μL)各1 μL,DNA 2 μL,补水至20 μL;PCR最佳反应条件为:94℃预变性5 min;94℃变性30 s,56℃退火30 s,72℃延伸1 min,共35个循环;72℃再延伸5 min。
2.2PCR产物的检测及特异性实验
2组引物特异性实验显示,以BVDV1质粒和BVDV2质粒为模版有明显目的条带出现,以BPIV3、CSFV、JEV及正常BT细胞的cDNA为模版,均无目的条带出现(见图1)。结果显示特异性可以达到100%。
2.3检测结果的准确性
选择引物1和引物2,PCR扩增BVDV 1型和BVDV 2型阳性片段进行测序,测序结果经BLAST分析,与GenBank中BVDV 1型和BVDV 2型核酸序列同源性均为99%,说明该方法检测准确性较好。
2.4敏感性试验
图2结果显示2组引物检测病毒DNA浓度均可以达到每微升102拷贝。
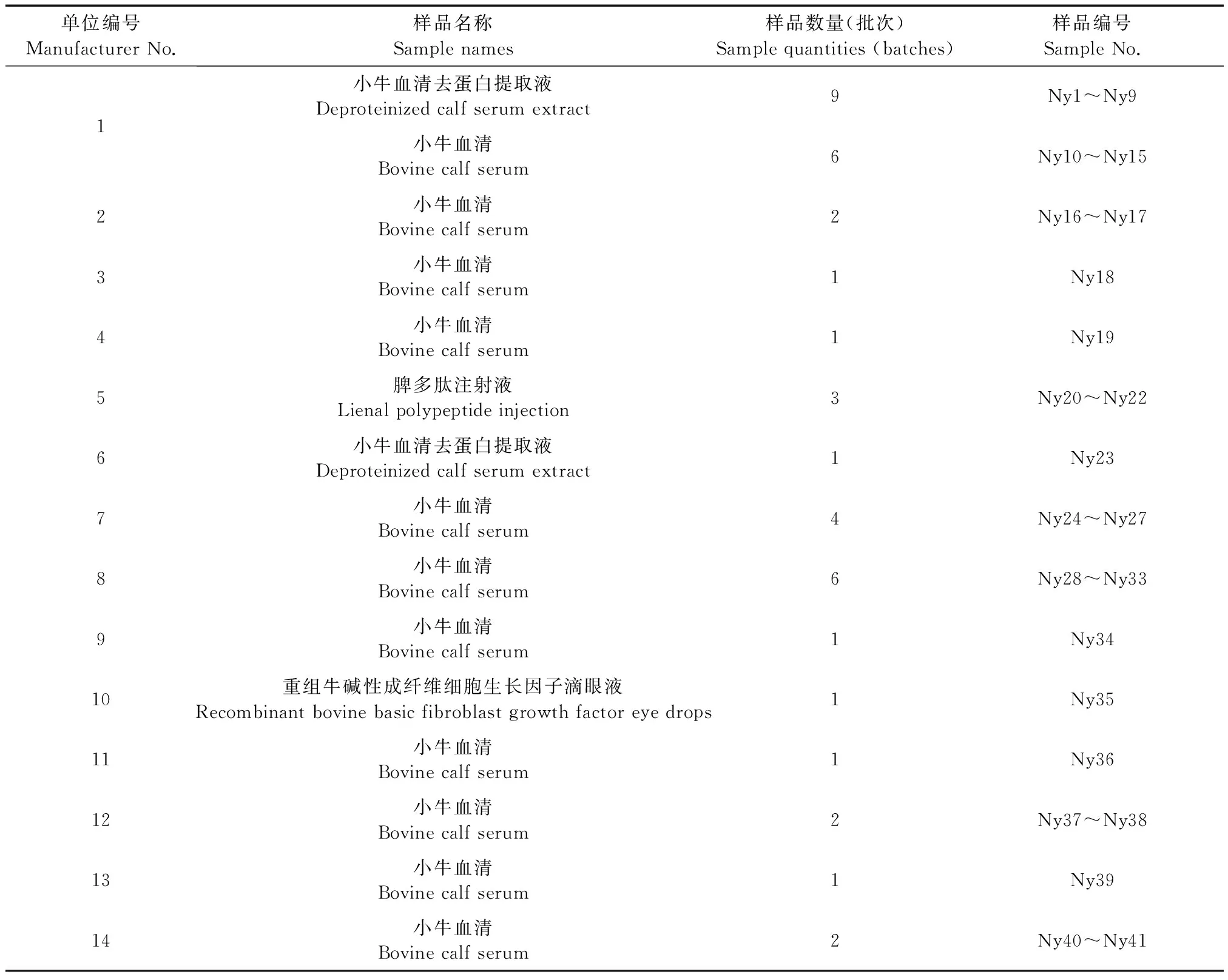
表2 41批次牛源样本信息
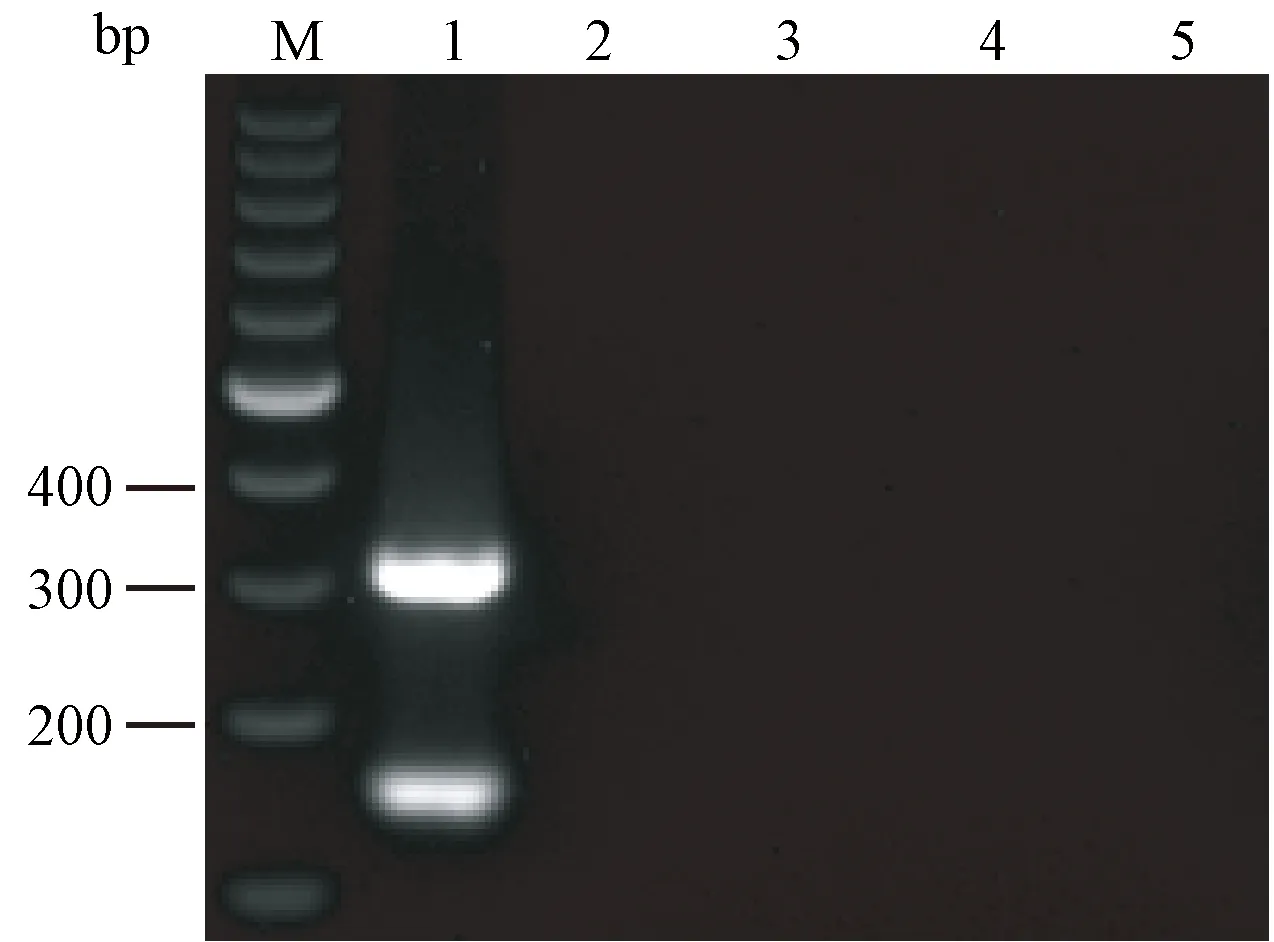
注:M:100 bp DNA ladder marker;1:BVDV;2:BT细胞对照;3:BPIV3;4:CSFV;5:JEV。图1 引物特异性验证Note. M: 100 bp DNA ladder marker; 1: BVDV; 2: BT cells for control; 3: BPIV3; 4: CSFV; 5: JEV.Fig.1 Specificity validation of the primers
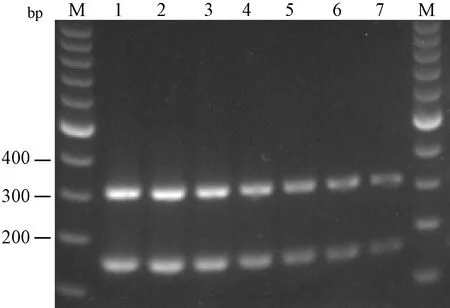
注:M:100 bp DNA ladder marker;1~7:10-3~10-9稀释。图2 通过BVDV质粒浓度梯度测定2对引物PCR检测敏感性Note. M: 100 bp DNA ladder marker; 1-7: 10-3-10-9 dilution.Fig.2 Sensitivity of 2 pairs of primers determined by BVDV plasmid in gradient concentration
2.5稳定性和重复性实验
电泳结果显示,BVDV质粒标准品在-30℃冰箱放置3个月、6个月、12个月时,用2组引物进行检测,分别能扩增出约151 bp和303 bp可见目的条带(图3)。

注:M:100 bp DNA ladder marker;1~3:-30℃冰箱放置3个月的质粒标准品;4~6:-30℃冰箱放置6个月的质粒标准品;7~9:-30℃冰箱放置12个月的质粒标准品。图3 2组引物PCR检测稳定性Note. M: 100 bp DNA ladder marker; 1-3: Plasmid standard sample stored at -30℃ for 3 months; 4-6: Plasmid standard sample stored at -30℃ for 6 months; 7-9: Plasmid standard sample stored at -30℃ for 12 months.Fig.3 Stability of the 2 pairs of primers

注:M:100 bp DNA ladder marker;1,46:BVDV;2,47:BT细胞;3~23:g1~g21;24~45:g22~g43;48~68:g44~g64。图4 PCR检测64份牛肛拭子样本(g1~g64)电泳结果Note. M: 100 bp DNA ladder marker; 1, 46: BVDV; 2, 47: BT cells; 3-23: g1-g21 bovine anal swab samples; 24-45: g22-g43 bovine anal swab samples; 48-68: g44-g64 bovine anal swab samples.Fig.4 Results of electrophoresis of 64 bovine anal swab samples (g1-g64) detected by the PCR method
2.6对牛肛拭子样本检测
对64份牛肛拭子样本(编号:g1~g64)进行检测,电泳结果显示有19份肛拭子样本(编号:g1、g4、g9、g15、g17、g34、g35、g43、g48、g51、g54~g61、g63)扩增出约303 bp的可见目的条带,正常BT细胞和其他45份牛肛拭子本未扩增出可见目的条带。样本电泳结果见图4。
2.7对牛源性样本进行病毒检测
对41批次牛源样本进行BVDV1和BVDV2病毒检测,有5批次牛源样本(编号:Ny16、Ny29、Ny32、Ny35、Ny41)扩增出约303 bp的可见目的条带,有1批次牛源样本(编号:Ny26)扩增出约151 bp的可见目的条带,其他35批次牛源样本未扩增到可见目的条带。样本电泳结果见图5。
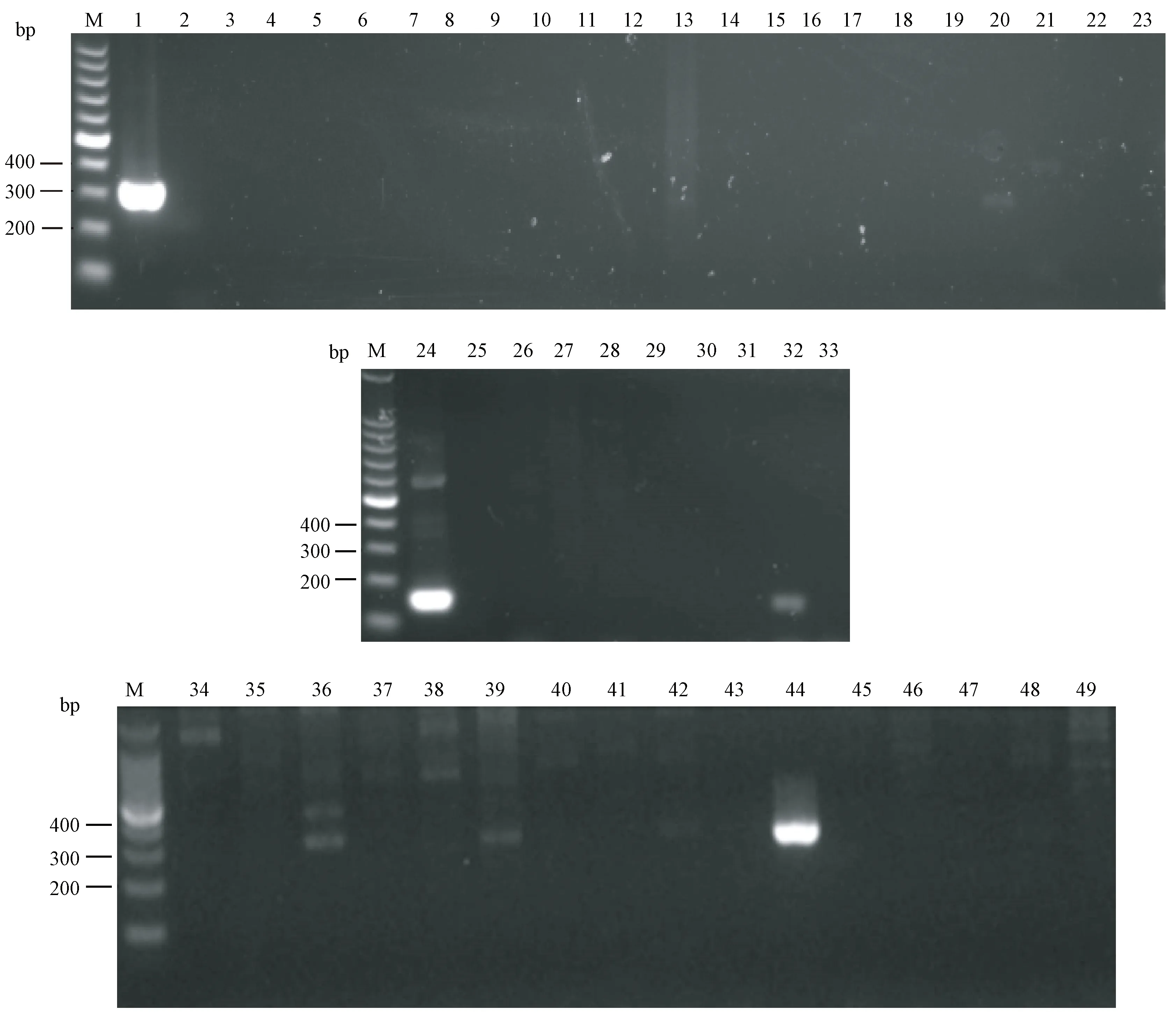
注:M:100 bp DNA ladder marker;1,44∶2型BVDV;2,25,43:BT细胞;3~4:阴性牛血清对照;5~23:Ny1~Ny19牛源样本;24:1型BVDV;26~33:Ny20~Ny27;34~42:Ny28~Ny36;45~49:Ny37~Ny41。图5 PCR检测41批次牛源样本(Ny1~Ny41)1型和2型BVDV病毒的电泳结果Note. M: 100 bp DNA ladder marker; 1, 44: BVDV2; 2, 25, 43: BT cells; 3-4: Negative bovine serum control; 5-23: Ny1-Ny19 bovine-derived samples; 24: BVDV1; 26-33: Ny20-Ny27 bovine-derived samples; 34-42: Ny28-Ny36 bovine-derived samples; 45-49: Ny37-Ny41 bovine-derived samples.Fig.5 Results of electrophoresis of BVDV1 and BVDV2 in 41 bovine-derived samples (Ny1-Ny41) detected by the PCR method
2.8检测结果的验证
将1型BVDV和2型BVDV与GenBank中BVDV1和BVDV2标准株核苷酸序列进行比对,其同源性均为99%;BVDV2核酸阳性样本g1、g4、g9、g15、g17、g34、g35、g43、g48、g51、g54~g61、g63、Ny16、Ny29、Ny32、Ny35、Ny41扩增产物纯化测序,与GenBank中BVDV2标准株核苷酸序列进行比对,其同源性均在95%以上;BVDV1核酸阳性样本Ny26扩增产物纯化测序,与GenBank中BVDV1标准株核苷酸序列进行比对,其同源性为98%。检测结果显示牛肛拭子样本阳性率为29.69%(19/64),牛源样本阳性率为14.6%(6/41)。
3 讨论
BVDV是牛感染率较高、危害性较大的传染病病原之一,国内外已建立了多种检测方法,包括血清学及PCR检测方法等[2, 3,7-9]。但未见有针对牛源制品及牛源制品原辅材料外源BVDV检测的报道,中华人民共和国药典亦没有关于牛源制品及原辅材料检测的规定[10]。药典在“新生小牛血清检测”中虽然有关于新生牛血清用细胞接种法和免疫荧光法检测病毒的规定[10],但没有更为敏感特异的分子生物学检测方法,针对人用牛源性材料及人用牛源性生物制品的检测还是空白。
本研究检测了国内外4个厂家人用生物制品成品(包括小牛血清去蛋白提取液、脾多肽注射液、重组牛碱性成纤维细胞生长因子滴眼液等)11批次,结果均为阴性;检测国内外10个厂家用于生产人用牛源性生物制品的原料小牛血清及实验用小牛血清(包括胎牛血清)30批次,阳性率为20%(6/30)。6批次BVDV核酸阳性小牛血清分别属于5个省市的5个厂家,BVDV检出率为50%。检测的64份牛肛拭子样本又来源另一省市,由此可见BVDV分布范围之广及对人用牛源性生物制品存在的潜在危险。
我们建立的BVDV RT-PCR检测方法,其目的主要是用于牛及人用牛源性生物制品、及人用牛源性生物制品原材料携带或潜在污染BVDV的检测,如小牛血清去蛋白注射液、牛肉浸液、牛胆膏、牛骨粉、牛骨源性明胶;以及用于生产牛源制品的原材料,如牛血浆、牛组织、牛源细胞等。张淑琴等[4]从送检的牛肾细胞(MDBK细胞)中分离到BVDV病毒,本实验也在用于生产牛源生物制品的牛血浆中检测到BVDV。说明用于牛源生物制品生产的原材料确实存在BVDV的污染。
为了保障人民用药的安全,最大限度地降低使用牛源性生物制品传播牛携带相关病毒的风险,我们建立了特异、敏感、操作简单的RT-PCR方法,用于牛及牛源性生物制品及其原辅材料携带外源病毒的检测,完善了BVDV的检测技术,为研发BVDV RT-PCR检测试剂盒奠定了基础,也为今后制定相关技术的国家标准,在全国范围内推动牛源制品生产企业开展牛源制品及原辅材料BVDV检测提供了技术支撑。
[1] 殷震, 刘景华. 动物病毒学 [M]. 北京: 科学出版社, 1997: 645-652.
[2] 李兆华. RT-PCR技术在BVDV检测中的应用研究进展 [J]. 山东畜牧兽医, 2010, 31(2): 50-51.
[3] 郭锐, 陈平, 田永祥, 等. 快速检测牛病毒性腹泻病毒实时荧光定量PCR技术建立及应用 [J]. 湖北农业科学, 2011, 50(8): 1640-1643.
[4] 张淑琴, 谭斌, 程世鹏. 牛病毒性腹泻病毒基因2型毒株的分离与鉴定 [J]. 中国动物传染病学报, 2016, 24(3): 83-86.
[5] Bazzucchi M, Bertolotti L, Giammarioli M, et al. Complete genome sequence of a bovine viral diarrhea virus subgenotype 1h strain isolated in Italy [J]. Genome Announc, 2017, 5(8): e01697-16.
[6] 王吉, 付瑞, 卫礼, 等. 脑心肌炎病毒(EMCV)RT-PCR检测方法的建立及初步应用 [J]. 中国比较医学杂志, 2013, 23(7): 44-49.
[7] Baillargeon P, Arango-Sabogal JC, Wellemans V, et al. Determining bovine viral diarrhea and infectious bovine rhinotracheitis infections in dairy cattle using precolostral blood [J]. Can Vet J, 2017, 58(4): 360-364.
[8] Toohey-Kurth K, Sibley SD, Goldberg TL. Metagenomic assessment of adventitious viruses in commercial bovine sera [J]. Biologicals, 2017, 47: 64-68.
[9] Zoccola R, Mazzei M, Carrozza ML, et al. A newly developed BVDV-1 RT-qPCR Taqman assay based on Italian isolates: evaluation as a diagnostic tool [J]. Folia Microbiol (Praha), 2017, 62(4): 279-286.
[10] 陈竺, 邵明立, 吴浈, 等. 中华人民共和国药典 [S]. 2015年版, 三部(通则), 新生牛血清检测要求, 通则: 144.
EstablishmentandapplicationofaRT-PCRdetectionmethodforbovineviraldiarrheavirus
WANG Ji, FU Rui, LI Xiao-bo, WANG Shu-jing, WANG Sha-sha, LI Wei, QIN Xiao, GONG Wei, YUE Bing-fei*, HE Zheng-ming
(National Institutes for Food and Drug Control, National Center for Quality of Laboratory Animal, Beijing 102629, China)
ObjectiveTo establish a dual RT-PCR detection method for bovine viral diarrhea virus (BVDV) in bovine-derived samples.MethodsThe primers were designed and synthesized according to the published BVDV1 and BVDV2 genes containing highly conservative sequences in the 5’ untranslated regions (5’ UTR) to establish the dual RT-PCR method. The specificity, sensitivity, stability of this method were evaluated. Then 41 bovine-derived samples and 64 bovine plasma samples including bovine calf serum, deproteinized calf serum extract and one lienal polypeptide injection were detected with this method.ResultsThere was no cross reaction with bovine parainfluenza virus type 3 (BPIV3), classical swine fever virus (CSFV) and Japanese encephalitis virus (JEV) when samples were detected with the established dual RT-PCR method. The lowest concentration of template DNA for detection of BVDV1 and BVDV2 was 8.87 × 102copies and 6.31 × 102copies per microliter, respectively. Electrophoresis bands of about 151 bp and 303 bp were still amplified and detected after the BVDV1 and BVDV2 cDNA was stored at -30℃ for 12 months. The BVDV positive rate of 41 bovine-derived samples and 64 bovine plasma samples detected with this dual RT-PCR method was 14.6% and 29.7%, respectively.ConclusionsThe established dual RT-PCR method has the advantages of high efficiency, specificity, sensitivity and stability, and can be used for the detection of BVDV in bovine-derived samples.
Bovine viral diarrhea virus; RT-PCR; Bovine-derived samples
中国食品药品检定研究院学科带头人培养基金项目(编号:2015X5)。
王吉(1974 -),女,副研究员,研究方向:微生物学和免疫学。E-mail: wj_nd_jds@sina.com
岳秉飞(1960 -),研究员,研究方向:实验动物学。E-mail: y6784@126.com
R-33
A
1671-7856(2017) 11-0068-07
10.3969.j.issn.1671-7856. 2017.11.014
2017-05-11
