运动时间及尿蛋白与痛性糖尿病神经病变的相关性分析
2017-12-28高燕玲缪小萍李贵庆
关 媛, 高燕玲, 缪小萍, 李贵庆, 王 颖
(扬州大学附属医院 内分泌科, 江苏 扬州, 225000)
运动时间及尿蛋白与痛性糖尿病神经病变的相关性分析
关 媛, 高燕玲, 缪小萍, 李贵庆, 王 颖
(扬州大学附属医院 内分泌科, 江苏 扬州, 225000)
目的探讨体育运动时间及尿蛋白与2型糖尿病严重痛性糖尿病神经病变的相关性。方法选取本院病房收治的2型糖尿病合并糖尿病神经病变患者59例,分为严重痛性糖尿病神经病变(PDPN)组及无痛性糖尿病神经病变(无PDPN)组。比较2组患者高危因素的差异,探讨体育运动时间及蛋白尿与痛性糖尿病神经病变发病率的关系。结果痛性糖尿病神经病变组中女性患者居多,病程更长,收缩压更高,低密度脂蛋白较低, HbA1C较高,尿蛋白较多,运动时间较少,使用营养神经的药物较多,使用胰岛素的比例较高。在调整了风险因素后,痛性糖尿病神经病变的发病率在无体育运动组中随体育运动时间的增加而逐渐下降(OR=3.47, 95%CI为1.67~9.78), 在大量尿蛋白组中随尿蛋白的减少而逐渐降低(OR=2.76, 95%CI为1.43~3.65)。结论缺乏体育运动及尿蛋白的增加均会增加痛性糖尿病神经病变的发病风险。
痛性糖尿病神经病变; 体育运动; 尿蛋白
糖尿病神经病变是2型糖尿病最常见的慢性并发症之一,其会导致足部溃疡,甚至导致截肢[1]。约20%的糖尿病患者有糖尿病神经病变[2], 而40%~50%患有糖尿病神经病变的患者有痛性糖尿病神经病变(PDPN), 会严重影响患者的生活质量。痛性糖尿病神经病变的治疗复杂,目前有多项针对痛性糖尿病神经病变临床药理学研究[3], 然而大多数治疗方案中,除了血糖控制外,均难以取得良好的治疗效果。PDPN的诊断复杂,而且常常被临床工作所忽视[4]。目前研究[5]表明,糖尿病神经病变与几项传统的心血管危险因素有关,包括血脂、BMI、吸烟和血压。也有研究[6]表明缺乏运动、吸烟、饮酒也会增加糖尿病神经病变的发病风险。而增加体育运动及戒烟会减轻糖尿病神经病变的症状及进展[7]。本研究的目的是确定本院糖尿病患者PDPN的风险因素,包括体育运动及蛋白尿等。由于DN4在鉴别不同病因的慢性神经痛方面显示了不错的敏感性和特异性[8], 所以本研究中PDPN的诊断标准采用2005年设计的DN4评分[9], 现报告如下。
1 资料与方法
1.1 一般资料
选取本院2011年1月—2017年3月病房收治的2型糖尿病合并糖尿病神经病变患者59例,分为严重痛性糖尿病神经病变及无痛性糖尿病神经病变组,其中严重痛性糖尿病神经病变指神经痛难以忍受,需使用抗神经痛药物的患者。痛性糖尿病神经病变组指严重痛性糖尿病神经病变。无痛性糖尿病神经病变为神经传导速度检查阳性,DN4评分<4分的2型糖尿病患者。排除标准: 非糖尿病性神经病变; 有周围血管动脉闭塞; 有截肢手术的病史; 严重的精神疾病及其他相关可影响理解问题的疾病。止痛药物的使用不作为排除的条件,除非其影响了疼痛程度使DN4评分<4分。
1.2 方法
由经过培训的糖尿病专科医生采集完整的病史,包括可能会引起疼痛的病因。采用本院美国尼高力Vikin Ques Loeser, JD t台式高级肌电诱发电位系统进行腓、胫神经的运动神经传导速度(MCV)和感觉神经传导速度(SCV)检查。测量身高、体质量、血压、糖尿病病程、降糖药、降压药、降脂药的使用、每日持续体育运动的时间。常规的实验室检查包括: 下肢血管彩超、糖化血红蛋白(HbA1C)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、甘油三酯(TG)、总胆固醇(TC)、血肌酐、尿白蛋白/尿肌酐比值(ACR)。少量蛋白尿为ACR 30~300 mg/g, 大量蛋白尿为ACR≥300 mg/g。
向患者提供中文版的DN4问卷进行调查,由经过培训的糖尿病专科医生进行体格检查。DN4工具包括10个方面,4个问题。其中7个方面是关于疼痛描述的问题(灼热感、冰冷的疼痛、电击样疼痛),及与之相关的感觉异常方面的问题(刺痛、麻木、针刺感、瘙痒)。其他3个方面为简单的床旁神经检查(应用软毛刷进行触觉减退方面的检查,应用任意的一次性针进行针刺觉减退的检查,应用软毛刷的触觉动态异常性疼痛的检查),阳性检查结果计1分,阴性结果计0分,总分0~10分。有诊断价值的截点为4分,其中问卷调查3分以上具有诊断意义。以上的病史采集及体格检查均为同一研究者。
1.3 统计学方法
采用SPSS 23.0软件进行统计学分析。计量资料以均数±标准差表示,连续变量两独立样本比较采用t检验,分类变量采用Fisher检验。运动时间及尿蛋白与DN4评分的差异采用线性回归分析。运动时间及尿蛋白对痛性糖尿病神经病变的发病风险采用Logistic回归分析。P<0.05为差异有统计学意义,采用95%的置信区间。
2 结 果
痛性糖尿病神经病变组中女性患者居多,病程更长,收缩压更高,低密度脂蛋白胆固醇较低,HbA1C较高,尿蛋白较多,运动时间较少,使用营养神经的药物较多,使用胰岛素的比例较高。见表1。

表1 有及无痛性糖尿病神经病变患者基本情况比较[n(%)]
与PDPN比较, *P<0.05,**P<0.01。
无痛性糖尿病神经病变组体育运动时间越短,DN4评分越高(P=0.035)。在痛性糖尿病神经病变组却无此变化趋势。此外,无痛性糖尿病神经病变组尿蛋白越多, DN4评分越高(P=0.028)。在痛性糖尿病神经病变组却无此变化趋势。见表2。在调整了性别、年龄、糖尿病病程、收缩压、低密度脂蛋白胆固醇、HbA1C、营养神经药物的使用、胰岛素的使用等因素后,体育运动时间越短,痛性糖尿病神经病变的发病风险越高(P=0.005)。此外,调整以上相关因素后,尿蛋白越多,痛性糖尿病神经病变的发病风险越高(P=0.023)。见表3及图1、2。

表3 不同每日运动时间及尿蛋白组的痛性糖尿病神经病变的发病率比较
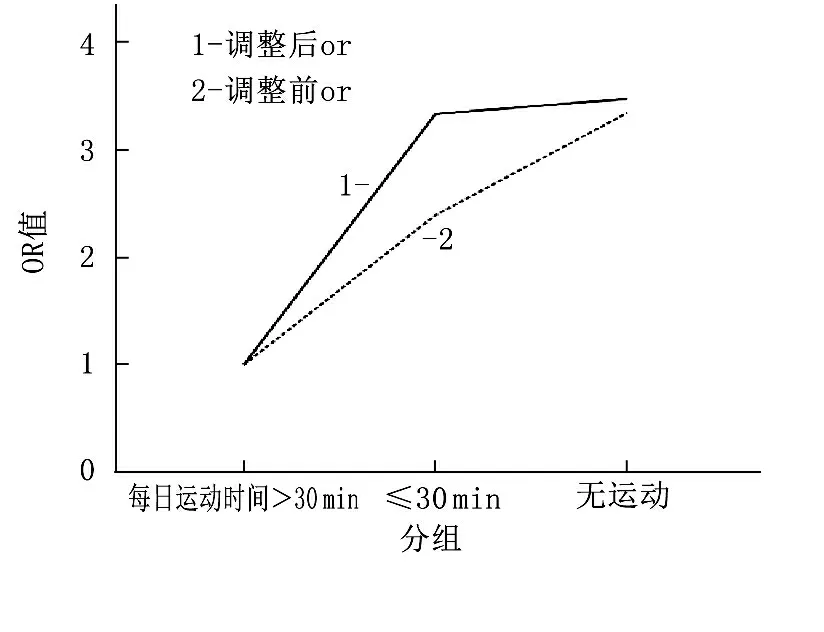
图1 每日运动时间与痛性糖尿病神经病变发病率的关系

图2 尿蛋白与痛性糖尿病神经病变发病率的关系
3 讨 论
痛性糖尿病神经病变的诊断标准为四肢末端对称分布的神经感觉方面的疼痛,并且同一部位反复发作,病程超过6个月[10]。目前,有多种诊断痛性糖尿病神经病变的方法,如临床症状、神经传导速度、震动觉、痛温觉检查,以及几种经过认证的调查问卷[11]如密歇根神经病变评分(MNSI)、神经症状评分(NSS)、VAS评分、McGill疼痛问卷等。然而,痛性糖尿病神经病变为神经小纤维损伤的结果,而神经传导速度的检查主要评估大神经纤维的功能。所以痛性糖尿病神经病变的诊断需以临床表现为基础,如疼痛的性质(灼热感、冰冷的疼痛、电击样疼痛、刺痛、麻木、针刺感、瘙痒等),疼痛加重的时间(夜晚及休息时),疼痛减轻的因素(行走时等)[12]。DN4调查问卷非常详细,有很强的痛性糖尿病神经病变的诊断敏感性。DN4评分≥4分在痛性糖尿病神经病变的诊断有83%的敏感[13-15]。除了高血糖,血脂异常,氧化应激,神经细胞的胰岛素抵抗也是糖尿病神经病变的发病机制[16]。
痛性糖尿病神经病变的早期诊断不仅对糖尿病神经病变的病因研究有帮助,同时也可以通过药物减轻患者的临床不适症状,改善患者的生活质量[17]。缺乏体育运动使痛性糖尿病神经病变的发病风险增加,缺乏每日的持续体育运动不仅在DN4评分≥4分组中评分较高,在无痛性糖尿病神经病变组中也有相对较高的DN4评分。这样的结果表明,缺乏体育运动会加速糖尿病神经病变进展。体育锻运动可以降低血压[18], 改善高血糖、高血脂,甚至是身体成分。此外,通过体育运动,血管内皮功能可以得到改善,抗炎因子分泌增加,对抗氧化应激[19]。前瞻性研究[20]表明,规范的体育运动可以延缓糖尿病神经病变的进展,减轻神经的敏感性。
在校正了糖尿病病程、年龄、糖化血红蛋白、高脂血症、血压、BMI等因素后,无痛性糖尿病神经病变组中蛋白尿与DN4评分仍呈正相关。痛性糖尿病神经病变组发病风险同样随蛋白尿的严重程度增加而升高。研究[21]已经报道了尿蛋白与糖尿病神经病变发病率的正相关关系。本研究认为蛋白尿与痛性糖尿病神经病变之间有相同的发病机制: 内皮的功能障碍与微血管的损伤。总之,缺乏体育运动及蛋白尿会增加痛性糖尿病神经病变的风险,体育运动可能会成为预防痛性糖尿病神经病变的一种简便有效的方法。
[1] S. E. Holzer, A. Camerota, L. Martens, et al. Costs and duration of care for lower extremity ulcers in patients with diabetes[J]. Clin Ther, 1998, 20(1): 169-181.
[2] A. Sadosky, C. Schaefer, R. Mann, et al. Burden of illness associated with painful diabetic peripheral neuropathy among adults seeking treatment in the US: results from a retrospective chart review and cross-sectional survey, Diabetes Metab[J]. Syndr Obes, 2013(6): 79-92.
[3] Tesfaye S. Painful diabetic peripheral neuropathy: consensus recommendations on diagnosis, assessment and management[J]. Diabetes Metab Res Rev, 2011, 27: 629-38.
[4] C. A. Abbott, R. A. Malik, E. R. van Ross, et al. Prevalence and characteristics of painful diabetic neuropathy in a large community-based diabetic population in the U. K[J]. Diabetes Care, 2011, 34(10): 2220-2224.
[5] S. Tesfaye, N. Chaturvedi, S. E. Eaton, et al. Vascular risk factors and diabetic neuropathy[J]. N Engl J Med, 2005, 352(4): 341-350.
[6] C. A. Abbott, N. Chaturvedi, R. A. Malik, et al. Explanations for the lower rates of diabetic neuropathy in Indian Asians versus Europeans[J]. Diabetes Care, 2010, 33(6): 1325-1330.
[7] V. Spallone, R. Morganti, C. D'Amato, et al. Validation of DN4 as a screening tool for neuropathic pain in painful diabetic polyneuropathy[J]. Diabet Med, 2012, 29(5): 578-585.
[8] Bouhassira D, Attal N, Alchaar H, et al. Comparison of pain syndromes associated with nervous or somatic lesions and development of a new neuropathic pain diag- nostic questionnaire (DN4)[J]. Pain, 2005, 114: 29-36.
[9] D. Bouhassira, N. Attal, H. Alchaar, et al. Comparison of pain syndromes associated with nervous or somatic lesions and development of a new neuropathic pain diagnostic questionnaire (DN4)[J]. Pain, 2006: 139-146.
[10] Bouhassira D, Attal N, Alchaar H, et al. Comparison of pain syndromes associated with nervous or somatic lesions and development of a new neuropathic pain diagnostic questionnaire (DN4)[J]. Pain, 2005, 114: 29-36.
[11] A. Peltier, S. A. Goutman, B. C. Callaghan. Painful diabetic neuropathy[J]. BMJ, 2014(348): 1799-1805.
[12] A. Hartemann, N. Attal, D. Bouhassira, et al. Working Group on the Diabetic Foot from the French-speaking Society of, Painful diabetic neuropathy: diagnosis and management[J]. Diabete Metab, 2011, 37(5): 377-388.
[13] Anon. Intensive blood-glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes (UKPDS 33). UK Prospective Diabetes Study (UKPDS) Group[J]. Lancet, 1998, 352(9131): 837-853.
[14] M. I. Bennett, N. Attal, M. M. Backonja, et al. Using screening tools to identify neuropathic pain[J]. Pain, 2007, 127(3): 199-203.
[15] Anon. The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus. The Diabetes Control and Complications Trial Research Group[J]. N Engl J Med, 1993, 329(14): 977-986.
[16] B. Kim, E. L. Feldman. Insulin resistance in the nervous system, Trends Endocrinol[J]. Metab, 2012, 23(3): 133-141.
[17] A. G. Smith, J. Russell, E. L. Feldman, et al. Lifestyle intervention for prediabetic neuropathy[J]. Diabetes Care, 2006, 29(6): 1294-1299.
[18] D. J. Carlson, G. Dieberg, N. C. Hess, et al. Isometric exercise training for blood pressure management: a systematic review and meta-analysis[J]. Mayo Clin Proc, 2014, 89(3): 327-334.
[19] V. V. Venkatasamy, S. Pericherla, S. Manthuruthil, et al. Effect of physical activity on insulin resistance, inflammation and oxidative stress in diabetes mellitus[J]. J Clin Diagn Res, 2013, 7(8): 1764-1766.
[20] S. Dixit, A. G. Maiya, B. A. Shastry. Effect of aerobic exercise on peripheral nerve func- tions of population with diabetic peripheral neuropathy in type 2 diabetes: a single blind, parallel group randomized controlled trial[J]. J Diabetes Complicat, 2014, 28(3): 332-339.
[21] H. Sone, S. Mizuno, N. Yamada. Vascular risk factors and diabetic neuropathy[J]. N Engl J Med, 2005, 352(18): 1925-1927.
Correlationbetweenphysicalexercisetime,albuminuriaandpainfuldiabeticpolyneuropathy
GUANYuan,GAOYanling,MIAOXiaoping,LIGuiqing,WANGYing
(DepartmentofEndocrinology,AffiliatedHospitalofYangzhouUniversity,Yangzhou,Jiangsu, 225000)
ObjectiveTo discuss the relationship between physical exercise time, albuminuria and painful diabetic polyneuropathy.MethodsA total of 59 patients with type 2 diabetes combined with diabetic neuropathy were included in the study in our hospital, and were divided into pain-free diabetic neuropathy(non-PDPN) and serious painful diabetic polyneuropathy (PDPN) group. The difference between the two groups of patients with risk factors were compared, and the relationship between physical time, albuminuria and painful diabetic polyneuropathy were discussed.ResultsThere were more female patients with older age, and they had longer diabetes duration, higher systolic blood pressure, lower low-density lipoprotein(LDL), higher HbA1c, more albumin-uria, less habitual exercise, more neuropathy medication use and more insulin use in PDPN group. After adjusting the possible confounding factors, the risk of painful neuropathy was decreased with increase of physical activity in the group without physical activity (OR=3.47, 95% CI: 1.67~9.78), and was decreased with the decline of albuminuria in the group with amount of albuminuria (OR=2.76, 95% CI: 1.43~3.65).ConclusionLess physical activity and increase of albuminuria can increase the risk of PDPN.
painful diabetic polyneuropathy; physical activity; albuminuria
R 587.2
A
1672-2353(2017)23-021-04
10.7619/jcmp.201723007
2017-07-11
国家自然科学基金青年基金(81200596)
王颖, E-mail: ywang1110@163.com
