miR-451a调控BAP31诱导结直肠癌细胞凋亡
2017-12-28许可韩彬柏杨周黎明
许可 韩彬 柏杨 周黎明
(四川大学华西基础医学与法医学院药理学教研室,四川 成都 610041)
论著
miR-451a调控BAP31诱导结直肠癌细胞凋亡
许可 韩彬 柏杨 周黎明△
(四川大学华西基础医学与法医学院药理学教研室,四川 成都 610041)
目的:探讨miR-451a及靶蛋白BAP31在结直肠癌中的作用。方法体外培养HCT116、SW620、SW480、DLD细胞,以Real-time PCR法检测结直肠癌细胞系中miR-451a和BAP31的相对表达量;通过建立miR-451a不同表达情况的结直肠癌细胞HCT116模型,应用抑制消减杂交方法建立抑制消减文库,从中筛选miR-451a的调控蛋白,并通过萤光素酶报告基因检测miR-451a的直接调控靶基因;采用MTT法、流式细胞术以及Hoechst染色法评价miR-451a调控的靶蛋白BAP31对结直肠细胞凋亡的调节作用。结果在抑制杂交消减文库中得到了miR-451a可能调控的相关基因,其中在正向文库中得到BAP31、EEF1A1和CDC20等7个基因,在反向文库中得到DKK1和PSME1等4个基因。在HCT116、HT29、SW480、SW620和DLD结直肠癌细胞中miR-451a的相对表达量是正常结肠上皮细胞NCM460中的0.32、0.44、0.53、0.43和0.73倍,BAP31在DLD、HT29、SW620和HCT116结直肠癌细胞中的表达量是正常结肠上皮细胞NCM460中的1.85、2.84、2.37和3.71倍。双萤光素酶报告基因实验证明,miR-451a可作用于与BAP31开放阅读框上游177的位点,通过miR-451a作用使海肾荧光素酶的活性降低80.3%。在HCT116细胞和SW620细胞中过表达miR-451a后72h抑制率分别为39.50%和39.50%;沉默BAP31后72 h抑制率分别为45.32%和53.56%。过表达miR-451a 48 h后HCT116凋亡增加13.57%,SW620细胞凋亡率增加13.2%;沉默BAP31 48 h后HCT116细胞凋亡增加5.62%,SW620细胞凋亡率增加8.68%。结论miR-451a在结直肠癌细胞中能够直接通过调控BAP31诱导细胞的凋亡从而抑制细胞的增殖。
结直肠癌;miR-451a;BAP31;凋亡
结直肠癌是世界上发病率和死亡率最高的恶性肿瘤之一。据WHO报道截止2012年,结直肠癌的发病率以2%的速度迅速上升,全球新诊断结直肠癌患病人数为136万例,占发病率第3位,而死亡人数也达69.4万例,占肿瘤患者死亡率的第二位[1]。而随着生活水平的提高和饮食结构的改变,中国城市结肠癌的发病率更是远远超过国际水平成为第四大常见恶性肿瘤,仅次于肺癌、胃癌和肝癌,仅2012年新发病例约40万人[2]。因此,结直肠癌是各国重点防治的恶性肿瘤之一。
MiR-451a定位于人类染色体17q11.2,于2005年被Altuvia等人首次在人脑垂体RNA中发现并命名[3]。大量研究表明,miR-451a表达量在众多肿瘤,如:慢性髓细胞白血病、胶质瘤细胞、非小细胞肺癌、头颈部鳞癌、胃癌中均明显下调[4-8],而且可以上调多药耐药基因的表达从而增加卵巢癌的化疗耐药性[9]。若过表达miR-451a则能显著降低结肠癌细胞SW480的侵袭能力[10,11],可见miR-451a在胃肠肿瘤中可能作为一个抑癌因子参与了消化道肿瘤发生、发展过程的调控。
B细胞受体相关蛋白31(B cell receptor associated protein 31,BAP31)是由738个核苷酸编码246个氨基酸残基,分子量为28 KD,属于B细胞受体相关蛋白家族,定位于内质网上,是重要的内质网分子伴侣蛋白,能与转运调节因子进行信号传递[12,13]。研究发现,BAP31在宫颈癌、卵巢癌、乳腺癌、食道癌、肝癌、结直肠癌和肺癌组织中均呈现高表达[14],然而意义却并不明确。本研究拟通过抑制消减杂交的方法,研究miR-451a可能调控的下游基因,并以文库中筛选得到的下游基因BAP31为研究对象,探讨其在结直肠癌发生发展中的具体作用。
1 材料与方法
1.1 质粒和菌株
过表达miR-451a慢病毒Lv-miR-451a和空白对照慢病毒Lv-miR-451a-NC由中国汉恒公司构建。pGM-T载体购于北京天根生物公司,转化用感受态大肠杆菌JM109菌株为实验室保存菌株,感受态细胞制备由本实验室自己制备。双荧光素酶报告载体pSicheck2.0购于北京碧蓝橙生物科技公司的。设计miR-451a过表达引物,扩增miR-451a的前体序列,插入载体pcDNA-3.0载体中。设计BAP31沉默的引物和乱序引物Scramble插入载体psilencer-3.0+,引物稀释成10 mM,并在DNA杂交液中,插入载体pcDNA-3.0载体中,引物如下表。根据http://bibiserv.techfak.uni-bielefeld.de/rnahybrid/在线软件工具RNAhybrid预测miR-451a可能对BAP31基因的调控位点,设计插入双荧光素酶载体引物BAP31-(-148)、BAP31-(-177)、BAP31-(666)、BAP31-(3UTR),见表1。
1.2 细胞培养及转染
HCT116、SW620、SW480、HT29、DLD结直肠癌细胞株,正常结肠上皮细胞NCM60,以及用于双荧光素酶报告基因载体转染的293T细胞均为本实验室保存。培养时均用含10%胎牛血清,1%青链霉素的DEME培养基在5%CO2、37℃细胞培养箱中进行培养。293T细胞培养至聚合度为60%-80%时用于转染。转染时采用Lip2000,按照每μgDNA加入2 μL进行细胞转染。
1.3 RNA提取及反转录
细胞总RNA提取采用Trizol方法。向6孔板中每孔加入Trizol试剂500 μl,待细胞全部裂解后,收集裂解液转入1.5 ml EP管中;组织标本从液氮中取100 mg,向样品中加入Trizol试剂500 μl,组织匀浆机迅速匀浆后,收集匀浆液至1.5 mlEP 管中,加入Trizol至1 ml,室温静置5 min。加入氯仿0.2 ml,充分剧烈振荡15 s,室温静置5 min。4℃、12000 g离心15 min,吸取上层水相,向水相中加入等体积的异丙醇,混匀,室温静置10 min,4℃、12000 g离心10 min。移去上清液,加入预冷的75%DEPC水-乙醇1 ml,轻轻震荡,洗涤沉淀,4℃、7500 g离心5 min。弃上清液,自然风干5-10 min,加入DEPC水30 μl,溶解沉淀。取RNA样品1 μl通过NanoDrop ND-1000微量分光光度计检测各RNA样品的质量。样品质检合格后立即用RevertAid M-MuLV Reverse Transcriptase,于42℃反应60 min,75℃灭活5 min,逆转录产物放在冰上待用或-20℃保存。逆转录引物序列见表2。
1.4 Realtime-PCR
按VazymeAceQqPCR试剂盒说明书,配置PCR反应体系。Realtime-PCR于Bio-Rad CFX96定量PCR仪上进行。最后用2-△△CT公式计算癌组织相对于癌旁组织中的miR-451a和BAP31相对表达量。引物序列见表3。

表1 引物序列

表2 逆转录引物

表3 Realtime-PCR引物
1.5 抑制消减文库建立
采用双向的SSH来获取差异表达基因,分别以转染空白对照慢病毒HCT16 cDNA为Tester,以过表达miR-451a的HCT116的cDNA为Driver,得到正向文库(Forward-subtracted library,FSL);再以过表达miR-451a的HCT116的cDNA为Tester,以转染空白对照慢病毒HCT16的cDNA为Driver得到反向文库(Reverse-subtracted library,RSL)。采用SMART PCR技术合成双链cDNA。在0.5 mL RNase-Free的Ep管中,采用SMART IIA Oligonucleotide引物,使用SMART Script Reverse Transcriptase (Clontech,10 U·mL-1),逆转录合成第1链cDNA,进一步合成ds cDNA。两组ds cDNA,分别用RsaI酶切,将酶切产物进行两轮杂交和两轮PCR,产物经纯化并定量后连接到pGM-T载体中,16℃连接过夜。取连接产物5.0 μL加ddH2O 5.0 μL用于转化E.coliJM109感受态细胞。涂布于含100 μg·mL-1氨苄青霉素的LB平板,37℃培养过夜。挑取阳性克隆接种于2 mL含100 μg·mL-1氨苄青霉素的LB培养基中,37℃培养过夜。将部分阳性克隆送成都擎科公司测序。将序列登录美国国家生物信息中心网站,用BLAST 软件将得到的序列在线与GenBank中的序列进行同源性比对。将测序所得的基因序列提交Http://www.omicsbean.com.cn进行GO数据聚类分析,分析结果由网站提供。引物序列见表4。
1.6 组织总蛋白的提取和Western blotting
取组织各标本组织 100 mg放入EP管中,并加入1 ml DNA/RNA/蛋白质提取试剂盒中的GTC裂解液(每500 μL加入β-巯基乙醇10 μL)。用电动匀浆器置于冰上匀浆,至肉眼不见块状组织为止,收集经过提DNA、RNA柱子后的液体,转入10 mLEP管中,加入4倍体积的预冷丙酮。-20℃沉淀过夜。12000 rpm 4℃离心10 min,弃上清,加入1 mL冰乙醇润洗12000 rpm 4℃离心3 min,加入600 μL蛋白Loading buffer,沸水煮10 min,-80℃储存备用。取稀释好的样品进行 SDS-PAGE电泳(分离胶12%,浓缩胶5%),转膜,4℃封闭过夜。一抗4℃孵育过夜,TBST洗涤后,再与HRP标记的二抗于室温孵育1 h,ECL显色,照相。

表4 抑制消减杂交文库所需引物
1.7 双荧光素酶报告基因构建
将构建的萤光素酶报告载体pSicheck-BAP31-148, pSicheck-BAP31-177, pSicheck-BAP31-666和pSicheck-BAP31-3UTR。当293T细胞生长至80%聚合度时,按照空白、pCDNA+pSicheck、pCDNA-miR451a+pSicheck、pCDNA-miR451a+pSicheck-148、pCDNA-miR451a+pSicheck-177、pCDNA-miR451a+ pSicheck-666、pCDNA-miR451a+ pSicheck-3UTR、pCDNA +pSicheck-148、pCDNA+pSicheck-177、pCDNA+pSicheck-666、pCDNA + pSicheck-3UTR按照miR-451a两倍于psicheck载体的量共转染293T细胞。在48 h后按照Promega 双萤光素酶报告检测试剂盒操作,先用PBS洗涤后,加入PLB制成裂解液400 μl。将小量细胞裂解液20 μL和荧光素酶测试试剂II(LARII)100μL混合,萤火虫荧光素酶的活力立即用荧光照度仪检测。检测完后立即加入Stop &GloTM试剂100 μL,淬灭萤火虫荧光素酶反应,同时激活Renilla荧光素酶反应,并立即检测Renilla荧光素酶的活力。以荧火虫荧光发光强度为内参,以pCDNA+pSicheck-NC组为阴性对照,得到其余各组海肾荧光相对发光强度。
1.8 MTT法测细胞增殖能力
收集细胞,接种于96孔板,每孔细胞数5×103,每组设三个复孔。用含10%胎牛血清,1%青链霉素的DEME培养基在5%CO2、37℃细胞培养箱中进行培养24 h,待细胞贴壁后,将pcDNA、pcDNA-miR451a、pSilencer-Scr、psilencer-BAP31转染细胞。转染0、24、48、72、96、120 h后,将待测孔每孔加入MTT溶液(5 mg·mL-1)20 μL,继续培养4 h后,弃培养液。每孔加入DMSO150 μL,避光震荡10 min,使结晶物充分溶解。在酶标仪上于570 nm处检测各孔吸光值(OD)。绘制对应时间的生长曲线。
1.9 Hoechst染色
HCT16、SW620转染pcDNA-miR451a、pcDNA-NC、psilencer-BAP31及对照质粒psilencer-Scr。48 h后用4%甲醛固定20 min,适当洗涤去除固定剂。滴加少量Hoechst33342染液。室温放置3-5 min。吸除Hoechst33342染色液,用PBS洗涤2次,每次3-5 min。封片后荧光显微镜下观察。
1.10 流式细胞检测细胞凋亡
用不含EDTA的胰酶消化细胞后,300 g,4℃离心5 min收集细胞。胰酶消化时应注意观察细胞,当细胞形状发生变圆时,立即用含有血清的培养基终止消化。用预冷的PBS洗涤细胞两次,每次洗涤完毕后,均用300 g,4℃离心5 min。收集细胞,加入1×Binding Buffer 100 μL重悬细胞。加入Annexin V-FITC5 μL轻轻混匀,避光在室温反应10 min,待上机检测前10 min再加入PI Staining Solution5 μL,随后加入1×Binding Buffer400 μL,混匀,再用流式细胞仪检测。
1.11 统计学计量
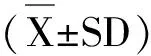
2 结果
2.1 HCT116、HT29、SW620中miR-451a的表达情况
通过Realtime-PCR检测常见结直肠癌细胞株HCT16、HT29、SW480、SW620、DLD与对照正常结肠上皮细胞NCM460中miR-451a的表达量,结果表明:与正常结肠上皮细胞NCM460中的miR-451a表达量相比,miR-451a在HCT116、HT29、SW480、SW620和DLD细胞中的相对表达量分别为0.32、0.44、0.53、0.43、0.73倍,均显著低于正常结肠上皮细胞NCM460中的表达量(P<0.05);且在这五株细胞中,以HCT116、HT29、SW620中miR-451a的相对表达量最低,见图1。
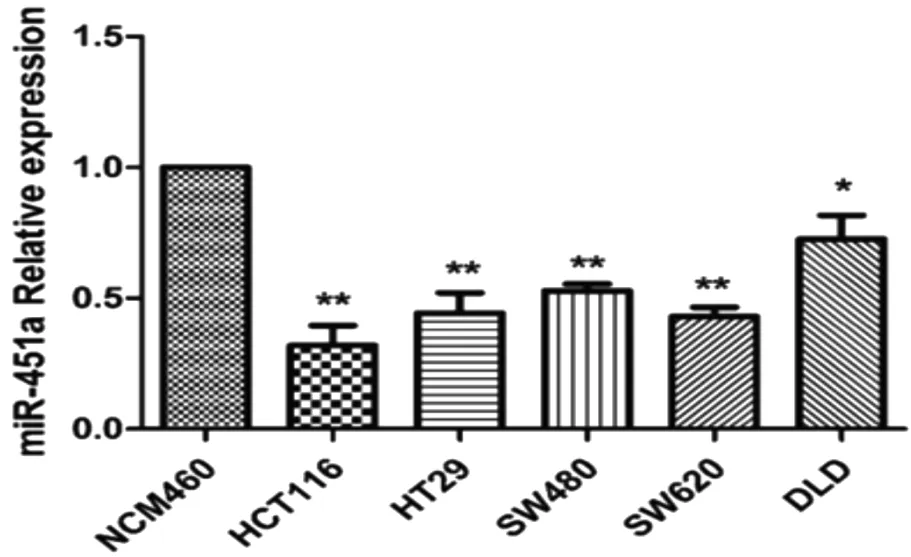
图1 miR-451a在不同结直肠细胞中的相对表达量注:与正常结肠上皮细胞NCM460相比,*P<0.05、**P<0.01。
2.2 稳定转染过表达miR-451a的HCT116中,miR-451a表达上升
选择miR-451a相对表达量最低的HCT116作为建库的细胞株。利用构建的miR-451a过表达慢病毒载体Lv-miR-451a和空白慢病毒载体Lv-miR-451a-NC转染HCT116细胞,经嘌呤霉素筛选,得到稳定转染的细胞株HCT116-Lv-miR-451a和HCT116-Lv-miR-451a-NC。通过Realtime-PCR检测了稳定转染过后细胞株中miR-451a的相对表达量,结果表明:HCT116-Lv-miR-451a中miR-451a相对表达量是未经处理的HCT116细胞中的2.1倍,而HCT116-Lv-miR-451a-NC中miR-451a相对表达量是未经处理的HCT116细胞中的1.07倍,HCT116- Lv-miR-451a中miR-451a的相对表达量是HCT116-Lv-miR-451a-NC里的1.96倍。HCT116-Lv-miR-451a中miR-451a相对表达量显著高于HCT116-Lv-miR-451a-NC中的(P<0.01),见图2。

图2 HCT116细胞转染miR-451a过表达慢病毒载体Lv-miR-451a和空白慢病毒载体Lv-miR-451a-NC后,miR-451a的相对表达量注:与空白慢病毒载体Lv-miR-451a-NC相比,**P<0.01。
2.3 抑制消减文库的建立
以HCT116-Lv-miR-451a细胞和HCT116-Lv-miR-451a-NC细胞互为Diver和Tester,构建了正向和反向两个文库。文库质量检测显示:第二轮消减PCR产物大小在800-1200bp弥散,大小符合建库要求,见图3A;通过对保守基因GAPDH的定量分析,在消减闻库中GAPDH被消减掉8.26倍,证明抑制消减文库对相同基因的消减效率符合建库要求,见图3B。将经纯化后的第二轮PCR产物克隆到pGM-T载体中,然后转化大肠杆菌JM109,两个文库中总共获得1149个阳性克隆,其中正向库728个,反向库421个。对文库中所获得的阳性克隆随机挑取120个,其中正向库75个,反向库45个进行测序,测序结果显示在正向库中我们获得了:BAP31、 EEF1A1、CDC20、WDR6、TUFM、RPL13和RPL7A这7个基因的EST序列,其中7个BAP31序列占总测序数的9.33%,4个RPL7A序列占总测序数的5.33%,EEF1A1和RPL13各3个分别占总测序数的4.0%,CDC20、WDR6和TUFM各1个,分别占总测序数的1.33%;在反向库中我们获得了:DKK1、PSME1、NDUFA3 和GNB2这4个基因的EST序列,其中5个DKK1序列占总测序数的11.11%,3个NDUFA3序列占总测序数的6.67%, EEF1A1和RPL13各1个分别占总测序数的%,PSME1和GNB2各1个,分别占总测序数的2.22%。以上11个基因的EST经序列比对分析与人类基因组中相对应的基因同源性均为100%。

图3 SSH文库质量的检测注:A—正向消减文库(L1)、反向消减文库(L2)和Marker(L3);B—GAPDH的相对表达水平
2.4 生物信息学结果分析
通过对miR-451a所调控的这些基因在生化过程、细胞组成和分子功能等方面的GO分析,得到了正向文库中所得到的7个基因主要与转录延伸(GO:0006414),蛋白质在内质网上的定位(GO:0070972),蛋白质的翻译(GO:0006412)以及polyA RNA 的结合(GO:004482)高度相关;而反向文库中的4个基因的聚类分析主要与Wnt信号通路的负向调节有关。进一步生物信息学分析,miR-451a所调控的这些基因参与了细胞分子的转运,细胞信号传导和细胞的增殖与生长,见图4。

图4 GO分析
2.5 BAP31在结直肠癌细胞株中高表达
利用Realtime-PCR和Westerblot检测在常见结直肠癌HCT16、HT29、SW620、DLD细胞株与对照细胞株正常结肠上皮细胞NCM460中BAP31的表达量。结果显示:以正常结肠上皮细胞NCM460中的BAP31mRNA表达量为对照,在DLD、HT29、SW620和HCT116细胞中BAP31的表达量相对于正常结肠上皮细胞NCM460中BAP31表达量的1.85、2.84、2.37和3.71倍(P<0.01),见图5A。以正常结肠上皮细胞NCM460中的BAP31表达量为对照,在DLD、HT29、SW620和HCT116细胞中BAP31蛋白的表达量是正常结肠上皮细胞NCM460中BAP31表达量的1.97、2.20、3.22、和2.81倍(P<0.01),见图5B、C。
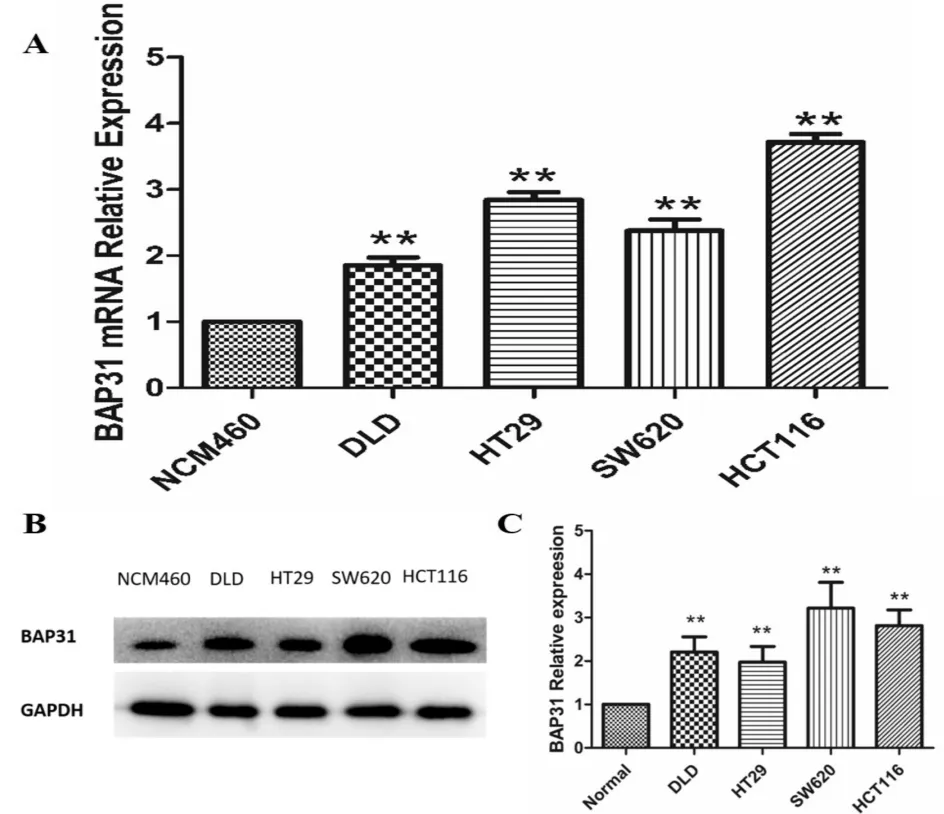
图5 BAP31在不同细胞系中的相对表达量注:A—DLD、HT29、SW620、HCT116和正常结肠上皮细胞NCM460中BAP31mRNA的相对表达量;B—DLD、HT29、SW620、HCT116和正常结肠上皮细胞NCM460中BAP31 蛋白的相对表达量;C—蛋白质灰度值扫描统计;与正常结肠上皮细胞NCM460相比,**P<0.01。
2.6 双荧光素酶报告基因证明BAP31为miR-451a的靶基因
经过RNAHybrid工具预测后,选择得分较高的3个位点,分别为BAP31上游177、上游148和开放阅读框内(Opening reading frame,ORF)666位点,同时也考虑了microRNA常用作用方式的3′-UTR区域来作为miR-451a的作用靶点进行研究,见图6A、C。将以上位点的序列克隆进psicheck-2.0载体中,检测载体上萤火虫萤光素酶和海肾萤光素酶的活性。萤光素酶报告基因的结果显示:与空白对照组相比,在BAP31ORF上游177、148、ORF666和3′-UTR的预测位点,通过miR-451a作用后,海肾荧光素酶的活性分别降低了80.3%、30.1%、44.6%和42.8%。实验结果表明miR-451a对BAP31的ORF177位点的作用最强能显著降低海肾荧光素酶的活性(P<0.01),见图6B。
图6 双荧光素酶报告基因检测注:A—RNAHybrid预测得分较高的上游177、上游148和开放阅读框内666位点与成熟miR-451a的结合位点示意图;B—双荧光素酶报告载体中所克隆的序列在BAP31基因上的位置示意图。C—各克隆片段双荧光素酶报告载体海肾荧光的相对强度。(与pSicheck空载体对照相比,** P <0.01)
2.7 过表达miR-451a,沉默BAP31可抑制结直肠癌细胞的增殖
HCT16、SW620转染pcDNA-miR451a、pcDNA-NC、psilencer-BAP31及对照质粒psilencer-Scr。结果显示:转染过表达miR-451a,沉默BAP31后,HCT116、SW620两株细胞分别在48 h后出现对细胞增殖的抑制作用,达到72 h时,抑制效果最为明显。HCT116细胞过表达miR-451a和沉默BAP31基因后,其48 h抑制率分别为:19.75%和28.23%,72 h抑制率分别为:39.50%和45.32%。SW620 细胞过表达miR-451a和沉默BAP31基因后,其48 h抑制率分别为:31.03%和29.25%,72 h抑制率分别为:39.50%和53.56%,见图7。

图7 过表达miR-451a和沉默BAP31后细胞活力测定注:A—HCT116细胞过表达miR-451a和沉默BAP31细胞相对活力;B—SW620细胞过表达miR-451a和沉默BAP31细胞相对活力
2.8 过表达miR-451a,沉默BAP31可诱导结直肠癌细胞凋亡的发生
HCT16、SW620转染过表达miR-451a质粒pcDNA-miR451a、对照质粒pcDNA-NC;psilencer-BAP31及对照质粒psilencer-Scr。通过Hocheast染色及AnnexinV-FITC/PI 双染色法流式细胞检测转染后48 h细胞凋亡情况。Hocheast染色结果表明:过表达miR-451a或沉默BAP31后,核碎裂增多,凋亡明显增加,见图8。AnnexinV-FITC/PI 双染流式细胞检测结果显示:过表达miR-451a 后HCT116凋亡增加13.57%,其中早期凋亡增加5.93%,晚期凋亡增加7.64%;沉默BAP31后HCT116凋亡增加5.62%,其中早期凋亡增加1.3%。晚期凋亡增加4.32%;过表达miR-451a后SW620的凋亡增加13.2%,其中早期凋亡增加7.1%。晚期凋亡增加6.1%;沉默BAP31后,SW620的凋亡增加8.68%,其中早期凋亡增加3.5%,晚期凋亡增加5.18%,见图9。

图8 Hocheast染色测定细胞凋亡(×100)
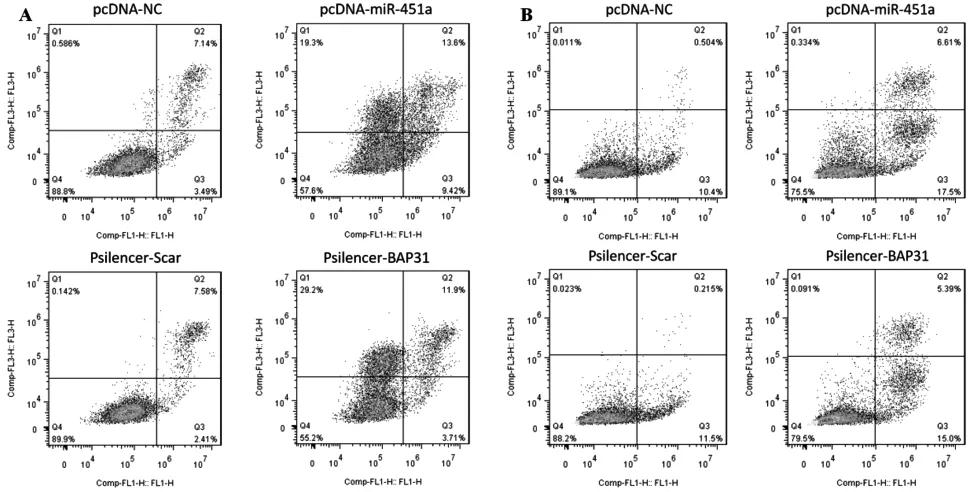
图9 双染法流式细胞检测过表达miR-451a和沉默BAP31后HCT116、SW620细胞凋亡情况
3 讨论
MiR-451a在慢性髓细胞白血病、胶质瘤细胞、非小细胞肺癌、胃癌、结直肠癌、乳腺癌等多种恶性肿瘤中低表达,同时在乳腺癌、卵巢癌耐药细胞株中也低表达,我们进一步在HCT116、HT29、SW480、SW620和DLD这五株结直肠癌细胞中也发现了miR-451a的表达较正常的结肠上皮细胞低,为后续抑制杂交消减文库建立筛选细胞奠定了实验基础。
为进一步研究miR-451a可能调控的基因,我们采用miR-451a相对表达最低的HCT116细胞,在只改变miR-451a表达量的前提下,建立了miR-451a差异表达的模型。首次利用SSH差异表达基因筛选的方法,建立了分别以转染空白对照慢病毒HCT16 cDNA为Tester,以过表达miR-451a的HCT116的cDNA为Driver,得到正向文库(FSL);再以过表达miR-451a的HCT116的cDNA为Tester,以转染空白对照慢病毒HCT16 cDNA为Driver得到反向文库(RSL),在结直肠癌中筛选到了miR-451a表达量改变后差异表达的基因。SSH的方法已在肺癌、食管癌、胃癌等重大疾病的差异表达基因的筛选上得到了成功的应用,它采用两次消减杂交和两次PCR,保证了高特异性;通过杂交操作,可以获得低丰度差异表达基因;使用SMARTerTMPCR cDNA Synthesis合成cDNA,只需2 ng总RNA,这对于微量RNA的富集起到了关键的作用。在我们建立的抑制杂交削减正向文库中我们得到了BAP31, EEF1A1, CDC20, WDR6, TUFM, RPL13 和 RPL7A这7个基因,在反向库中我们获得了DKK1, PSME1, NDUFA3 和GNB2这4个基因。这说明在结直肠癌中当我们上调miR-451a的表达后,BAP31, EEF1A1, CDC20, WDR6, TUFM, RPL13 和 RPL7A这7个基因的表达下降了,而同时DKK1、PSME1, NDUFA3 和GNB2这4个基因的表达却上调了。这提示我们BAP31, EEF1A1, CDC20, WDR6, TUFM, RPL13 和 RPL7A这7个基因有可能是作为miR-451a的直接靶基因被miR-451a所调控,而DKK1、PSME1, NDUFA3 和GNB2这4个基因有可能是作为miR-451a所调控的通路下游的分子,但仍受到miR-451a的调控,其更清晰的调控通路还需要进一步的研究来证明。
通过对文库中的基因的GO数据分析,我们发现miR-451a调控的这些基因参与了细胞生化过程、细胞组成和分子功能等方面所起到的作用,主要体现在参与与了转录延伸、蛋白质在内质网上的定位、蛋白质的翻译、以及polyA RNA的结合、负向调剂Wnt信号通路等过程。所以我们认为miR-451a在结直肠癌发生发展过程中的功能很可能是通过调控的这些基因参与了细胞分子的转运,细胞信号传导和细胞的增殖与生长。
BAP31在多种恶性肿瘤中高表达,我们进一步在HCT116、HT29、SW620和DLD这四株结直肠癌细胞中也发现了BAP31的表达较正常的结肠上皮细胞高,在后续的实验中,我们选择了BAP31表达相对较高的HCT116和SW620作为我们的研究对象。MicroRNA在对靶基因的调控上,经典的调控模式是与其靶基因的3′-UTR端进行结合调控,目前大多数中microRNA靶基因预测的软件大多基于这样的思想,在microRNA作用碱基的配对预测上,多采用microRNA5′端作用6-7个碱基严格配对的模式进行microRNA靶基因的预测。这种预测模式确实为microRNA所作用的靶基因的研究提供了大量的便利。但是随着对microRNA的研究越来越深入,大量的研究发现,microRNA对于靶基因的作用方式除了经典的3′-UTR的结合外,还有可能在基因的5′-UTR,ORF区域结合并发挥其调控作用[15-17]。这样多样的作用方式在为microRNA靶基因预测方面提出了新的挑战。我们在研究miR-451a能否直接调控BAP31的时候,通过经典的3′-UTR预测方法得到了结果显示miR-451a对于BAP31的3′-UTR区域的作用并不强烈。但是通过我们SSH文库中所得到miR-451a表达下调后BAP31的表达升高,在结直肠癌细胞中发现miR-451a的表达量较正常结肠上皮细胞NCM460表达下降,而BAP31表达较正常结肠上皮细胞NCM460中表达升高,以及在结直肠癌细胞中过表达miR-451a后BAP31的表达量下降了这些结果,我们还是想验证一下miR-451a是否能直接作用于BAP31。双荧光素酶结果让我们感到惊奇,miR-451a对BAP31的5‘-UTR区域序列产生较强的萤光素酶抑制作用,也就是说miR-451a可能是直接作用于BAP31的5′-UTR而发挥调控BAP31的作用的,这也证实了BAP31是miR-451a的直接作用靶基因。进一步研究了miR-451a是如何通过调控BAP31在结直肠癌中发挥作用的。通过我们的研究发现,过表达miR-451a或沉默BAP31 都能显著抑制结直肠癌细胞的增殖。进一步的研究我们发现,过表达miR-451a或沉默BAP31能够引起结直肠癌细胞的凋亡增加,甚至在HCT116细胞中,当过表达miR-451a或沉默BAP31时还能使部分细胞直接坏死。从这点看BAP31也有可能作为以后肿瘤治疗中的一个新靶点。
1 Globocan 2012, http://globocan.iarc.fr.
2 International Agence for Research on Cancer, http://ci5.iarc.fr.
3 Altuvia Y, Landgraf P, Lithwick G, et al. Clustering and conservation patterns of human microRNAs[J]. Nucleic Acids Res, 2005, 33(8): 2697-2706.
4 Lopotova T, Zackova M, Klamova H, et al.MicroRNA-451 in chronic myeloid leukemia: miR-451-BCR-ABL regulatory loop[J]. Leuk Res, 2001, 35(7): 974-977.
5 Godlewski J, Bronisz A, Nowicki MO, et al. MicroRNA-451: aconditional switch controlling glioma cell proliferation and migration[J]. Cell Cycle, 2010, 9(14): 2742-2748.
6 Zha W, Cao L, Shen Y, et al.Roles of mir-144-ZFX pathway in growth regulation of non-small-cell lung cancer[J]. PLoS One, 2013, 8(9): e74175-e74175.
7 Caruso P, MacLean ME, Khanin R, et al. Dynamic changes in lung microRNA profiles during the development of pulmonary hypertension due to chronic hypoxia and monocrotaline[J]. Arterioscler Thromb Vasc Biol, 2010, 30(4): 716-723.
8 Banfires E, Bitarte N, Arias F, et al. MicroRNA-451 regulates macrophage migration inhibitory factor production and proliferation of gastrointestinal cancer cells[J]. Clin Cancer Res, 2009, 15(7): 2281-2290.
9 Zhu H, Wu H, Liu X, et al. Role of microRNA miR-27a and miR-451 in their regulation of MDR1/P-glycoprotein expression in hum cancer cells[J]. Biochem Pharmacol, 2008, 76(5): 582-588.
10 吴春蓉,李生陆,罗治彬. 微小RNA-451对结肠癌细胞侵袭能力的影响[J]. 重庆医学, 2010, 39(14): 1813-1815.
11 吴春蓉,罗治彬,陈伟. MiR-451对结肠癌细胞系SW620生物学行为的影响[J].解放军医志, 2011, 36(5): 478-482.
12 Spiliotis ET, Manley H,Osorio M, et al. Selective export of MHC class I molecules from the ER after their dissociation from TAP[J]. Immunity, 2000, 13(6): 841-851.
13 Lambert, G, Becker B, Schreiber R, et al. et al. Control of cystic fibrosis transmembrane conductance regulator expression by BAP31[J]. J Biol Chem, 2001, 276(23): 20340-20345.
14 宋朝君,许晓光,陈丽华,等. BAP31在肿瘤组织中的表达分布的研究[J]. 中国免疫学会第五届全国代表大会暨学术会议摘要, 2006, 280-280.
15 Xu W, Wang Z, Liu Y. The characterization of microRNA-mediated gene regulation as impacted by both target site location and seed match type[J]. PLoS One, 2014, 9(9): 1-10.
16 Chi, SW, Hannon, GJ, Darnell, RB. An alternative mode of microRNA target recognition[J]. Nat Struct Mol Biol, 2012, 19(3): 321-327.
17 Miranda KC, Huynh T, Tay Y, et al. Apattern-based method for the identification of MicroRNA binding sites and their corresponding heteroduplexes[J]. Cell, 2006, 126(6): 1203-1217.
MiR-451aregulatedBAP31incolorectalcancercellsinducedapoptosis
Xu Ke, Han Bing, Bo Yang, Zhou Li-ming△
(Department of Pharmacology, West China School of Basic Medical Sciences & Forensic Medicine,Sichuan University, Sichuan Chengdu 610041)
Objective: To investigate the role of miR-451a and its target gene BAP31 in colorectal cancer cell lines.MethodsThe relative expression of miR-451a and BAP31 in colorectal cancer cell lines was detected by real-time PCR in HCT116, SW620, SW480 and DLD cells. The inhibitory subtractive library of colorectal cancer cell line miR-451a was established by suppressing subtractive hybridization method by using the different expressing of miR-451a HCT116 model. The BAP31 protein was selected as the study object of miR-451a.Luciferase reporter gene was used to determine whether BAP31 is directly regulated target genes of miR-451a by testing luciferase relative activity.The proliferation of colorectal cancer cells was evaluated by MTT assay. The apoptosis inducted by miR-451a regulated BAP31 was evaluated by flow cytometry and Hoechst staining.ResultsThe genes related to the possible regulation of miR-451a were obtained in the suppression subtractive library. Seven genes, such as BAP31, EEF1A1 and CDC20, were obtained in the positive library. DKK1, PSME1 and other genes were obtained in the reverse library. The relative expression levels of miR-451a in HCT116, HT29, SW480, SW620 and DLD colorectal cancer cells were 0.32, 0.40, 0.53, 0.43 and 0.73 times higher than those in normal colon epithelial cells NCM460. The relative expression of BAP31 in DLD, HT29, SW620 and HCT116 in colorectal cancer cells was 1.85, 2.84, 2.37 and 3.71 times higher than that in normal colon epithelial cells NCM460. Double-luciferase reporter gene experiments show that miR-451a can act on the upstream of the BAP31 open reading frame at 177 site, and the activity of renilla luciferase is reduced by 80.3%. Over-expressed miR-451a in the HCT116 and SW920 cells,the inhibitory rates of were 39.50% and 39.50% at 72 h, respectively; and the inhibitory rates were 58.32% and 53.56% at 72 h after silencing BAP31, respectively. The apoptosis of HCT116 and SW620 cells were increased 13.57% and 13.2% after 48 hours over-expressed miR-451a; the apoptosis of HCT116 and SW620 cells were increased 5.62% and 8.68%after 48 hours of silencing BAP31.ConclusionsMiR-451a can inhibit the proliferation of cells directly by regulating BAP31-induced apoptosis in colorectal cancer cells.
Colorectal cancer; miR-451a; BAP31; Apoptosis
许可,男,讲师,主要从事化疗药理研究,Email:xkkls37@hotmai.com。
△通讯作者:周黎明,女,教授,主要从事化疗药理研究,Email:zhou108@163.com。
2017-3-23)
