解毒扶正散对非小细胞肺癌免疫微环境的影响
2017-12-28孙龙华章淑芳罗来恒涂长英陈建建
孙龙华,章淑芳,罗来恒,涂长英,陈建建
(南昌市中西医结合医院呼吸内科,南昌 330003)
解毒扶正散对非小细胞肺癌免疫微环境的影响
孙龙华,章淑芳,罗来恒,涂长英,陈建建
(南昌市中西医结合医院呼吸内科,南昌 330003)
目的探讨非小细胞肺癌患者经中医方剂解毒扶正治疗后肿瘤免疫微环境相关细胞因子的变化,探索中医药治疗非小细胞肺癌的作用机制。方法将60非小细胞肺癌患者按随机数字表法分为治疗组和对照组:治疗组30例,采用化疗+解毒扶正散治疗;对照组30例,采用单纯化疗方案,共2个疗程,每个疗程28 d。采用ELISA检测2组患者外周血中干扰素(IFN-γ)、白细胞介素2(IL-2)、转化生长因子-β(TGF-β)的水平,采用流式细胞仪检测2组患者CD4+CD25+调节性T细胞的比例。结果治疗组和对照组性别、年龄比较差异无统计学意义(P>0.05)。治疗组较对照组血浆中IFN-γ、IL-2水平提高,CD4+CD25+调节性T细胞比例提高,TGF-β水平降低,差异均有统计学意义(均P<0.05)。结论解毒扶正散对非小细胞肺癌患者机体免疫功能调节具有一定的作用,可改善非小细胞肺癌患者肿瘤免疫微环境,为今后开展大样本、前瞻性临床研究提供了新的佐证。
解毒扶正散; 非小细胞肺癌; 肿瘤微环境
肺癌是我国癌症发病率首位的恶性肿瘤死亡原因,发病率及死亡率仍然在继续上升,在过去的30年内,我国肺癌死亡率增长迅速,分别增长了465%,肺癌死亡人数占所有恶性肿瘤死亡人数的22.7%,在2008年肺癌已经取代肝癌成为中国死亡人数最高的肿瘤[1]。传统中医学认为肺癌的发病机理是正气虚损,阴阳失调从而导致邪气乘虚入肺及肺脏功能失调、肺气壅塞、气血瘀滞。影响津液输布,导致痰湿内蕴、郁久化热成毒,积于两肺而成肺癌。因此,传统中医药在治疗肺癌中多以扶正、活血化瘀、清热、解毒等祛邪为主。肺癌的生长不仅受到肿瘤自身遗传学和生物学的调控,而且受到肺癌所处微环境的影响。肿瘤微环境是肿瘤细胞和相邻正常组织之间部位,是由细胞外基质、可溶性分子和肿瘤基质细胞所组成。肿瘤微环境对肿瘤增殖生长、侵袭、转移以及新生血管的形成具有重要影响,研究肿瘤微环境已经成为当今肿瘤防治中的一大热点。
1 对象与方法
1.1 研究对象
收集2014年8月至2017年1月间南昌市中西医结合医院呼吸内科初诊初治非小细胞肺癌患者60例,所有患者不合并自身免疫性疾病,均经病理组织证实为非小细胞肺癌。有吸烟史30例。将60例患者按随机数字表法分为治疗组和对照组,2组患者性别、年龄、病程比较差异无统计学意义(P>0.05),见表1。

表1 非小细胞肺癌患者临床特点
1.2 治疗方法
所有入选患者均获得知情同意。治疗组治疗方法是化疗方案上加上解毒扶正散方剂,该方剂由解毒草、仙鹤草、青天葵、生龙骨、野菊花、白花舌蛇草、黄芪和白术组成,每日1剂,每剂药煎成2袋,每袋120 mL,分早晚2次顿服,连续服用56 d。
1.3 主要仪器与试剂检测方法
Bio-Rad550分光光度仪(美国Bio-Rad公司);FACS Calibur流式细胞仪(Becton Dickinson公司);淋巴细胞分离液(上海精诚化学试剂有限公司);TGF-β、IL-2、INF-γ的ELISA试剂盒(北京天根生物技术公司)。
1.4 标本处理
采集肺癌患者空腹状态下的外周血约4 mL,每份2 mL。一份离心后取血清保存于-20 ℃冰箱中,用于检测TGF-β、IL-2、INF-γ。另外一份用肝素抗凝,采用淋巴计数分离液分离外周血单个核细胞,计数细胞后调整细胞浓度至1×106~2×106以流式细胞检测CD4+CD25+调节性T细胞。
1.5 流式细胞仪检测CD4+CD25+调节性T细胞的比例(%)
取100 μL人外周血单个核淋巴细胞加入Ep管中,分别加入10 μL FITC标记的鼠抗人CD4、PE标记的CD25抗体,避光孵育30 min后加入PBS洗涤2次,水平离心2000 r×5 min,弃上清,加入500 μL PBS重悬细胞后用流式细胞仪检测。
1.6 TGF-β、IL-2、IFN-γ检测
分别取肺癌患者血清约100 μL加入待测孔,反应板充分混匀后37 ℃下放置120 min,洗涤液洗涤反应板4~6次后每孔加入第一抗体工作液50 μL,37 ℃下放置60 min,洗板后每孔加入酶标抗体工作液100 μL,37 ℃下放置60 min,洗板后每孔加入底物工作液100 μL,37 ℃暗处反应5~10 min,每孔加1滴终止液混匀后于450 nm处吸光值。分别与TGF-β、IL-2和IFN-γ的标准曲线图上根据样品的OD值查出相应的TGF-β、IL-2和IFN-γ值。
1.7 统计学方法
2 结果
2.1 2组患者在治疗结束后外周血中CD4+CD25+调节性T细胞比例
治疗结束后治疗组非小细胞肺癌患者外周血CD4+CD25+调节性TCD4+T细胞比例为(48.00±14.67)%,而对照组治疗结束后外周血CD4+CD25+调节性TCD4+T细胞比例为(37.03±16.20)%,组间比较差异有统计学意义(P<0.05)。见表2。
2.2 2组治疗后外周血中TGF-β、IL-2、IFN-γ检测结果比较
治疗结束之后治疗组、对照组中非小细胞肺癌患者外周血中TGF-β水平分别为(47.03±10.80)pg·mL-1和(68.09±9.83)pg·mL-1,IL-2水平分别为(31.03±0.62)pg·mL-1和(18.00±0.42)pg·mL-1,IFN-γ水平分别为(33.93±1.89)pg·mL-1和(23.03±10.87)pg·mL-1。治疗后2组患者外周血中TGF-β、IL-2、IFN-γ水平比较差异均有统计学意义(均P<0.05),见表2。
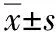

组别nCD4+CD25+T细胞比例/%IL-2ρ/(pg·mL-1)TGF-βρ/(pg·mL-1)IFN-γρ/(pg·mL-1)治疗组3048.00±14.6731.03±0.6247.03±10.8033.93±1.89对照组3037.03±16.20#18.00±0.42#68.09±9.83#23.03±10.87#
#P<0.05与治疗组相比。
3 讨论
随着我国社会经济的发展以及人口老龄化,恶性肿瘤的发病率逐渐上升,癌症已成为人类健康的第一杀手。2016年世界肿瘤顶级期刊(Cancer J Clin)发表了我国国家癌症中心Chen等[2]的文章,数据显示我国2015年共有429.2万新发肿瘤病例和281.4万癌症死亡病例。其中肺癌的发病率最高,并且死亡率也是排在各种肿瘤之首。肺癌是所有癌症死亡的首要因素,占所有癌症的17%,肺癌死亡率较高,究其原因是大多数肺癌癌细胞很快对化疗药物出现耐药,甚至对治疗出现抵制作用,尽管近20年来随着显微外科、放疗、免疫治疗、化疗及分子靶向药物治疗的显著提高,肺癌的治疗技术有着突飞猛进的发展,即便如此发达国家肺癌的5年生存率也仅仅维持在11%~16%的水平[3]。
Hanahan等[4]在2000年基于肿瘤细胞内信号变化,提出生长信号、凋亡信号、复制潜能、侵袭转移等恶性肿瘤六大特征,强调肿瘤细胞在肿瘤发生发展过程中处于核心地位。10年后,Hanahan等[5]又在Cell杂志发表文章,提出肿瘤的发生发展不仅仅取决于肿瘤细胞本身,而且及其以来肿瘤细胞生存的土壤也就是肿瘤微环境,肿瘤微环境也是肿瘤的一个显著特征。肿瘤微环境一旦形成,诸多免疫细胞及分子大量聚集共同促进肿瘤免疫逃逸、肿瘤生长及转移。最近研究表明,肿瘤微环境内的免疫耐受是导致这种情况发生的最关键原因[6]。肿瘤微环境作为肿瘤免疫效应阶段的执行场所,其内存在许多因素参与肿瘤组织与免疫系统的相互作用,包括局部效应细胞功能障碍、抑制性免疫调节细胞Treg、细胞因子的免疫负调节作用、抑制性配体受体反应以及肿瘤微环境中T细胞代谢活性的负调节等[7]。在肿瘤微环境免疫抑制网络中TGF-β处于关键地位,肿瘤细胞、肌成纤维细胞、髓系来源抑制细胞、肿瘤相关巨噬细胞以及调节性T细胞等均可分泌高水平的TGF-β,而TGF-β可促进微环境中成纤维细胞的趋化和活化,激活免疫细胞与基质上皮细胞的对话,促进上皮-间质转型,并能诱导多种细胞因子的表达比如VEGF、金属蛋白酶MMP-2、MMP-9、负调控金属蛋白酶抑制因子,促进血管形成,最终导致肿瘤微环境改变,使其有利于肿瘤的浸润转移,血浆中增高的TGF-β水平常与肿瘤转移及不良预后相关[8]。CD4+CD25+T细胞(Treg)是一类免疫调节细胞,由胸腺产生,表达L-10等免疫抑制因子,细胞表面表达L-2受体α链(CD25),本身不产生L-2。Treg细胞主要是通过细胞-细胞接触依赖方式发挥免疫抑制作用,在调控自身免疫性疾病的发生、炎症反应和T细胞稳态中发挥重要作用[9]。研究结果显示Treg细胞广泛存在于多种肿瘤组织中,并且起到免疫抑制作用,而在肿瘤组织微环境中消除该类细胞,则在一定程度上可抑制肿瘤的发展[10]。本研究表明,解毒扶正散能够降低肿瘤患者外周血中TGF-β水平,提高CD4+CD25+T细胞比例,也有类似研究表明中医药方能够抑制非小细胞肺癌细胞中TGF-β水平从而抑制上皮间质转化来调控肺癌转移[11]。
中医药在肿瘤防治中有重要地位,具有改善症状、提高生活质量、稳定病灶等诸多作用。本院呼吸科根据中医经典著作《素问·刺法论》有云:“正气存内,邪不可干”,“邪之所凑,其气必虚”,肺癌发病机理是全身的正气不足,外邪入侵,同时又有局部的热毒内聚、痰凝气滞、瘀阻脉络,而我省地处南方,夏天湿热气候比较容易导致人体的阳热偏盛而发病。笔者提出在治疗肺癌时应在扶正的基础上,重视对热毒的清除,研制出肺癌治疗的协定处方解毒扶正散(由解毒草、仙鹤草、青天葵、生龙骨、野菊花、白花舌蛇草、黄芪和白术组成),该方具有益气扶正、清热解毒、化痰散结、祛瘀通络的功效,方中解毒草、野菊花和仙鹤草均可清热解毒,青天葵清肺止咳、散瘀消肿,黄芪补中益气,生龙骨安神潜阳、白花舌蛇草清热、利湿、解毒和抗癌。更主要的是解毒草、仙鹤草、青天葵、生龙骨、野菊花、白花舌蛇草均具有寒凉收敛之性,而现代药理研究发现,清热解毒可抑制肿瘤细胞增殖且能够诱导肿瘤细胞凋亡、调节免疫及细胞信号通路发挥多途径多靶点抗肿瘤作用[12]。中医理论认为清热解毒药物与肿瘤具有不受控制的向外生长浸润和转移的“阳热特性”相反。
笔者通过化疗联合解毒扶正散治疗非小细胞肺癌,发现解毒扶正散能够提高INF-γ、IL-2水平及CD4+CD25+T细胞比例,而降低TGF-β水平,说明解毒扶正散可能具有干预微环境改善肺癌免疫抑制状态的作用。本课题通过干预非小细胞肺癌的免疫微环境,寻求经济低廉、毒副作用小、疗效好的免疫治疗方法,以提高肺癌综合治疗的水平,为中西医结合治疗肺癌提供新的思路。
[1] She J,Yang P,Hong Q,et al.Lung cancer in China:challenges and interventions[J].Chest,2013,143(4):1117-1126.
[2] Chen W,Zheng R,Peter D.Cancer statistics in China[J].CA Cancer J Clin,2016,66(2):115-132.
[3] Rafael R,Niki K.Lung cancer in 2014:optimizing lung cancer treatment approaches[J].Nat Rev Clin Oncol,2015,12(2):75-76.
[4] Hanahan D,Weinberg R A.The hallmarks of cancer[J].Cell,2000,100(1):57-70.
[5] Hanahan D,Robert W A.Hallmarks of cancer:the next generation[J].Cell,2011,144(5):646-674.
[6] Haratani K,Hayashi H,Tanaka T,et al.Tumor immune microenvironment and nivolumab efficacy in EGFR mutation-positive non-small-cell lung cancer based on T790M status after disease progression during EGFR-TKI treatment[J].Ann Oncol,2017,28(7):1532-1539.
[7] 胡多.肿瘤微环境中的免疫效应抑制[J].国际病理科学与临床杂志,2006,27(2):108-111.
[8] De la Fuente M,Thuwajit D.Chronic inflammation and cytokines in the tumor microenvironment[J].J Immunol Res,2014,2014:149185.
[9] Rudge G,Gleeson P A,van Driel I R.Control of immune responses by immunoregulatory T cells [J].Arch Immunol Ther Exp(Warsz),2006,54(6):381-391
[10] Jaehong K,Jong Sup B.Metabolic regulation of macrophages in tumor microenvironment[J].Curr Opin Hematol,2017,24:1065-1251.
[11] He X R,Han S Y,Li X H,et al.Chinese medicine Bu-Fei decoction attenuates epithelial-mesenchymal transition of non-small cell lung cancer via inhibition of transforming growth factor β1 signaling pathway in vitro and in vivo[J].J Ethnopharmacol,2017,204:45-57.
[12] 熊露,田少霞.扶正培本治则方药调节肿瘤微环境免疫与血管正常化的思路研究[J].中国中西医结合杂志,2010,30(2):201-204.
EffectofJieduFuzhengSanonTumorImmuneMicroenvironmentofNon-SmallCellLungCancer
SUNLong-hua,ZHANGShu-fang,LUOLai-heng,TUZhang-ying,CHENJian-jian
(DepartmentofRespiratoryMedicine,NanchangHospitalofIntegrativeTraditionalChineseandWesternMedicine,Nanchang330003,China)
ObjectiveTo investigate the changes in cytokines in tumor immune microenvironment of non-small cell lung cancer(NSCLC) after treatment with Jiedu Fuzheng San,and to explore the mechanism of action of traditional Chinese medicine for NSCLC.MethodsSixty NSCLC patients were randomly given chemotherapy alone(control group,n=30) or in combination with 2 courses of 28-day Jiedu Fuzheng San treatment(treatment group,n=30).The levels of interferon-γ(IFN-γ),interleukin-2(IL-2) and transforming growth factor-β(TGF-β) in peripheral blood were measured by ELISA.The proportion of CD4+CD25+T cells was analyzed by flow cytometry.ResultsThere were no significant differences in gender and age between the two groups(P>0.05).Compared with control group,the levels of IFN-γ and IL-2 and proportion of CD4+CD25+T cells increased but the levels of TGF-β decreased in treatment group(P<0.05).ConclusionJiedu Fuzheng San can regulate immune function and tumor microenvironment in patients with NSCLC.These results provide new evidence for prospective and controlled clinical trial.
Jiedu Fuzheng San; non-small cell lung cancer; tumor microenvironment
2017-08-18
江西省自然科学基金(20151BAB205036);江西省卫生计生委中医药科研课题(赣卫中医字【2015】21号2015A026;赣卫科教字【2015】26号20167035)
孙龙华(1982—),男,博士,主治医师,主要从事肺癌、COPD研究。
R734.2
A
1009-8194(2017)10-0001-03
10.13764/j.cnki.lcsy.2017.10.001
刘大仁)
