穴位埋线对实验自身免疫性葡萄膜炎大鼠眼部炎症影响的研究
2017-12-28赵建英郝小波郑凤鸣黄素珍吴含青郭大东
赵建英 郝小波 郑凤鸣 黄素珍 吴含青 郭大东
穴位埋线对实验自身免疫性葡萄膜炎大鼠眼部炎症影响的研究
赵建英1郝小波1郑凤鸣2黄素珍3吴含青4郭大东5
目的探讨穴位埋线疗法对治疗EAU大鼠眼部炎症情况的影响变化。方法Lewis大鼠随机分为对照组3只、EAU组24只和穴位埋线(ACE)组24只。除对照组外,均使用光感受器间维生素A结合蛋白(IRBP)免疫造模形成EAU组,ACE组为造模成功后次日进行穴位埋线,分别观察眼前段炎症变化并记录免疫后9d、13d、18d及23d不同时间段的眼部房水蛋白量。结果造模后13d是炎症的高峰期,该时段模型鼠眼前段炎症及房水蛋白量均达到高峰,EAU组房水蛋白浓度为41.15±3.91mg/ml,ACE组13d房水蛋白浓度为21.85±1.70mg/m;不仅如此,在观察的4个时间段中,ACE组房水蛋白量均低于EAU组(P<0.01)。结论穴位埋线疗法能减轻EAU大鼠眼前段炎症反应,同时还可以减轻由于眼前段炎症导致的房水蛋白量的急剧升高,因此该疗法在调节免疫状态方面是一种有积极有效的绿色疗法。
穴位埋线; 自身免疫性葡萄膜炎; 实验; 大鼠; 房水蛋白
葡萄膜炎是一种多发于青壮年的眼病,在致盲眼病中占有重要地位,已引起世界范围内的重视[1]。由于该病是一种自身免疫性眼病,治疗上以免疫抑制疗法为主,包括激素和激素替代治疗,长期使用副作用明显[2]。传统中医药观点认为,免疫系统是机体阴阳平衡的调节系统。临床发现运用穴位埋线疗法对葡萄膜炎免疫调节有一定的治疗作用[3,4],因此借助于广泛应用于人类自身免疫性葡萄膜炎发病机理及药物治疗的研究[5,6]的动物模型——视网膜蛋白作为抗原诱发的实验性自身免疫性葡萄膜炎(Experimental autoimmune uveitis,EAU)来进行试验研究,本研究旨在研究穴位埋线(Acupoint catgut embedding,ACE)对EAU大鼠眼部炎症的影响,为临床治疗提供实验依据。
1 材料与方法
1.1 实验动物及喂养
6~8周龄雌性SPF级Lewis大鼠,体重140~160g(北京维通利华实验动物有限公司,大鼠许可证号:SCXK(京)2017-0001)。实验大鼠饲养于广西中医药大学第一附属医院试验动物房。实验研究方案、实验动物的应用及喂养均得到广西中医药大学第一附属医院实验室动物管理和使用委员会的批准。所有动物均按照视觉与眼科学研究学会中对动物进行眼科与视觉研究实验的要求饲养与处理。
1.2 主要试剂及仪器
埋线材料及主要实验试剂、仪器:埋线材料由北京任晓艳穴位埋线医疗研究中心提供(专利号:2004200665990,京药监械(准)字2005第2270643号,京药管械生产许20040062号);光感受器间维生素A结合蛋白[IRBP,1177-1191,氨基酸序列:ADGSSWEGVGVVPDV,(上海生工生物工程股份有限公司合成)];结核菌素[tuberculin,TB(美国Difco公司)];CFA[完全弗氏佐剂(美国Sigma公司)];数码眼前节照相(日本TOPCON公司);K5600超微量分光光度计(北京凯奥科技发展有限公司)。
1.3 方法
动物分组与造膜 分组: 将51只大鼠按随机数字表将随机分为空白对照组3只(注射生理盐水),模型组(造模后无任何干预措施),穴位埋线组(造模后第2天经行穴位埋线),每组各24只。造模: Lewis大鼠在裂隙灯下排除其他眼部疾病,在动物房饲养1周后进行造模。参照文献[7-9]方法按每只IRBP(光感受器间维生素A类结合蛋白)100ug,TB(结核杆菌)100ug,CFA(完全弗氏佐剂)150ul,PBS(磷酸缓冲盐溶液)150ul制备乳糜液。注射麻醉后分别于大鼠双后足垫及脊柱正中两旁皮下,共4个部位建立实验性自身免疫性葡萄膜炎动物模型(EAU)。②穴位埋线 大鼠穴位的选择依据《实验针灸学》及华兴邦等所著大鼠穴位图谱[10,11]。分别选取脾俞:第12胸椎下两旁,肋间,左右侧各一穴;肾俞:第2腰椎下两旁,左右侧各一穴。③选穴 首先对照大鼠解剖图谱选取相应穴位,尓后将大鼠麻醉后处死进行解剖学上进一步确认的前期准备,最终选取穴位后标记。④消毒 进针前该区域备皮及碘伏消毒。⑤进针 将1cm左右羊肠线推入相应穴位皮下至肌层,线头不外露,无菌棉签按压针孔处止血。每穴1 针。⑥注意事项 埋线后立即更换干燥清洁垫料。⑦EAU大鼠眼部炎症观察及组织病理学检查 免疫后每天定时通过数码眼前节照相机观并记录察EAU组和埋线组大鼠眼部炎症情况。参照文献[12]方法对眼部炎症进行分级。⑧EAU大鼠房水蛋白测量及血清白蛋白、球蛋白检验 大鼠均在第9d、13d、18d、23d分别给予前房穿刺,虹吸管收集房水,分别注入无菌EP管中,使用K5600超微量分光光度计进行蛋白浓度检测;同时经心脏取血,保存于肝素涂抹的EP管,收集外周血样本,以3000 r/min,4°离心3min,取上清液,-80°保存待测。
1.4 统计学处理
2 结果
2.1 EAU大鼠眼部炎症变化(图1)
通过数码眼前节照相机观察发现,免疫后5d EAU组和ACE组大鼠开始出现虹膜血管轻度扩张、充血,造模成功后次日进行穴位埋线治疗。免疫后5d两组大鼠眼部均出现明显的炎症表现,如虹膜血管轻、中度扩张充血、瞳孔缩小及前房混浊,9dEAU组大鼠炎症评分为2.667±0.577,ACE组大鼠炎症评分为1±0.5774;12d两实验组大鼠均出现最严重眼部炎症表现,如虹膜严重充血、前房大量纤维蛋白渗出、瞳孔膜闭等,EAU组大鼠炎症评分为3.667±0.5774,ACE组大鼠炎症评分为1.333±0.5774,随后炎症反应逐渐减轻,至免疫后20d炎症基本消退。
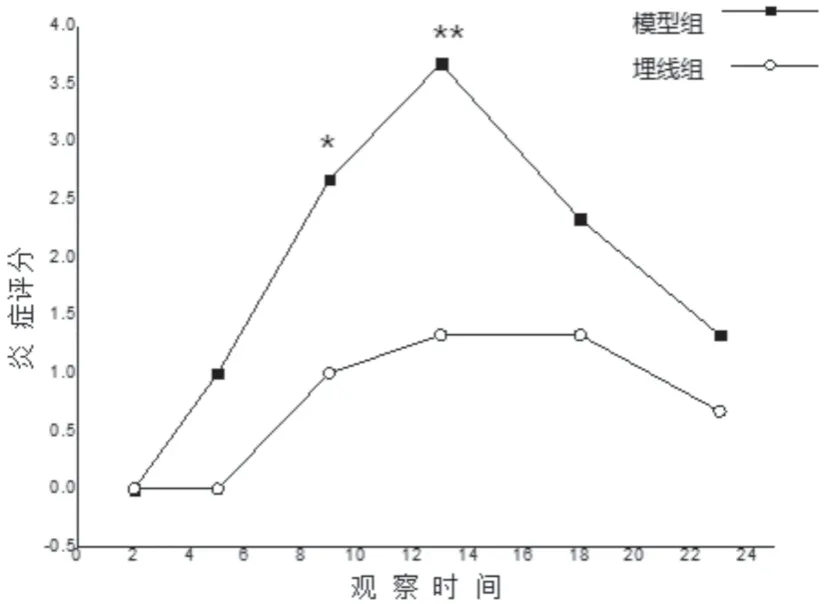
图1 同一时间段与埋线组比较,*P<0.05,**P<0.01
2.2 EAU大鼠房水蛋白变化
房水蛋白定量分析显示,空白对照组大鼠房水蛋白浓度为2.03±0.33 mg/ml,免疫后9d,EAU组房水蛋白浓度为12.97±2.86mg/ml,ACE组为7.63±0.35mg/ml;免疫后13d房水蛋白量相对达到高峰,EAU组房水蛋白浓度为41.15±3.91mg/ml,埋线组为21.85±1.70mg/ml,随后房水蛋白浓度开始下降,免疫后18dEAU组房水蛋白浓度为19.03±6.20mg/ml,ACE组为11.69±4.34mg/ml;免疫后23dEAU组房水蛋白浓度为8.34±0.38mg/ml,ACE为6.68±1.64mg/ml。EAU组与ACE组组间各个时间段房水蛋白量均高于空白对照组(P<0.01),不同时间段房水蛋白浓度EAU组均高于ACE组,差异有统计学差异(P<0.01)。EAU组及ACE组在观察的4个阶段中(F=47.12~81.62),两组房水蛋白量均显著高于对照组(P=0.00),组内观察两组分别在第13d、18d与9d比较,差异有统计学意义(P<0.01~0.05),第23d与9d比较无统计学差异(P<0.05)。

图2
3 讨论
通过对EAU大鼠眼部炎症观察发现,免疫后13d为炎症高峰期,该阶段可以从眼前段表现及房水蛋白来相互验证。眼前段表现为前房积脓、重度纤维蛋白渗出、虹膜血管充血严重甚至瞳孔膜闭等症状;房水蛋白也显示免疫后13d,前房穿刺取房水较其它阶段均困难,分析原因,考虑该阶段房水处于相对凝固状态、量少[13],EAU组、ACE组房水蛋白浓度不仅高于正常组,而且明显高于其它观察阶段。
从治疗疗效分析,通过穴位埋线治疗后13d穴位埋线组大鼠眼部炎症比EAU组减轻,测量大鼠房水蛋白浓度进一步可以证实。免疫后13d、18d及23dACE组均明显低于EAU组,说明穴位埋线法在减轻大鼠EAU眼部症状[14]、减少房水蛋白生成,加速减轻眼部炎症反应方面有一定的治疗作用。
穴位埋线疗法是经络理论与现代医学相结合的产物,使用可降解生物线体这种异物组织对穴位产生持久而柔和的生理、物理和生物化学的刺激,从而达到协调脏腑,平衡阴阳,疏通经络,调和气血,补虚泻实,扶正祛邪及免疫调节双向作用。郝小波提出穴位埋线可适宜用与慢性、顽固性眼病的治疗[15]。虽然穴位埋线可以在EAU动物模型中减轻眼部炎症方面有一定的治疗作用,但是查阅相关文献报道,运用某些中药[13]可以在造模后20d将造模鼠房水蛋白降低至正常,相比之下穴位埋线暂未发现具有强效的抗炎效果。考虑到免疫调节紊乱是导致该病发生的直接原因,穴位埋线应该是通过多种途径改善机体自身免疫反应,为此我们应该探寻更多的在调节自身免疫方面有效的绿色疗法,以便临床上可以在多种有效的疗法上相应的自由选择组合,力求更大效益的为病人服务,进而为自身免疫性葡萄膜炎的治疗提供了新的思路,但其发挥作用的具体相关机制还需要进一步实验研究。
感谢:山东中医药大学眼科研究所老师给予实验的帮助和指导。

表1
组间不同时间段资料采用独立样本t检验,与EAU组比较#P<0.01;组内资料比较采用单因素方差分析ANOVA,各组间的两两比较采用LSD检验,与9d比较,@P<0.01,*P<0.05
[1] 刘家琦,李凤鸣.实用眼科学[M].北京:人民卫生出版社,2010:8.
[2] 于晋懿,卢弘.非感染性葡萄膜炎的免疫抑制治疗[J].眼科新进展,2014,34(7):695-700.
[3] 张馨,郝小波.穴位埋线对慢性葡萄膜炎患者T淋巴细胞亚群的影响[J].南京中医药大学学报,2013,29(2):129-131.
[4] 郑凤鸣,郝小波,赵建英.穴位埋线对大鼠实验性自身免疫性葡萄膜炎治疗作用的研究[J].中国中医眼科杂志,2015,25(5):309-313.
[5] Caspi RR.A look at autoimmunity and inflammation in the eye[J].J Clin Invest,2010,120(9):3073-3083.
[6] Fang CB,Zhou DX,Zhan SX,He Y,Lin Z,Huang C,Li J.Amelioration of experimental autoimmune uveitis by leflunomide in Lewis rats[J].PLoS One,2013,8(4): e62071.
[7] Cortes L.M,Avichezer D,Silver P.B,Luger D,Mattapallil M.J,Chan C.C,Caspi R.R.Inhibitory peptide analogs derived from a major uveitogenic epitope protect from antiretinal autoimmunity by inducing type 2 and regulatory T cells[J].J Leukoc Bio,2008,84(2):577 - 585.
[8] Cui Y,Shao H,Sun D,Kaplan HJ.Regulation of interphotoreceptor retinoid-binding protein(IRBP)-specific Th1 and Th17 cells in anterior chamber-associated immune deviation(ACAID)[J].Invest Ophthalmol Vis Sci,2009,50(12):5811-5817.
[9] Tian Q,Bi H,Cui,Y,Guo D,Xie X,Su W,etal.Qingkailing injection alleviates experimental autoimmune uveitis in rats via inhibiting Th1 and Th17 effector cells[J].Biol Pharm Bull,2012,35(11):1991-1996.
[10] 李忠仁,新世纪全国高等中医药院校规划教材[M].中国中医药出版社,2003:329.
[11] 华兴邦,李辞蓉,周浩良,等.大鼠穴位图谱的研制[J].实验动物与动物实验,1991,1:1-4.
[12] Agarwal RK,Silver PB,Caspi RR.Rodent models of experimental autoimmune uveitis[J].MethodsMolBiol,2012,900:443-469.
[13] 唐凯,郭大东,张莲,司俊康,杜宇翔,毕宏生.龙胆泻肝汤对大鼠实验性自身免疫性葡萄膜炎的治疗作用[J].眼科新进展,2015,35(4):305-309.
[14] 郑凤鸣,郝小波,赵建英,张莲,郭大东.穴位埋线对大鼠实验性自身免疫性葡萄膜炎治疗作用的研究[J].中国中医眼科杂志,2015,25(5):309-313.
[15] 郝小波.眼病中医外治[M].南宁:广西民族出版社,2014:36-39.
Effectofacupointcatgutembeddingonocularinflammationinexperimentalautoimmuneuveitisrats
ZHAOJian-ying1,HAOXiao-bo1,ZHENGFeng-ming2,HUANGSu-zhen3,WUHan-qing4,GUODa-dong5
(1.TheFirstAffiliatedHospitalofGuangxiUniversityofChineseMedicine,Nanning,Guangxi,530023;2.ChineseMedicineHospitalShangyuShaoxing,Shaoxing,Zhejiang,312300;3.DongguanHumenZhongYiyuan,Dongguan,Guangdong,523902;4.GuangxiInternationalZhuangHospital,Nanning,Guangxi,530001;5.EyeInstituteofShandongUniversityofTCM,Jinan,Shandong,250002)
ObjectiveTo explore the effect of acupoint catgut embedding therapy on ocular inflammation in EAU rats.MethodsLewis rats were randomly divided into control group(n=3),EAU group(n=24)and acupoint catgut embedding(ACE)group(n=24).(IRBP)was used to form EAU group.The ACE group was treated with acupoint catgutation after the success of the model.The changes of the anterior segmental inflammation were observed and 9 days after the immunization.13d,18d and 23d at different times of eye aqueous protein.ResultsT The peak of inflammation and the amount of aqueous protein in the model group were 41.15 ± 3.91mg / ml,and the aqueous protein concentration in the ACE group was 21.85 ± 1.70mg / m;not only that,in the observation of the four time periods,ACE group of aqueous protein levels were lower than EAU group(P<0.01).ConclusionAcupoint catgut embedding therapy can reduce the anterior segment of the EAU rat inflammatory response,but also can reduce the anterior segment of the inflammation caused by the rapid increase in the amount of aqueous humor protein,so the regulation of immune status is a positive and effective green therapy.
Acupoint catgut embedding; Autoimmune uveitis; Experiment; Rat; Aqueous protein
1. 广西卫生自筹计划课题(Z20170279)2. 2017广西中医药大学校级面上项目(2017MS029) 3. 国家自然科学基金(81360558);4. 广西自然科学基金项目(2010GXNSFA013208);5. 广西自然科学基金项目(0342042);6. 广西科技攻关计划项目(12300020)7. 广西高校科学技术研究项目(KY2015YB157)8.山东省中医药科技发展计划项目(编号:2013ZDZK-083)
1.530023,广西南宁,广西中医药大学第一附属医院;2.312300,浙江绍兴,绍兴市上虞中医医院;3.523902,广东东莞,东莞市虎门中医院;4.530001,广西南宁,广西国际壮医医院;5.,250002,山东济南,山东中医药大学眼科研究所
郝小波,E-mail:562695922@qq.com
10.3969/j.issn.1674-9006.2017.04.003
R77
