美发网菌子实体和原质团中甾醇类物质含量测定方法研究
2017-12-28刘宇光仲慧格王淑敏
刘宇光,解 甜,唐 兰,仲慧格,王淑敏
(长春中医药大学,吉林 长春 130117)
美发网菌子实体和原质团中甾醇类物质含量测定方法研究
刘宇光,解 甜,唐 兰,仲慧格,王淑敏*
(长春中医药大学,吉林 长春 130117)
建立利用高效液相色谱测定美发网菌子实体和原质团中麦角甾醇和豆甾醇含量的方法。麦角甾醇含量测定色谱条件:岛津Inerlsil ODS-SP C18柱(4.6 mm×250 mm,5 μm);以甲醇为流动相;检测波长为281 nm;流速为1 mL·min-1;柱温为28℃;进样量为10 μL。豆甾醇含量测定色谱条件:汉邦ODS C18色谱柱(4.6 mm×250 mm,5 μm);以乙腈-水(96:4) 为流动相;检测波长为204 nm;流速为0.8 mL·min-1;柱温为35℃;进样量为10 μL。麦角甾醇在进样量0.2004 μg~0.8016 μg范围内与吸收峰面积呈良好线性关系,回归方程y=1E+06x-9625.3,r=0.9999。豆甾醇在进样量0.0408 μg~0.3208 μg范围内与吸收峰面积呈良好线性关系,回归方程y=4E+06x-37149,r=0.9995。应用高效液相色谱法建立的测定方法可以快速准确地测定美发网菌子实体、原质团中麦角甾醇和豆甾醇的含量,可作为美发网菌质量控制方法。
美发网菌;麦角甾醇;豆甾醇;高效液相色谱
美发网菌(Stemonitis splendens Rost)隶属于发网菌科 (Stemonitidaceae) 发网菌属 (Stemonitis)。因其个体微小、生命周期短,来源有限,目前仅在子实体化学成分分析方面有文献报道[1-2]。本研究旨在建立美发网菌子实体和发酵物原质团中麦角甾醇和豆甾醇的色谱检测方法,并且首次对美发网菌目黏菌进行麦角甾醇的含量测定。甾醇广泛存在于真菌和黏菌内[2-5],研究发现甾醇类及其过氧化物具有显著抗炎、镇痛、抗癌以及降低胆固醇的生物活性[6-14],所以本研究对美发网菌及其发酵产物中麦角甾醇和豆甾醇含量建立的高效液相色谱测定方法,不仅可以为美发网菌甾醇类成分质量控制提供科学依据,亦可为进一步研究开发其医药价值提供理论基础。
1 仪器与试药
AUY220分析天平,岛津国际贸易上海有限公司;KQ-500DA型数控超声波清洗器,昆山市超声仪器有限公司;RE-52AA旋转蒸发仪,上海亚荣生化仪器厂;岛津LC-20AT高效液相色谱仪,岛津国际贸易上海有限公司。麦角甾醇对照品,中国药品生物制品检定所,批号:MUST-11070601,纯度>98%;豆甾醇对照品,美国Sigma公司,批号:lot#BCBR7558V,纯度约等于95%;甲醇、乙腈均为色谱纯,美国Fisher公司;其他试剂均为分析纯。
2 方法
2.1 麦角甾醇含量测定试验方法
2.1.1 色谱条件
以十八烷基硅烷键合硅胶为填充剂(Inerlsil ODS-SP C18色谱柱,4.6 mm×250 mm,5 μm),以甲醇为流动相,检测波长为281 nm,流速为1.0 mL·min-1,柱温为 28℃,进样量为 10 μL[8]。理论塔板数按麦角甾醇峰计算不低于5 000,记录色谱图与标准谱图一致,见图1~图3。

图1 麦角甾醇HPLC图Fig.1 Chromatogram of ergosterol

图2 子实体样品麦角甾醇HPLC图Fig.2 Chromatogram of ergosterol in fruiting body

图3 原质团样品麦角甾醇HPLC图Fig.3 Chromatogram of ergosterol in plasmodia
2.1.2 麦角甾醇对照品溶液的制备
取麦角甾醇对照品适量,精密称定,置25 mL量瓶中,加甲醇制成每1毫升约含0.05 mg的溶液。
2.1.3 麦角甾醇供试品溶液的制备
分别称取美发网菌样品约0.5 g(子实体和原质团),精密称定,置具塞锥形瓶中,各加入20 mL甲醇,超声处理30 min,滤过,回收溶剂,残渣加1 mL甲醇使其溶解,作为供试品溶液。
2.2 豆甾醇含量测定试验方法
2.2.1 色谱条件
以十八烷基硅烷键合硅胶为填充剂(汉邦ODS C18色谱柱,4.6 mm×250 mm,5 μm),以乙腈-水(96:4) 为流动相,检测波长为204 nm,流速为0.8 mL·min-1,柱温为 35℃,进样量为 10 μL[14-15]。理论塔板数按豆甾醇峰计算不低于3 000,记录色谱图与标准谱图一致,见图4~图6。
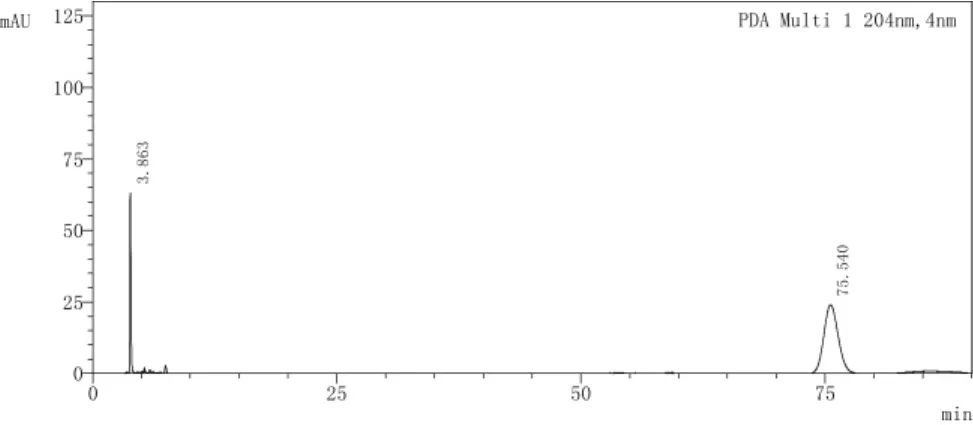
图4 豆甾醇HPLC图Fig.4 Chromatogram of stigmasterol

图5 子实体样品豆甾醇HPLC图Fig.5 Chromatogram of stigmasterol in fruiting body

图6 原质团样品豆甾醇HPLC图Fig.6 Chromatogram of stigmasterol in plasmodia
2.2.2 豆甾醇对照品溶液的制备
精密称取豆甾醇对照品适量,加入无水乙醇制成每1毫升约含0.2 mg的溶液[16]。
2.2.3 豆甾醇供试品溶液的制备
分别取美发网菌子实体和原质团样品约0.5 g,精密称定,各加入氯仿20 mL,超声处理20 min,滤过,回收溶剂,残渣加甲醇1 mL使其溶解,作为供试品溶液[15-16]。
3 结果
3.1 麦角甾醇含量测定结果
3.1.1 方法学考察
(1) 线性关系考察
分别取麦角甾醇对照品溶液 4 μL、8 μL、10 μL、12 μL、14 μL、16 μL,注入高效液相色谱仪器,按照按照“2.1.1”项下条件测定吸收峰面积。以麦角甾醇质量(μg) 为横坐标(x),吸收峰面积值(A)为纵坐标(y),得线性回归方程为:y=1E+06x-9625.3,r=0.9999,表明麦角甾醇进样量在0.2004 μg~0.8016 μg 范围内与吸收峰面积呈良好线性关系。
(2) 精密度考察
取麦角甾醇对照品溶液,按照“2.1.1”项下条件测定,每次进样10 μL,连续6次。结果麦角甾醇吸收峰面积值分别是660 783、660 091、660 647、660 579、660 433、661 070。RSD值为0.05%,表明仪器精密度良好。
(3) 重复性考察
精密称取同一批子实体和原质团各6份,按照“2.1.3”项下方法制备供试品溶液,按照“2.1.1”项下条件进行测定,重复6次。结果子实体吸收峰面积值分别是643 582、636 670、644 524、649 923、647 534、648 492,RSD值为0.68%;原质团吸收峰面积值分别是636854、633 220、633 452、632 125、632 754、633 304,RSD值为0.24%。各样品峰面积测量值的相对标准偏差均不大于3%,表明此方法重复性良好。
(4) 稳定性考察
取子实体和原质团供试品溶液,分别于0、2 h、4 h、8 h、16 h、24 h注入高效液相色谱仪,按照“2.1.1”项下条件测定。子实体吸收峰面积值分别是648 492、649 651、650 147、644 144、636 539、635 310,RSD值为0.94%;原质团吸收峰面积值分别是 635 010、634 864、638 027、636 961、633 859、636 184,RSD值为0.22%。各样品峰面积测量值的相对标准偏差均不大于3%,表明样品在24 h内稳定。
(5) 回收率考察
分别取已经测知含量的子实体约0.2 g(约含有麦角甾醇0.17 mg)和原质团约0.2 g(约含有麦角甾醇0.25 mg),精密称定,各加入质量浓度为0.05 mg·mL-1的麦角甾醇对照品溶液4 mL,挥干溶剂,残渣按照“2.1.3”项下方法制备供试品溶液,计算麦角甾醇的加样回收率。结果见表1、表2。
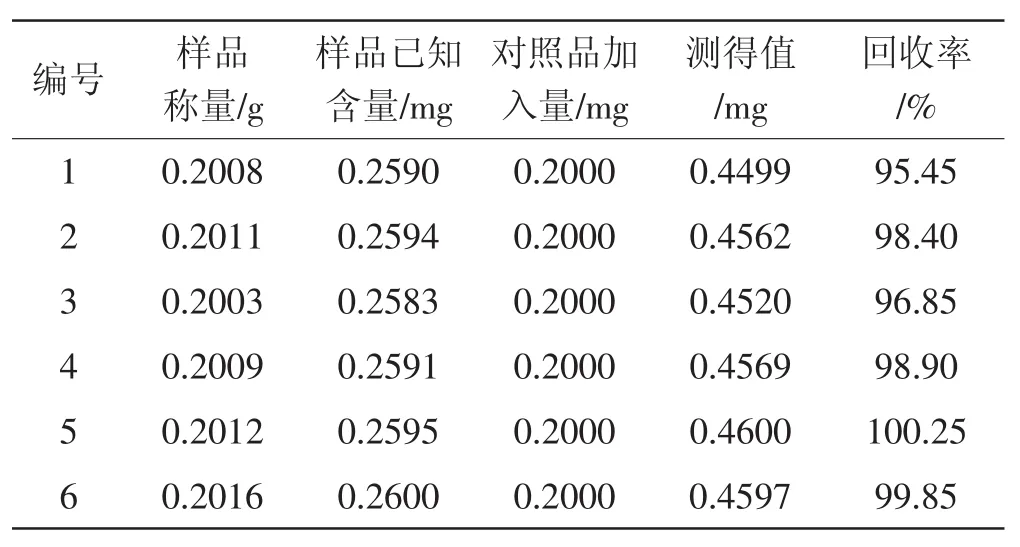
表2 原质团中麦角甾醇回收率试验(n=6)Tab.2 Recoveries of ergosterol in plasmodia(n=6)
从表1、表2可以看出,子实体中麦角甾醇平均回收率为99.51%,RSD值为3.71%。原质团中麦角甾醇平均回收率为98.28%,RSD值为1.86%。待测样品的回收率和相对标准偏差均在限度范围内,表明该方法准确度较高。
3.1.2 样品含量测定
分别精密称取3批子实体和原质团样品,制备供试品溶液,色谱条件不变,测定吸收峰面积,计算样品中麦角甾醇含量。结果见表3。

表3 子实体和原质团中麦角甾醇含量(n=3)Tab.3 Assay results of ergosterol in fruiting body and plasmodia(n=3)
从表3可以看出,子实体中麦角甾醇平均含量为0.8837 mg·g-1,RSD值为0.73%。原质团中麦角甾醇平均含量为1.2959 mg·g-1,RSD值为0.37%。不同待测物相对标准偏差均不大于3%,表明不同样品中麦角甾醇的含量较稳定且原质团中较高。
3.2 豆甾醇含量测定结果
3.2.1 方法学考察
(1) 线性关系考察
分别取豆甾醇对照品溶液 2 μL、6 μL、10 μL、14 μL、16 μL,注入高效液相色谱仪,按照“2.2.1”项下条件进行测定,以测得吸收峰面积对应豆甾醇质量作图,得回归方程为y=4E+06x-37149,r=0.9995,结果表明豆甾醇进样量在0.0408 μg~0.3208 μg范围内与吸收峰面积呈良好线性关系。
(2) 精密度考察
取豆甾醇对照品溶液,按照“2.2.1”项下条件测定,每次进样10 μL,连续6次。结果豆甾醇吸收峰面积值分别是635 010、634 864、638 027、636 961、633 859、636 184。RSD值为0.08%,表明仪器精密度良好。
(3) 重复性试验
精密称取同一批子实体和原质团各6份,按照“2.2.3”项下方法制备供试品溶液,按照“2.2.1”项下条件进行测定,重复6次。结果表明子实体吸收峰面积值分别是675 629、666 810、662 037、678 064、664 538、657 862,RSD 值为1.17%;原质团吸收峰面积值分别是614 622、624 822、612 558、619 796、611 950、601 466,RSD值为0.29%。各样品峰面积测量值的相对标准偏差均不大于3%,结果表明方法重复性良好。
(4) 稳定性考察
取子实体和原质团供试品溶液,分别于0、2 h、4 h、8 h、16 h、24 h注入高效液相色谱仪,按照“2.2.1”项下条件测定。子实体吸收峰面积值分别是658 739、668 954、675 094、679 218、659 317、655 492,RSD值为1.46%;原质团吸收峰面积值分别为 675 900、669 994、667 954、664 530、678 230、685 253,RSD值为1.13%。各样品峰面积测量值的相对标准偏差均不大于3%,结果表明样品在24 h稳定。
(5) 回收率考察
分别取6份已知含量的子实体约0.5 g(约含有豆甾醇0.0295 mg)和原质团约0.5 g(约含有豆甾醇0.0375 mg),精密称定,各加入质量浓度为0.0375 mg·mL-1的豆甾醇对照品溶液1 mL,挥干溶剂,按照“2.2.3”项下方法操作,制备供试品溶液,残渣用无水乙醇定容,依法测定,计算豆甾醇加样回收率。结果见表4、表5。

表4 子实体中豆甾醇回收率实验(n=6)Tab.4 Recoveries of stigmasterol in fruiting body(n=6)

表5 原质团中豆甾醇回收率实验(n=6)Tab.5 Recoveries of stigmasterol in plasmodia(n=6)
从表4、表5可以看出,子实体中豆甾醇平均回收率为96.84%,RSD值为2.20%。原质团中豆甾醇平均回收率为96%,RSD值为2.97%。待测样品的回收率和相对标准偏差均在可接受范围内,表明该色谱方法测得值与参考值较接近。
3.2.2 样品含量测定
分别精密称取3批子实体和原质团样品,按照“2.2.3”项下方法制备供试品溶液,按照“2.2.1”项下条件测定样品中豆甾醇含量。结果见表6。

表6 子实体和原质团中豆甾醇含量(n=3)Tab.6 Assay results of ergosterol in fruiting body and plasmodia(n=3)
从表6可以看出,子实体中豆甾醇平均含量为0.059 mg·g-1,RSD值为1.11%。原质团中豆甾醇平均含量为0.075 mg·g-1,RSD值为1.14%。不同待测物相对标准偏差均不大于4%,表明不同样品中豆甾醇的含量较稳定且原质团中含量略高。
4 讨论
采用高效液相色谱法对美发网菌麦角甾醇和豆甾醇的含量进行测定,结果显示2种成分在子实体和原质团中的色谱条件一致,方法稳定可靠。从整体结果可以得出如下结论:豆甾醇的提取溶剂分别为氯仿和氯仿-甲醇(1∶1),2种溶剂相比较,氯仿的提取效果最好;本研究是首次采用高效液相色谱法对美发网菌甾醇类成分进行分析,子实体和原质团中麦角甾醇和豆甾醇的成分比较稳定,提取方法和色谱条件重现性好、选择性高,可以作为美发网菌甾醇类成分的质量标准;比较子实体与原质团中麦角甾醇和豆甾醇的含量,原质团中2种成分较高。推测在美发网菌生长发育过程中,原质团可能是分裂旺盛的营养体且麦角甾醇和豆甾醇均为结构物质;原质团中麦角甾醇和豆甾醇与子实体成分相同,含量略高。因此利用发酵产物可以代替野生资源,填补国内黏菌生物学的研究空白,其丰富的医药价值值得深入探索。
[1]朱鹤,王琦,李玉.两种暗孢黏菌化学成分的初步研究[C]//中国菌物学会第五届会员代表大会暨2011年学术年会论文摘要集.广州:中国菌物学会,2011:2.
[2]朱鹤,王琦,李玉.两种黏菌中甾醇类化合物的提取分离[C]//2012年中国菌物学会学术年会会议摘要.北京:中国菌物学会,2012:1.
[3]曹龙辉,李晓珺,赵文红,等.麦角甾醇的研究进展[J].中国酿造,2014,33(4):9-12.
[4]Ingrid C,Bert S,Wolfgang S.The Chemistry of the plasmodial pigments of the slime mold Fuligo septica(Myxomycetes)[J].Angewandte Chemie International Edition,2010,26(6):586-587.
[5]高云佳,赵庆春,闵鹏,等.脱皮马勃化学成分的研究[J].中国药物化学杂志,2010,20(1):47-49.
[6]李小丽.马勃化学成分的分离、鉴别及对组织蛋白酶L抑制作用研究[D].长沙:湘潭大学,2011.
[7]Li A,Liu Y,Wang L,et al.Ergosterol alleviates kidney injury in streptozotocin-induced diabetic mice[J].Evidence-based Complementary and Alternative Medicine,2015,2015(2):1-8.
[8]Tabata T,Tanaka M,Iio T.Hypochole-sterolemic activity of phytosterol.II[J].Yakugaku Zasshi Journal of the Pharmaceutical Society of Japan,1980,100(5):546-552.
[9]陈英红,姜瑞芝,高其品.安络小皮伞醇提物中镇痛成分麦角甾醇和肉桂酸的含量测定[J].中成药,2005,27(5):583-585.
[10]Ramosligonio A,Lópezmonteon A,Trigos A.Trypanocidal activity of ergosterol peroxide from Pleurotus ostreatus[J].Phytotherapy Research,2012,26(6):938-943.
[11]Cheng J,Duan DD,Wang YN,et al.Acaricidal activity of stigmasterolfrom Inula britannica againstTetranychus innabarinus[J].Journal of Theoretical Biology,2012,4(1):52-72.
[12]Duan DD,Bu CY,Cheng J,et al.Effects of stigmasterol to activities of several enzymes of Tetranychus cinnabarinus[M].Springer Berlin Heidelberg:Information Technology and A-gricultural Engineering,2012:721-729.
[13]Dong H,Wang X,Huang J,et al.Effects of postharvest stigmasterol treatment on quality related parameters and antioxidant enzymes of green asparagus(Asparagus officinalis L.)[J].Food Addit Contam Part A Chem Anal Control Expo Risk Assess,2016,33(12):1785-1792.
[14]张斌,郁听,栗磊,等.植物甾醇的研究进展[J].食品与发酵工业,2015,41(1):190-195.
[15]魏志奇,陈幸,李彬,等.高效液相色谱法测定川木通中豆甾醇的含量[J].时珍国医国药,2009,20(3):574-575.
[16]梁春辉,张寒,李雪宁.高效液相色谱法分析青荚叶中豆甾醇的含量[J].应用化工,2015(2):369-370.
Study on Content Determination Method of Two Sterols in Stemonitis splendens Fruiting Body and Plasmodia
LIU Yu-guang,XIE Tian,TANG Lan,ZHONG Hui-ge,WANG Shu-min
(Changchun University of Traditional Chinese Medicine,Changchun 130117,China)
An HPLC method were developed for determination of the content of ergosterol and stigmasterol in Stemonitis splendens Rost fruiting body and plasmodia.Chromatographic conditions of ergosterol content determination were that it was shimadzu inerlsil ODS-SP C18 column(4.6 mm×250 mm,5 μm),the mobile phase was methanol at a flow rate of 1.0 mL·min-1,detection wavelength was 281 nm,the column temperature was 28℃,and the injection volume was 10 μL.Chromatographic conditions of stigmasterol content determination were that it was Hanbang ODS C18 column(4.6 mm×250 mm,5 μm),the mobile phase was acetonitrile-water(96:4)at a flow rate of 0.8 mL·min-1,the detection wavelength was 204 nm,the column temperature was 35℃,and the injection volume was 10 μL.The results showed that ergosterol had good linear relationships in the range of 0.2004 μg~0.8016 μg with the linear equation(y=1E+06x-9625.3,r=0.9999).Stigmasterol had good linear relationships in the range of 0.0408 μg~0.3208 μg with the linear equation(y=4E+06x-37149,r=0.9995).The method of high performance liquid chromatography(HPLC)can be used to determine the content of ergosterol and stigmasterol in fruiting body and plasmodia,which can be used as a quality control method for S.splendens Rost.
Stemonitis splendens Rost;ergosterol;stigmasterol;HPLC
S646.9
A
1003-8310(2017)06-0072-05
10.13629/j.cnki.53-1054.2017.06.016
刘宇光(1993-),女,在读硕士研究生,主要研究方向为中药分析。E-mail:1605860633@qq.com
*通信作者:王淑敏(1965-),女,博士,教授,主要从事中药分析和药用微生物物质基础与药效学研究。E-mail:446097156@qq.com
2017-07-11
