异戊二烯对刺参急性毒性及其抗氧化酶和免疫酶活性的影响
2017-12-27罗耀明李多慧田甲申鹿志创王秀艳王丽梅姜大为
罗耀明,李多慧,田甲申,鹿志创,王秀艳,王丽梅,姜大为
异戊二烯对刺参急性毒性及其抗氧化酶和免疫酶活性的影响
罗耀明1、2,李多慧2,田甲申1,鹿志创1,王秀艳2,王丽梅1,姜大为2
(1.辽宁省海洋水产科学研究院,辽宁省海洋生物资源和生态学重点实验室,辽宁大连116023;2.大连市水产研究所,辽宁 大连116085)
为研究有机污染物对海洋生物的毒性影响,选择海洋环境中典型的异戊二烯作为暴露污染物,研究其对体质量为 (5.23±0.96)g刺参 Apostichopus japonicus的急性毒性及其体腔液中超氧化物歧化酶(SOD)、过氧化氢酶 (CAT)、酸性磷酸酶 (ACP)和碱性磷酸酶 (AKP)活性的影响,并在实验室条件下,采用静水式生物毒性试验法开展了急性毒性试验,以及96 h亚致死效应的毒性试验。结果表明:异戊二烯对刺参的24、48、72、96 h半致死质量浓度分别为83.00、78.09、72.93、69.77 mg/L,安全质量浓度为6.98 mg/L;亚致死试验中,CAT活性受到的影响最大,表现为受到抑制作用,存在良好的剂量-效应和时间-效应正相关性;96 h时,中、低浓度异戊二烯对SOD活性具有显著的诱导作用 (p<0.05),而高浓度异戊二烯对SOD活性具有极显著的抑制作用 (p<0.01);ACP和AKP活性受到的影响较小,但48 h时两种酶均受到极显著的诱导作用 (p<0.01),96 h时AKP活性受到显著的诱导作用 (p<0.05);随着异戊二烯质量浓度的增加和时间的延长,刺参体腔液中4种酶活性受到不同程度的影响,因此,异戊二烯胁迫对刺参体内产生自由基导致氧化胁迫效应,以及对消化、能量代谢系统的影响可能是其重要的致毒原因,刺参体腔液中4种酶的变化体现了异戊二烯的致毒机制。本研究结果可为异戊二烯对海洋生物的生态毒理学方面的研究提供参考依据。
异戊二烯;刺参;亚致死效应;超氧化物歧化酶;过氧化氢酶;酸性磷酸酶;碱性磷酸酶
异戊二烯又名2-甲基-1,3-丁二烯 (2-methyl-1, 3-butadiene, isoprene), 在常温下是一种无色、易挥发的液体,具有刺激性气味[1]。据研究资料显示,秋季黄海和渤海表层海水中异戊二烯相较于大气中呈现过饱和状态,其水平分布呈北高南低的特征[2-3]。海水中的异戊二烯来源于多种途径,包括浮游植物光合成、细菌代谢和有机物光化学降解等[4-6],特别是船载化学品的泄漏、溢油事故和沿海石油化工企业的废水排放,直接污染和破坏海洋生态系统,危害海洋生物,且在短期内无法修复。1990年至今,中国海域发生的溢油、泄漏污染事故共计60余起[7],2010年大连 “7.16溢油” 事故[8]和2011年蓬莱 “19-3溢油” 事故[9]中,油污对海洋生物产生了毒害,如棘皮动物、浮游生物、贝类、甲壳类、鱼类、海鸟、红树林和大型哺乳动物等,并最终通过食物链影响到人类健康[10-11]。异戊二烯是常见的石油化工产品,作为危害性较强的有机污染物之一,在动物组织中发生反应后形成的环氧化合物可诱变肿瘤[12]。
刺参Apostichopus japonicus属于棘皮动物,其免疫系统属于非特异性免疫系统。刺参的真体腔中含有大量半透明的体腔液,在体腔液中含有体腔细胞,在机体受到外界刺激时体腔细胞引起免疫应答,并通过细胞免疫和体液免疫协同作用,将外源物分解成无害物质或直接排出体外[13-14]。超氧化物歧化酶 (Superoxide dismutase,SOD)主要生物功能是催化超氧阴离子自由基歧化为过氧化氢和氧[15]。过氧化氢酶 (Catalase,CAT)是在生物演化过程中建立起来的生物防御系统的关键酶之一,其生物学功能是催化细胞内过氧化氢分解,防止过氧化[16]。抗氧化防御酶通常是机体抵御外源污染物毒性作用的第一道屏障,对机体的氧化和抗氧化平衡起着重要的作用[17]。酸性磷酸酶 (Acid phosphatase,ACP)和碱性磷酸酶 (Alkaline phosphatase,AKP)广泛存在于动物各组织中,是维持机体生长代谢和机体健康,保持体内环境稳定所必需的酶,当免疫水平降低或提高时,它们会产生相应的变化[18-20],因此,本研究中探讨了异戊二烯对刺参体内抗氧化酶和免疫酶活性的影响。
目前,国内外有关有机污染物[21-25]对海洋或水生生物毒理学方面的报道较多,但涉及异戊二烯对海洋生物毒理学方面的报道较少[26-27],而国外有关异戊二烯的毒理机制以对啮齿类动物的研究居多[28-29]。罗耀明等[26]曾开展过异戊二烯对刺参幼参 (1.30 g±0.62 g)的急性毒性试验,结果表明,24、48、72、96 h时,半致死浓度分别为70.40、68.28、67.25、66.55 mg/L, 安全浓度为 6.66 mg/L。由于本试验刺参的规格与其不同,因此,继续开展异戊二烯对刺参的急性毒性试验具有重要意义。本试验中,同时还进一步研究了异戊二烯对刺参体腔液中超氧化物歧化酶、过氧化氢酶、酸性磷酸酶和碱性磷酸酶活性的影响,以期为异戊二烯对海洋生物的毒性影响研究提供理论参考依据。
1 材料与方法
1.1 材料
试验用刺参购自大连金州区杏树屯某育苗场,体质量为 (5.23±0.96)g,试验前先置于实验室暂养1周,每天换水1次,隔1天投饵1次。暂养期间,刺参摄食正常,无病害,无死亡。在试验开始前一天停止投饵,并选取健康刺参用于试验。试验用水经沉淀、沙滤,温度为13~15℃,溶解氧为6.87~7.79 mg/L,盐度为29.58~30.91,pH为7.5~8.3。
试验用主要仪器:多功能酶标仪 (瑞士Tecan)和CTl5RE型台式微量高速离心机 (日本Hitachi)。
试验用主要药品与试剂:异戊二烯和二甲基亚砜,均为化学纯,购自中国国药有限公司;超氧化物歧化酶、过氧化氢酶、碱性磷酸酶、酸性磷酸酶和总蛋白等试剂盒,均购自南京建成生物工程研究所。
1.2 方法
1.2.1 急性毒性试验 参照 《水生生物检测手册》中静水式毒性试验法[30],并根据预试验结果,按等差级数设定异戊二烯质量浓度为64.00、68.00、 72.00、 76.00、 80.00、 84.00 mg/L, 以自然海水为空白对照组,以体积分数0.1%的二甲基亚砜为助溶剂对照组。所有试验组均设3个平行,每个10 L玻璃缸中放入20头刺参,随时观察,取出死亡刺参,并记录各组刺参分别在24、48、72、96 h的死亡量。判断刺参死亡的标准是对轻微刺激无反应,且在正常海水中饲养数日无存活迹象[26]。
取各试验组3个平行结果的平均值计算死亡率, 按公式[31]P= (p′-C) /(1-C) 进行校正。其中:p′为试验组鱼死亡百分数;C为对照组鱼死亡百分数;P为经校正后的试验组鱼死亡百分数。参照死亡百分数与概率单位换算表,将校正后的死亡百分数换算成死亡概率单位,建立浓度对数与死亡概率单位的直线回归方程,并计算出异戊二烯对刺参24、48、72、96 h的半致死质量浓度及95%置信区间[32],再用96 h半致死质量浓度×0.1计算出安全质量浓度。
1.2.2 亚致死毒性试验 参照姜北[24]对刺参亚致死效应的试验方法,根据急性毒性试验的96 h半致死浓度设定亚致死效应试验,按等比级数设置异戊二烯质量浓度分别为0.56(低浓度)、2.79(中浓度)、13.95(高浓度)mg/L,以自然海水为空白对照组,每个试验组设3个平行。每个10 L玻璃缸中放入30头刺参,试验期间不充气 (经测量溶氧量变化不明显)、不投饵,因异戊二烯具有挥发性,为避免异戊二烯浓度降低影响试验结果,在试验期间每隔24 h换水1次,保持异戊二烯浓度不变。试验开始后第24、48、72、96 h进行取样,每次从每缸随机选取5头刺参作为一个样本。取样后用0.9%的生理盐水冲洗刺参体表,用灭菌后的滤纸吸干体表水分,在灭菌的冰培养皿上迅速解剖刺参,同时收集体腔液装入离心管中,在4℃下以3000 r/min离心20 min后,收集上清液,在冰盘上迅速分装于1.5 mL冻存管中,最后放入冰箱(-80℃)中冷冻保存待用。
刺参体腔液中超氧化物歧化酶 (SOD)、过氧化氢酶 (CAT)、酸性磷酸酶 (ACP)、碱性磷酸酶 (AKP)和总蛋白等含量的测定方法参照测试盒说明书。
SOD、CAT、ACP、AKP酶活性结果用比活力来表示,活力单位分别为U/mg、U/mg、U/g和金氏单位/g,即酶活水平/总蛋白含量。
1.3 数据处理
试验数据用SPSS 20.0软件进行单因素方差分析,用LSD和Duncan法进行多重比较,显著性水平设为0.05,极显著性水平设为0.01。
2 结果与分析

图1 不同浓度的异戊二烯对刺参的致死率Fig.1 Mortality of sea cucumber Apostichopus japonicus exposed to different concentrations of isoprene
2.1 异戊二烯对刺参的急性毒性
试验中空白和助溶剂对照组均未出现刺参中毒和死亡现象。不同浓度的异戊二烯对刺参的致死率见图1,刺参中毒特征表现为体表肿胀、口器张开、轻微刺激无反应,出现麻痹状态,随着毒性作用时间的延长,口器中吐出乳白色絮状物,直至死亡。随着异戊二烯质量浓度的升高,刺参死亡率不断增加,死亡特征更加明显,存在良好的剂量-效应正相关性。
从表1可见,异戊二烯对刺参的24、48、72、96 h半致死浓度分别为 83.00、78.09、72.93、69.77 mg/L,异戊二烯对刺参的安全浓度为6.98 mg/L。异戊二烯的半致死浓度随试验时间的延长而降低,表明其致毒能力随试验时间的延长而明显增强,存在较为明显的蓄积急性致毒。

表1 异戊二烯对刺参的急性毒性作用Tab.1 Acute toxicity of isoprene to sea cucumber Apostichopus japonicus
2.2 异戊二烯对刺参超氧化物歧化酶活性的影响
不同时间内不同浓度的异戊二烯对刺参体腔液中SOD活性的影响见图2。24 h时,异戊二烯对SOD活性有诱导作用,随着浓度的升高对其活性影响增大;48 h时,低、高浓度异戊二烯对其活性有极显著诱导作用 (P<0.01),中浓度异戊二烯有极显著抑制作用 (P<0.01);72 h时,各浓度组异戊二烯对其活性影响不显著 (P>0.05);96 h时,低、中浓度异戊二烯对其活性有显著诱导作用(P<0.05),高浓度异戊二烯有极显著抑制作用(P<0.01)。这表明,刺参体内的SOD活性对异戊二烯的刺激较为敏感,机体内的抗氧化系统受到胁迫后产生了响应并对机体形成保护,随着毒性作用时间的延长,高浓度异戊二烯对刺参体内的SOD活性抑制作用极其显著,可能会损伤SOD活性。
2.3 异戊二烯对刺参过氧化氢酶活性的影响

图2 不同时间内不同浓度的异戊二烯对刺参体腔液中SOD活性的影响Fig.2 Effects of different concentrations of isoprene on the activities of SOD in sea cucumber at different time
不同时间内不同浓度的异戊二烯对刺参体腔液中CAT活性的影响见图3。在24、48、72、96 h时,不同浓度的异戊二烯胁迫后对刺参体内的CAT活性均有抑制作用,且随着浓度的加大对其活性的抑制作用增强,存在良好的剂量-效应正相关性,也存在一定的时间-效应正相关性。这表明,刺参体内的CAT活性对异戊二烯的刺激非常敏感,在机体受到异戊二烯胁迫后,体内的CAT活性受到抑制,随着异戊二烯浓度的加大和毒性作用时间的延长,对其活性的抑制作用越显著,从而对CAT活性的损伤越大。

图3 不同时间内不同浓度的异戊二烯对刺参体腔液中CAT活性的影响Fig.3 Effects of different concentrations of isoprene on the activities of CAT in coelomic fluid of sea cucumber at different time
2.4 异戊二烯对刺参酸性磷酸酶活性的影响
不同时间内不同浓度的异戊二烯对刺参体腔液中ACP活性的影响见图4。在24、72、96 h时,异戊二烯对刺参体内的ACP活性有一定的诱导和抑制作用,但作用不显著 (P>0.05);48 h时,异戊二烯对ACP活性有诱导作用,其中,低、高浓度异戊二烯的诱导作用极显著 (P<0.01)。这表明,刺参体内的ACP活性对异戊二烯的刺激不太敏感,在机体受到异戊二烯胁迫后,ACP活性受到的影响不大。
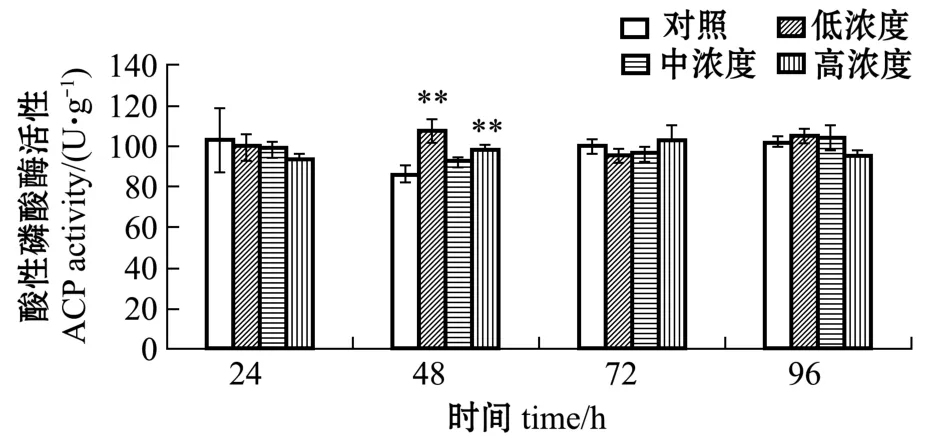
图4 不同时间内不同浓度的异戊二烯对刺参体腔液中ACP活性的影响Fig.4 Effects of different concentrations of isoprene on the activities of ACP in coelomic fluid of sea cucumber at different time
2.5 异戊二烯对刺参碱性磷酸酶活性的影响
不同时间内不同浓度的异戊二烯对刺参体腔液中AKP活性的影响见图5。在24、48、72、96 h时,不同浓度的异戊二烯对刺参体内的AKP活性具有一定的诱导作用,其中48、96 h内出现了显著的诱导作用。这表明,刺参体内的AKP活性对异戊二烯的刺激敏感度一般,在机体受到异戊二烯胁迫后,AKP活性受到一定的诱导,进而产生相应的变化并保护刺参机体免受伤害。
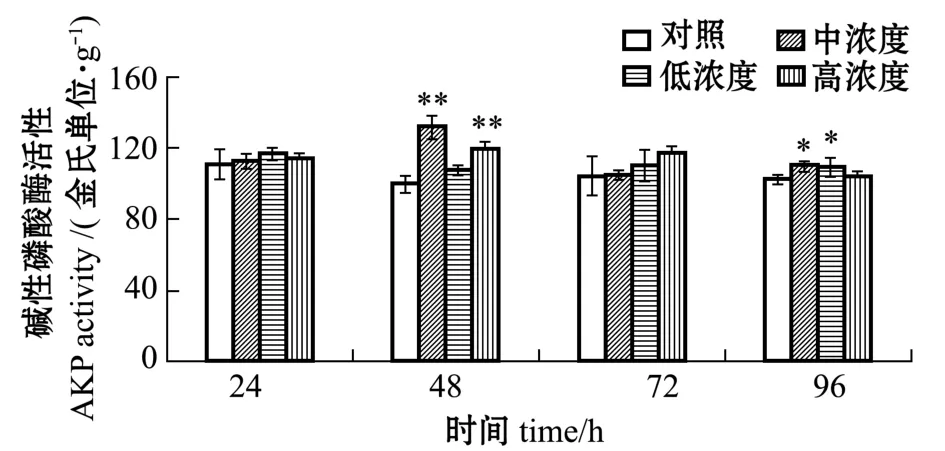
图5 不同时间内不同浓度的异戊二烯对刺参体腔液中AKP活性的影响Fig.5 Effects of different concentrations of isoprene on the activities of AKP in coelomic fluid of sea cucumber at different time
3 讨论
3.1 异戊二烯对刺参的急性毒性
异戊二烯对刺参的急性毒性作用存在良好的剂量-效应正相关性,这与罗耀明等[26]的研究结论相似。研究发现,有机污染物的生物毒性作用主要与受体的结合能力和生物的累积特性有关[33],当有机污染物的正辛醇-水分配系数<5时,水生生物通过富集作用引起中毒,但不会延食物链放大毒性[34]。本研究中异戊二烯的正辛醇-水分配系数为2.42,说明毒性不会通过食物链进行放大。
3.2 异戊二烯对刺参体腔液中抗氧化酶和免疫酶的影响
本试验中,刺参在异戊二烯胁迫下,其体腔液中的4种酶活性受到不同程度的影响,异戊二烯对CAT活性有显著的抑制作用,损伤最大,影响最强,对SOD活性的影响次之,对ACP和AKP活性的影响较小。SOD活性在异戊二烯浓度较低和暴露时间较短时会产生一定的应激反应,机体产生的这种应激反应即为兴奋作用,这与Monferran等[35]的研究结论及姜北[24]的苯胁迫试验结果相似,然而在48 h却出现了中浓度异戊二烯对SOD活性极显著的抑制作用,可能是由于刺参个体间差异性导致的结果。但当机体受到有机污染物胁迫时,体内的抗氧化酶活性会随有机污染物浓度和暴露时间的不同而有所差异[36-38],本试验中,随着毒性时间的延长,在96 h时高浓度异戊二烯对SOD活性有极显著的抑制作用,而中、低浓度异戊二烯对SOD活性有显著的诱导作用,这说明适宜浓度的异戊二烯对刺参造成的损伤可以减轻,同时还能诱导刺参的免疫水平,从而提高机体的免疫防御能力。异戊二烯对刺参体腔液中CAT活性表现为抑制作用,存在良好的剂量-效应和时间-效应正相关性,表明异戊二烯对刺参具有氧化胁迫作用,可能造成机体的氧化损伤,这与苯系物对刺参CAT活性的影响结果较为相似[23]。ACP是吞噬溶酶体的重要组成部分,在细胞吞噬和包囊反应中释放ACP,参与对带磷酸酯基团异物的降解过程[39]。本试验中,异戊二烯对ACP活性的抑制作用不显著,在48 h时出现了极显著诱导作用,表明刺参受到异戊二烯胁迫后提高了自身的非特异性免疫能力。AKP能够促进营养物质的转运和吸收,从而间接地加强了机体的非特异性免疫能力[40]。本试验中,异戊二烯对AKP活性主要表现为诱导作用,这与田丽粉等[25]研究的胜利原油对褐牙鲆幼鱼碱性磷酸酶的影响结论较为相似。总之,异戊二烯对刺参体腔液中ACP活性和AKP活性影响较小,这表明ACP和AKP对3种浓度的异戊二烯在一定时间内具有一定的承受能力,也可能是对异戊二烯胁迫的生理应答反应不明显。但是,本试验中ACP在48 h时有浓度组受到显著的诱导作用,AKP在48 h和96 h时有浓度组受到显著的诱导作用,说明毒性作用时间延长可能会导致机体损伤。
异戊二烯胁迫对刺参体内产生自由基并导致氧化胁迫以及消化代谢等影响,可能是异戊二烯重要的致毒机制,因此,刺参体腔液中 SOD、CAT、ACP、AKP 4种酶活性受到不同程度的影响,可能会造成机体损伤导致中毒,甚至死亡。
[1] 刘庆利,苏家凯,韩振江,等.异戊二烯的生产方法及用途[J].塑料制造,2016(3):60-67.
[2] Matsunaga S,Mochihiro M,Satio T,et al.In situ measurement of isoprene in the marine air and surface seawater from the western North Pacific[J].Atmospheric Environment,2002,36(39-40):6051-6057.
[3] 李建龙,周立敏,张洪海,等.秋季黄海与渤海异戊二烯含量的分布及海-气通量[J].环境科学研究,2015,28(7):1062-1068.
[4] Broadgate W J,Liss P S,Penkett S A.Seasonal emissions of isoprene and other reactive hydrocarbon gases from the ocean[J].Geophysical Research Letters,1997,24(21):2675-2678.
[5] Carpenter L J,Archer S D,Beale R.Ocean-atmosphere trace gas exchange[J].Chemical Society Reviews,2012,41(19):6473 -6506.
[6] Druffel E R M,Williams P M,Bauer J E,et al.Cycling of dissolved and particulate organic matter in the open ocean[J].Journal of Geophysical Research,1992,97(C10):15639-15659.
[7] 刘科伟.船载散装化学品泄漏对海洋环境与生态损害评估研究[D].大连:大连海事大学,2009.
[8] 李艳梅,曾文炉,余强,等.海洋溢油污染的生态与健康危害[J].生态毒理学报,2011,6(4):345-351.
[9] 国家海洋局.2011年中国海洋环境状况公报[R].北京:国家海洋局,2012.
[10] 王志霞,刘敏燕.溢油对海洋生态系统的损害研究进展[J].水道港口,2008,29(5):367-371.
[11] 杨晓霞,周启星,王铁良.海上石油生产水的水生生态毒性[J].环境科学学报,2008,28(3):544-549.
[12] Anderson B,De Peyster A,Shayne G P,et al.Encyclopedia of Toxicology[M].2nd ed.Michigan:Academic Press,2005.
[13] Smith L C,Rast J P,Brockton V,et al.The sea urchin immune system[J].Invertebrate Survival Journal,2006,3(1):25-39.
[14] 孟繁伊.仿刺参(Apostichopus japonicus,Selenka)体腔液中调理素样分子的研究[D].青岛:中国海洋大学,2009.
[15] 朱秀敏.超氧化物歧化酶的生理活性[J].当代医学,2011,17(15):26-27.
[16] 张坤生,田荟琳.过氧化氢酶的功能及研究[J].食品科技,2007,32(1):8-11.
[17] 陈海刚,蔡文贵,秦洁芳,等.三丁基氯化锡对红鳍笛鲷的急性毒性及不同组织生化指标的影响[J].生态毒理学报,2011,6(5):532-538.
[18] 陈瑛,邱子健,隋淑光,等.棘尾虫酸性磷酸酶的定位及诱导表达[J].动物学报,2003,49(2):218-223.
[19] 魏炜,张洪渊,石安静.育珠蚌酸性磷酸酶活力与免疫反应关系的研究[J].水生生物学报,2001,25(4):413-415.
[20] 陈清西,张吉,庄总来,等.锯缘青蟹碱性磷酸酶分离纯化及部分理化性质研究[J].海洋与湖沼,1998,29(4):362-367.
[21] Echeveste P, Galbán-Malagón C, Dachs J,et al.Toxicity of natural mixtures of organic pollutants in temperate and polar marine phytoplankton[J].Science of the Total Environment,2016,571:34-41.
[22] Harmon S M.The toxicity of persistent organic pollutants to aquatic organisms[J].Comprehensive Analytical Chemistry,2015,67:587-613.
[23] 高士博,王摆,董颖,等.苯系物对仿刺参catalase基因表达及酶活性的影响[J].生态毒理学报,2015,10(2):297-305.
[24] 姜北.苯系物(BTEX)对仿刺参(Apostichopus japonicus)毒理学的初步研究[D].大连:大连理工大学,2013.
[25] 田丽粉,任仲,崔毅,等.胜利原油对褐牙鲆仔稚鱼的急性毒性和幼鱼碱性磷酸酶的影响[J].海洋水产研究,2008,29(6):95-100.
[26] 罗耀明,许伟定,李多慧,等.环氧丙烷、丙烯酸和异戊二烯对仿刺参幼参的急性毒性[J].水产科学,2015,34(7):444-447.
[27] 蔡丽珊,罗耀明,李多慧,等.四种化学品对凡纳滨对虾幼虾和褐牙鲆幼鱼的急性毒性[J].水产科学,2014,33(12):735-740.
[28] Melnick R L,Sills R C.Comparative carcinogenicity of 1,3-butadiene,isoprene,and chloroprene in rats and mice[J].Chemico-Biological Interactions,2001,135-136:27-42.
[29] Anderson D.Genetic and reproductive toxicity of butadiene and isoprene[J].Chemico-Biological Interactions,2001,135-136:65-80.
[30] 国家环境保护局.水生生物监测手册[M].南京:东南大学出版社,1993.
[31] 周永欣,章宗涉.水生生物毒性试验方法[M].北京:农业出版社,1989:34-39.
[32] 熊治廷.环境生物学[M].武汉:武汉大学出版社,2000:134-137.
[33] Lu G H,Yuan X,Zhao Y H.QSAR study on the toxicity of substituted benzenes to the alga(Scenedesmus obliquus)[J].Chemosphere,2001,44(3):437-440.
[34] Binelli A,Provini A.The PCB pollution of Lake Iseo(N.Italy)and the role of biomagnification in the pelagic food web[J].Chemosphere,2003,53(2):143-151.
[35] Monferran M V,Wunderlin D A,Nimptsch J,et al.Biotransformation and antioxidant response in Ceratophyllum demersum experimentally exposed to 1,2-and 1,4-dichlorobenzene[J].Chemosphere,2007,68(11):2073-2079.
[36] Chater S,Douki T,Garrel C,et al.Cadmium-induced oxidative stress and DNA damage in kidney of pregnant female rats[J].Comptes Rendus Biologies,2008,331(6):426-432.
[37] Sun F H,Zhou Q X.Oxidative stress biomarkers of the polychaete Nereis diversicolor exposed to cadmium and petroleum hydrocarbons[J].Ecotoxicology and Environmental Safety,2008,70(1):106-114.
[38] Jones H B,Garside D A,Liu R,et al.The influence of phthalate esters on leydig cell structure and function in vitro and in vivo[J].Experimental and Molecular Pathology,2005,58(3):179-193.
[39] Cheng T C.The role of lysosimal hydrolases in molluscan celluar response to immunologic challenge[M]//Bulla L A Jr,Cheng T C.Invertebrate Models for Biomedical Research.New York:Springer,1978,4:59-71.
[40] Zhang R Q,Chen Q X,Zheng W Z.Inhibition of kinetics of green crab(Scylla serrata)alkaline phosphatase activity by dithiothreitol or 2-mercptoethanol[J].The International Journal of Biochemistry & Cell Biology,2000,32(8):865-872.
Acute toxicity and effects of isoprene on activities of antioxidant and immune enzymes in sea cucumber Apostichopus japonicus
LUO Yao-ming1,2, LI Duo-hui2, TIAN Jia-shen1, LU Zhi-chuang1,WANG Xiu-yan2, WANG Li-mei1, JIANG Da-wei2
(1.Key Laboratory of Marine Biological Resources and Ecology, Liaoning Ocean and Fisheries Science Research Institute, Dalian 116023, China;2.Dalian Fisheries Research Institute, Dalian 116085, China)
Acute toxicity of isoprene, a common toxic pollutant in marine environment, to sea cucumber Apostichopus japonicas with body weight of(5.23±0.96)g was studied in a laboratory by static bioassay and effects of isoprene on activities of superoxide dismutase(SOD),catalase(CAT),acid phosphatase(ACP)and alkaline phosphatase(AKP)were investigated in coelomic fluid of sea cucumber.The results showed that the median lethal concentration(LC50)of isoprene to sea cucumber was 83.00 mg/L in 24 h, 78.09 mg/L in 48 h, 72.93 mg/L in 72 h, and 69.77 mg/L in 96 h, with safe concentration of 6.98 mg/L.In sublethal effect test, the activities of CAT were the most sensitive and inhibited in isoprene treatment groups, with good time-dose dependent effect, and the activities of SOD were induced in the medium and low concentration of isoprene treatment groups and inhibited very significantly in the high concentration treatment groups at 96 h(p<0.01).The activities of ACP and AKP were less sensitive to isoprene, and significantly induced at 48 h(p<0.01), and the activities of AKP were significantly induced at 96 h(p<0.05).The activities of four enzymes in the coelomic fluid of sea cucumber were affected by isoprene with the increase in isoprene concentrations and time prolonged,indicating that the toxic mechanisms of isoprene is involved in generated free radicals,oxidative stress and the effects on digestive and metabolic systems in sea cucumber.The findings may provide the reference on ecological toxicology of isoprene to marine organisms.
isoprene; Apostichopus japonicus; sublethal effect; superoxide dismutase(SOD); catalase(CAT);acid phosphatase(ACP);alkaline phosphatase(AKP)
Q954.4
A
10.16535/j.cnki.dlhyxb.2017.06.008
2095-1388(2017)06-0682-06
2017-03-28
辽宁省海洋与渔业厅科研项目 (201417)
罗耀明 (1982—),男,工程师。E-mail:lym1982@126.com
王丽梅 (1964—),女,研究员。E-mail:meizi4678@sina.com
