重金属镉对铜藻生长及其生物活性成分积累的影响
2017-12-27吕芳詹冬梅郭文吴海一丁刚栾青
吕芳, 詹冬梅, 郭文, 吴海一, 丁刚, 栾青
重金属镉对铜藻生长及其生物活性成分积累的影响
吕芳1、2, 詹冬梅1、2, 郭文1, 吴海一1、2, 丁刚1、2, 栾青3
(1.山东省海洋生物研究院,山东青岛266104;2.青岛市大型海藻工程技术研究中心,山东青岛266104;3.烟台大学 生命科学学院,山东烟台264005)
为研究水体重金属污染对经济海藻的生长和品质造成的严重影响,以经济褐藻铜藻Sargassum horneri为研究对象,在温度为15℃的条件下,研究了由CdCl2·2.5H2O配制不同浓度 (0、0.1、0.5、1.0、5.0 mg/L)的重金属镉胁迫对铜藻生长、光合色素、可溶性糖、可溶性蛋白等生理生化指标,以及对生物活性成分 (岩藻黄素、褐藻胶和褐藻多酚)积累的影响。结果表明:对照组藻体的特定生长率 (SGR)在15 d内持续升高,0.1、0.5 mg/L Cd处理组的SGR在试验前10 d内逐渐升高,然后保持稳定至第15天,1.0 mg/L处理组的SGR随着培养时间的延长呈波动变化状态,而5.0 mg/L处理组的SGR呈先升高后降低的趋势;藻体的各项生理生化指标随胁迫时间呈不同的变化趋势,但在试验第15天时,各胁迫组藻体的叶绿素a、类胡萝卜素和可溶性蛋白含量均显著低于对照组 (P<0.05),而可溶性糖含量则显著高于对照组 (P<0.05);铜藻的岩藻黄素和褐藻多酚含量在不同浓度的Cd胁迫下均有极大程度的下降,且Cd胁迫浓度越高,降幅越大,而褐藻胶含量在Cd浓度≤0.5 mg/L胁迫下未有显著变化 (P>0.05),在Cd≥1.0 mg/L时显著下降 (P<0.05)。研究表明,在铜藻产业化开发应用过程中,其养殖海域的重金属污染是需要考虑的重要因素。
铜藻;镉;光合色素;岩藻黄素;褐藻胶;褐藻多酚
近年来,随着人们对海洋生物资源研究的逐渐深入,褐藻中富含的生物活性物质及其生物学功能引起了国内外学者的普遍关注,如岩藻黄素 (fucoxanthin)具有显著的抗氧化[1]、抗肿瘤[2]、减肥[3]和降血糖[4]等活性;褐藻胶 (alginate)具有抗肿瘤、增强免疫、促进生长等生物活性[5-6];褐藻多酚 (phlorotannins)具有抑菌、抗凝血、降血脂、抗肿瘤、抗氧化、抗过敏等多种生物活性[7-8]。因此,这些生物活性物质具有重要的开发和应用前景。
随着海洋污染的日益严重,重金属在海水中的浓度不断增加,不仅对海洋生物造成毒害,且能沿食物链富集和放大[9-10],藻类作为水生生态系统的初级生产者,其生长受到重金属的影响。因此,研究重金属对海洋藻类尤其是经济海藻的胁迫作用,并在此基础上进行养殖环境评价具有十分重要的意义。
铜藻Sargassum horneri隶属于马尾藻属Sargassum,在中国沿海呈不连续分布,是一类具有较高经济价值的经济褐藻,是近海海藻场及海底森林的主要组成部分,不仅可为经济鱼类提供觅食和栖息场所,还可吸附海水中的富营养化物质和重金属等,作为修复近海生态环境的工具海藻,对维持近海生物多样性和生态系统平衡具有重要作用。目前,国内外对于铜藻的研究主要集中在生态学[11-12]、 人工增养殖[13-15]和繁殖生物学[13,16]等方面。笔者在前期研究中对铜藻的营养品质进行了分析和评价,发现其富含岩藻黄素、褐藻胶、褐藻多酚等生物活性物质[17],具有重要的开发和应用前景。随着铜藻资源的开发利用,加上受近岸海域开发和污染的影响,其资源量不断下降,因此,在保护现有野生资源的同时,将具有优良性状的铜藻种质资源进行苗种繁育和海区增殖具有重要的意义,而深入开展养殖环境对铜藻生长及其生物活性成分积累影响的研究也势在必行。
镉是水体中污染最严重的元素之一,生物蓄积性强、毒性持久,对经济藻类的生长和品质产生影响较大。本研究中,以黄海漂浮铜藻为研究对象,探讨了Cd胁迫对铜藻的生长、光合色素、可溶性糖、可溶性蛋白等生理生化指标,以及对生物活性物质 (岩藻黄素、褐藻胶和褐藻多酚等)积累的影响,旨在为铜藻对重金属胁迫的响应研究提供理论依据,进而为保护海洋经济藻类的养殖环境以及开发利用提供参考。
1 材料与方法
1.1 材料
漂浮铜藻采自山东荣成海域的海带养殖筏架上(37°15′N, 122°35′E), 采后用低温箱迅速运回实验室。选择健康藻体,用海水反复清洗去除泥沙及杂质后,置于循环水箱中充气暂养。暂养5 d后用于试验。选取生长健壮、形态较一致、相同部位的藻体用于试验。
1.2 方法
1.2.1 铜藻的培养 试验用培养液为过滤的天然海水 (Cd含量为1.11 μg/L),通过向培养液中添加CdCl2·2.5H2O得到Cd胁迫质量浓度,分别为0.1、0.5、1.0、5.0 mg/L,以不加Cd的过滤海水作为对照组。
试验在容积为1000 mL的三角瓶中进行,每个三角瓶装800 mL培养液。每个试验处理组设置12个重复,每个重复放置 (3.0±0.1)g藻体。试验在恒温光照培养箱内充气进行,水温为15℃,光周期为12 L∶12 D,光照强度为5000 lx,每2 d更换一次培养液。
1.2.2 指标的测定与计算 于试验开始后的第3、5、10、15天取样测定铜藻的特定生长率、光合色素、可溶性糖、可溶性蛋白、岩藻黄素、褐藻胶和褐藻多酚等指标的含量。
(1)特定生长率。取出藻体,用滤纸吸干表面多余水分,称量藻体鲜质量,特定生长率(SGR,%/d)计算公式为
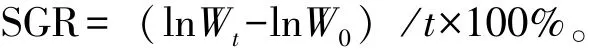
其中:Wt为试验t天时藻体鲜质量 (g);W0为试验开始时藻体鲜质量 (g);t为培养时间 (d)。
(2)光合色素、可溶性糖和可溶性蛋白。参照Wellburn[18]和付贵权等[19]的方法测定光合色素含量。取0.1 g新鲜藻体在液氮中研磨成匀浆状,加入8 mL 80%的丙酮置于4℃黑暗处抽提24 h。4℃下以4000 r/min离心10 min,弃沉淀,上清液用80%丙酮定容至10 mL。以80%丙酮作为空白对照,测定665、652、510、480 nm波长处的吸光值。重复测定3次以上,取其平均值。叶绿素a(Chl-a,mg/g) 和类胡萝卜素 (Car,mg/g) 含量计算公式为
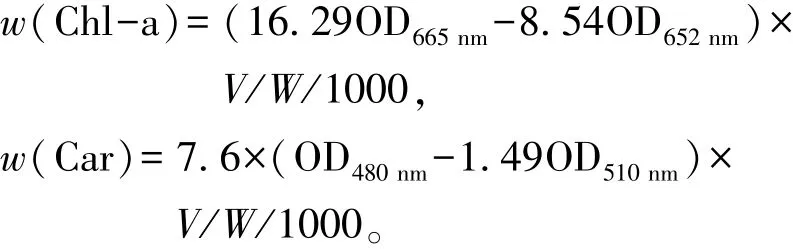
其中:V为浸提丙酮的体积 (mL);W为藻体鲜质量(g)。
采用南京建成植物可溶性糖检测试剂盒蒽酮比色法测定可溶性糖,取0.2 g新鲜藻体在液氮中研磨成匀浆状,加8 mL蒸馏水后于80℃水浴30 min,冷却后离心定容至10 mL,作为待测溶液。
采用南京建成蛋白检测试剂盒考马斯亮蓝法测定可溶性蛋白含量,取1.0 g新鲜藻体在液氮中研磨成匀浆状,加蒸馏水后离心定容到10 mL,作为待测溶液。
(3)岩藻黄素。参照闫相勇等[20]的方法测定岩藻黄素的含量。称取1.0 g铜藻干粉,用20 mL甲醇在60℃条件下避光静置,浸提2次,每次1 h。浸提液于4℃下以4000 r/min离心10 min后,取上清液并转入分液漏斗中,缓慢加入正己烷,充分震荡,放置分层,保留上层溶液;再用正己烷对下层甲醇水溶液进行萃取,多次重复萃取操作至正己烷层几乎无色,合并所得的正己烷溶液,定容。在岩藻黄素特定吸收波长450 nm下测定吸光度值,岩藻黄素含量 (mg/g)计算公式为

(4)褐藻胶。参照尚德荣等[21]研究中所使用的醋酸钙法测定褐藻胶的含量。取1.0 g铜藻干粉,加2.0 mol/L盐酸30 mL过夜,用蒸馏水洗至无氯离子为止。再用0.1 mol/L醋酸钙溶液30 mL浸泡2 h,用蒸馏水清洗5次,将洗下的水溶液用0.1 mol/L氢氧化钠溶液滴定,用酚酞作指示剂。褐藻胶含量 (%)计算公式为

其中:C为NaOH的摩尔浓度 (mol/L);V为滴定消耗的NaOH体积 (mL);0.216 0为1.0 mL 0.1 mol/L氢氧化钠标准溶液相当于0.216 0 g褐藻酸钠;M为海藻样品的质量 (g)。
(5)褐藻多酚。参照严小军等[22]的方法测定褐藻多酚的含量。取0.1 g铜藻干粉,加入3 mL 15%的乙醇浸泡24~48 h后,放入微波炉中加热10 s,微波辐射功率为 700MHz。然后在4000 r/min下离心15 min,定容至3 mL得到褐藻多酚溶液。取0.5 mL褐藻多酚溶液置于15 mL试管中,加水稀释至7 mL,混合均匀,加入1 mL Folin-Denis试剂摇匀,3 min后加入2 mL饱和碳酸钠溶液,充分混合,于710 nm处测定吸光值。用间苯三酚标准液按上述方法作标准曲线,样品在710 nm处测得的吸光值代入标准曲线公式中即可求得褐藻多酚含量。
1.3 数据处理
试验数据以平均值±标准差 (mean±S.D.)表示,采用SPSS 13.0软件进行单因素方差分析,用Duncan法进行组间多重比较,显著性水平设为0.05。
2 结果与分析
2.1 Cd对铜藻生长的影响
从图1可见:对照组藻体的SGR在试验期间持续升高,而各处理组的SGR却呈现差异性,其中0.1、0.5 mg/L Cd处理组的SGR在试验前10 d内逐渐升高,然后保持稳定至第15天 (P>0.05),1.0 mg/L Cd处理组的SGR随培养时间的延长呈波动变化状态,而5.0 mg/L Cd处理组的SGR呈先升高后降低的趋势;试验期间,除第10天时0.1 mg/L Cd处理组外,各处理组的SGR均显著低于对照组 (p<0.05),至试验结束时,0.5、1.0 mg/L Cd处理组的SGR无显著性差异 (P>0.05),但均显著低于0.1 mg/L处理组 (p<0.05),而5.0 mg/L Cd处理组的SGR最低,仅为对照组的30%。
2.2 Cd对铜藻叶绿素a、类胡萝卜素、可溶性糖和可溶性蛋白含量的影响
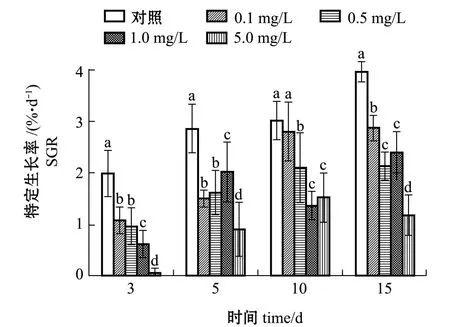
图1 重金属镉对铜藻特定生长率的影响Fig.1 Effect of Cd on specific growth rate of sea weed Sargassum horneri
Cd浓度≤1.0 mg/L的3个处理组,Chl-a含量在试验前10 d内无显著性变化,随后均呈下降趋势,至试验结束时,各处理组Chl-a含量均显著低于对照组 (p<0.05),而5.0 mg/L处理组的Chl-a含量在试验期间均呈显著下降趋势 (图2-A)。
各处理组的胡萝卜素含量随着培养时间的延长呈波动变化状态,至试验结束时均显著低于对照组(p<0.05)(图2-B)。
可溶性糖含量的变化呈现差异性,除0.1 mg/L处理组在第3天和第5天时与对照组无显著性差异外 (P>0.05),其他各组在各时间段均显著高于对照组 (p<0.05)(图2-C)。
可溶性蛋白含量除5.0 mg/L处理组在试验15 d内持续下降外,其他3个处理组则在培养前5 d逐渐上升,随培养时间的延长逐渐下降,至试验结束时各个处理组均显著低于对照组 (p<0.05)(图2-D)。
2.3 Cd对铜藻岩藻黄素、褐藻胶和褐藻多酚含量的影响
在不同浓度Cd处理下,铜藻的岩藻黄素含量明显下降,且Cd处理浓度越高,降幅越大,至试验结束时,各处理组较对照组分别下降了36.1%、38.2%、49.8%、68.8%(图3-A);而铜藻的褐藻胶含量在0.1、0.5 mg/L Cd处理下与对照组无显著性差异 (P>0.05),而在高浓度Cd(1.0、5.0 mg/L)处理下比对照组显著下降 (p<0.05),至试验结束时,高浓度Cd处理组较对照组分别下降了8.8%和9.4%(图3-B);褐藻多酚含量与岩藻黄素变化趋势一致,至实验结束时,各处理组较对照组分别下降了 30.35%、43.5%、45.7%、57.6%(图3-C)。

图2 重金属镉对铜藻叶绿素a、类胡萝卜素、可溶性糖和可溶性蛋白含量的影响Fig.2 Effect of Cd on contents of Chl-a, carotenoid, soluble sugar and soluble protein in brown alga Sargassum horneri
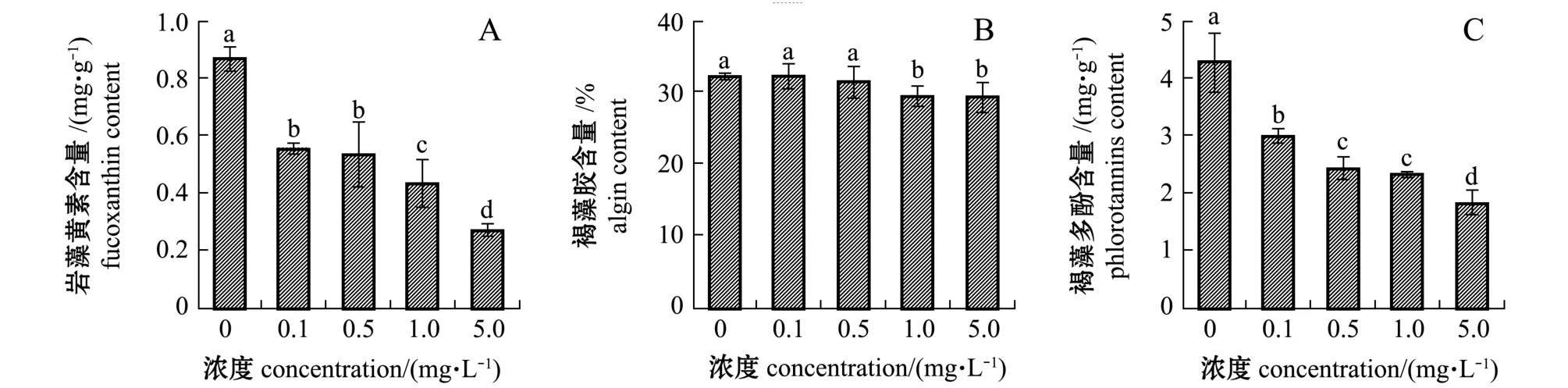
图3 重金属镉对铜藻岩藻黄素、褐藻胶和褐藻多酚含量的影响Fig.3 Effect of Cd on contents of fucoxanthin, alginate and phlorotannins in brown alga Sargassum horneri
3 讨论
3.1 Cd对铜藻生长的影响
藻类的生长受各种环境因子的影响,比如温度、光照、营养盐,以及海水的盐度、pH、污染物等。近年来,中国近海水域持续受到重金属的污染,势必会对藻类的生长造成一定影响。本研究结果表明,在培养前10 d内,铜藻在Cd污染的海水中生长良好,培养15 d时,各试验组铜藻的特定生长率均显著降低,其中Cd浓度为5.0 mg/L试验组藻体的SGR降低幅度最大,藻体尖端出现发白脱落等表观现象,铜藻的生长受到明显抑制。说明铜藻对Cd的毒性具有一定的耐受性,但当超过其耐受范围时,则会受到胁迫损伤。余江等[23]研究表明,龙须菜Gracilaria lemaneiformis在Cd浓度<3.0 mg/L的培养液中生长良好,Cd浓度≥3.0 mg/L时,生长受到明显抑制。Jiang等[24]研究发现,5 μmol/L Cd处理7 d对缘管浒苔Ulva linza的相对生长速率无影响,而使浒苔Ulva prolifera的相对生长速率显著降低,120 μmol/L Cd处理7 d则会导致浒苔死亡,说明大型海藻对重金属Cd的耐受力存在种间差异。
目前,重金属Cd抑制藻类生长的原因尚未有统一的定论,其原因可能是:Cd是海藻生长的非必需元素,藻类能主动排除或隔离Cd来降低其毒性,Cd胁迫引起生长速率降低的原因可能与镉胁迫诱发藻类的适应机制和修复机制而消耗的能量有关[25];Cd与藻体内相应分子结合形成的物质阻断了藻体的一些基本功能,从而抑制了藻类对营养元素的吸收和转运,导致藻体营养的匮乏[26]。
3.2 Cd对铜藻藻体生化特性的影响
本试验结果表明,低质量浓度的Cd(≤1.0 mg/L)在培养前10 d内,对铜藻叶绿素和类胡萝卜素含量的影响不大,这与铜藻对重金属Cd的耐受机制有关。而高浓度Cd(5.0 mg/L)的胁迫作用则明显使叶绿素和类胡萝卜素含量显著降低。叶绿素和类胡萝卜素是大型海藻光合作用的主要色素,其含量的下降将直接导致光合作用及物质合成速率降低,从而对藻类的生理生化代谢产生巨大的毒害作用,也是衡量藻体衰老的重要指标。已有研究表明,叶绿素含量降低可能与其生物合成过程中Mg和Fe的缺乏有关[25],也可能是Cd抑制了一些酶的活性,如原叶绿素酸酯还原酶[27]或者使一些叶绿素酶的活性增强,促进了叶绿素的分解。而类胡萝卜素是辅助色素的一种,是植物体内非酶促抗氧化系统,能够有效地清除活性氧,防止膜脂的过氧化,维持膜结构的稳定性,避免细胞伤害[28]。本研究中,类胡萝卜素含量的减少表明,铜藻在高浓度Cd胁迫下对活性氧的清除能力下降,过量的活性氧会破坏光合作用,造成光合作用效率的降低。
可溶性糖和可溶性蛋白含量是衡量植物代谢水平的重要指标[29]。可溶性糖的积累可以提高植物的渗透势和抗性,相关研究表明,在重金属Cu胁迫8 d时,半叶马尾藻Sargassum hemiphyllum的可溶性糖含量呈明显上升趋势[19]。本研究中,除低浓度Cd(0.1 mg/L)在胁迫初期藻体内可溶性糖的含量保持稳定外,其余各胁迫组可溶性糖含量均高于对照组,说明藻体内积累了大量的碳水化合物,以抵抗Cd胁迫对细胞可能造成的损伤。可溶性蛋白大多数是功能蛋白和参与各种代谢的酶类,本研究中,在低浓度Cd胁迫下,可溶性蛋白的含量升高,在Cd浓度为1.0 mg/L时达到峰值,且随Cd浓度的升高呈显著降低的趋势。有研究报道,低浓度的Cd可诱导可溶性蛋白含量的增加,从而降低Cd的毒性,这可能是藻体对过量Cd毒害的自我保护机制的响应,但高浓度的Cd对蛋白质的合成与代谢起破坏作用[30-31],本研究中也进一步证实了这一结论。
3.3 Cd对铜藻生物活性物质积累的影响
褐藻中的生物活性物质是具有潜在开发应用价值的海洋天然活性产物,目前,国内外对于这方面的研究主要集中在生物活性物质的提取工艺以及生物学功能方面。岩藻黄素是一种特殊的类胡萝卜素,并与叶绿素a和叶绿素c组成捕光复合物,作为捕光复合体,在光合作用的光化学系统中具有重要的作用,天然的岩藻黄素主要来源于褐藻和硅藻。褐藻胶是一种酸性多糖,其生物来源主要有褐藻以及多种机会致病菌 (如假单胞菌属Pseudomonas),其生物功能主要是起到胞外的保护和支撑作用[32]。褐藻多酚是发现于褐藻且仅存于褐藻中的一族天然产物,有强烈的抗氧化活性,在褐藻中扮演着重要的角色,保护藻体免受紫外辐射的伤害、抵御其他食草动物的牧食、防止氧化暴发造成机体伤害等等。褐藻中这3种主要的活性物质为其提供了多种生物学功能,如抗氧化活性、抗肿瘤活性、抗凝血活性、降低血脂活性、降血糖活性等,但对这些活性物质的作用机理以及调控机制尚有待进一步地研究。已有研究表明,活性物质的含量受褐藻的种类、生长地理环境、生长季节、褐藻不同部位等因素的影响。如Mori等[33]在对深海养殖萱藻的研究中发现,其岩藻黄素的含量在幼年时期比较高。萱藻幼生期和成熟期的褐藻胶含量也不同,其细微结构也有显著差别;成熟期萱藻中多聚古罗糖醛酸含量高于幼生期,且随着萱藻的成熟,其含量显著增加[34]。严小军等[35]报道,海黍子和鼠尾藻的褐藻多酚含量存在着季节变动。许亚如[36]研究发现,羊栖菜气囊中的多酚含量高于茎中以及整个羊栖菜藻体粗提物中的多酚含量,但其认为褐藻多酚主要集中分布于藻体的外皮层细胞内,并无组织结构差异,推测原因并非是褐藻多酚在气囊中分布更广,而是由于气囊的比表面积较茎的更大,故褐藻多酚含量更多,加之与有机试剂的接触面积更大,所以提取效率更高。
环境因子对大型海藻的生长有显著的影响,势必会影响其生物活性物质的积累,而目前关于此方面的研究较少,尤其是重金属等环境污染物对藻类生物活性成分积累的影响鲜有报道。本试验中研究了不同浓度重金属Cd对铜藻岩藻黄素、褐藻胶和褐藻多酚等生物活性成分积累的影响,结果表明,Cd胁迫下铜藻岩藻黄素和褐藻多酚的含量均有极大程度的下降,0.1 mg/L Cd胁迫处理15 d即对其产生明显影响,且Cd胁迫浓度越高,活性成分的含量降幅越大。而褐藻胶的含量在0.1、0.5 mg/L Cd胁迫下与对照组无显著性差异,而在高浓度Cd(1.0、5.0 mg/L)胁迫下显著下降,但降幅较小。
综上所述,在经济褐藻铜藻的养殖过程中,养殖海域的重金属污染物不仅影响藻体的生长,而且对其活性物质的积累也产生显著的影响,是铜藻养殖过程中需要考虑的重要因素。关于不同环境因子对经济褐藻生物活性成分影响的研究尚且较少,今后亟需加强此方面的研究,以为其高值化利用和深加工提供理论依据。
致谢:感谢鲁东大学农学院水产养殖专业张彤彤同学在试验工作中的协助!
[1] Yan Xiaojun,Chuda Y,Suzuki M,et al.Fucoxanthin as the major antioxidant in Hijikia fusiformis,a common edible seaweed[J].Bioscience,Biotechnology,and Biochemistry,1999,63(3):605-607.[2] Khan M N A,Lee M C,Kang J Y,et al.Effects of the brown seaweed Undaria pinnatifida on erythematous inflammation assessed using digital photo analysis[J].Phytotherapy Research,2008,22(5):634-639.
[3] Maeda H,Hosokawa M,Sashima T,et al.Anti-obesity and anti-diabetic effects of fucoxanthin on diet-induced obesity conditions in a murine model[J].Molecular Medicine Reports,2009,2(6):897-902.
[4] Hosokawa M,Miyashita T,Nishikawa S,et al.Fucoxanthin regulates adipocytokine mRNA expression in white adipose tissue of diabetic/obese KK-Aymice[J].Archives of Biochemistry and Biophysics,2010,504(1):17-25.
[5] Otterlei M,Ostgaard K,Skjåk-Braek G,et al.Induction of cytokine production from human monocytes stimulated with alginate[J].Journal of Immunotherapy,1991,10(4):286-291.
[6] Fujihara M,Nagumo T.An influence of the structure of alginate on the chemotactic activity of macrophages and the antitumor activity[J].Carbohydrate Research,1993,243(1):211-216.
[7] Liu Lei,Heinrich M,Myers S,et al.Towards a better understanding of medicinal uses of the brown seaweed Sargassum in traditional Chinese medicine:a phytochemical and pharmacological review[J].Journal of Ethnopharmacology,2012,142(3):591-619.
[8] 彭雍博,罗宣,汪秋宽,等.海藻多酚功能性作用机制及其应用研究[J].大连海洋大学学报,2017,32(4):484-492.
[9] 陈勇,温泽民,尹增强,等.辽宁大长山海洋牧场拟建海域表层沉积物重金属潜在生态风险的评价[J].大连海洋大学学报,2015,30(1):89-95.
[10] 张晓举,赵升,冯春晖,等.渤海湾南部海域生物体内的重金属含量与富集因素[J].大连海洋大学学报,2014,29(3):267-271.
[11] Umezaki I.Ecological studies of Sargassum horneri(TURNER)C.AGARDH in Obama Bay,Japan Sea[J].Nippon Suisan Gakkaishi,1984,50(7):1193-1200.
[12] Yoshida G,Murase N,Arai S,et al.Ecotypic differentiation in maturation seasonality among Sargassum horneri(Fucales,Phaeophyta)populations in Hiroshima Bay,Seto Inland Sea,Japan[J].Phycologia,2004,43(6):703-710.
[13] 孙建璋,庄定根,陈万东,等.铜藻Sargassum horneri繁殖生物学及种苗培育研究[J].南方水产,2008,4(2):6-14.
[14] 孙建璋,庄定根,王铁杆,等.南麂列岛铜藻增殖技术的初步研究[J].现代渔业信息,2010,25(1):23-27.
[15] Pang Shaojun,Liu Feng,Shan Tifeng,et al.Cultivation of the brown alga Sargassum horneri:sexual reproduction and seedling production in tank culture under reduced solar irradiance in ambient temperature[J].Journal of Applied Phycology,2009,21(4):413-422.
[16] Uchida T,Arima S,Hirata S,et al.Free-living cells released from thalli of Sargassum horneri(Phaeophyta)in culture[J].Botanica Marina,1996,39(1-6):269-272.
[17] 詹冬梅,王翔宇,辛美丽,等.三种马尾藻的营养组成分析[J].广西科学院学报,2016,32(3):221-225.
[18] Wellburn A R.The spectral determination of chlorophylls a and b,as well as total carotenoids,using various solvents with spectrophotometers of different resolution[J].Journal of Plant Physiology,1994,144(3):307-313.
[19] 付贵权,韩婷婷,巩秀玉,等.重金属Cu2+胁迫对半叶马尾藻生长及生理生化特性的影响[J].南方水产科学,2015,11(4):34-39.
[20] 闫相勇,刘翼翔,吴永沛,等.海带岩藻黄素的提取及纯化工艺研究[J].中国食品学报,2014,14(3):115-121.
[21] 尚德荣,宁劲松,赵艳芳,等.海带中褐藻胶含量测定方法的建立[J].食品科技,2011,36(8):252-254.
[22] 严小军,娄清香,吴真真,等.褐藻多酚连三羟基的测定[J].海洋科学,2000,24(12):3-5.
[23] 余江,杨宇峰,聂湘平.大型海藻龙须菜对重金属镉胁迫的响应[J].四川大学学报:工程科学版,2007,39(3):83-90.
[24] Jiang Heping,Gao Bingbing,Li Wenhui,et al.Physiological and biochemical responses of Ulva prolifera and Ulva linza to cadmium stress[J].The Scientific World Journal, 2013, doi:10.1155/2013/289539.
[25] Xia J R,Li Y J,Lu J,et al.Effects of copper and cadmium on growth,photosynthesis,and pigment content in Gracilaria lemaneiformis[J].Bulletin of Environmental Contamination and Toxicology,2004,73(6):979-986.
[26] Kumar M,Kumari P,Gupta V,et al.Differential responses to cadmium induced oxidative stress in marine macroalga Ulva lactuca(Ulvales,Chlorophyta)[J].Bio Metals,2010,23(2):315-325.
[27] Stobart A K,Griffiths W T,Ameen-Bukhari I,et al.The effect of Cd2+on the biosynthesis of chlorophyll in leaves of barley[J].Physiologia Plantarum,1985,63(3):293-298.
[28] Niyogi K K.Photoprotection Revisited:genetic and molecular approaches[J].Annual Review of Plant Physiology and Plant Molecular Biology,1999,50:333-359.
[29] Xu Rongyan,Niimi Y,Han Dongsheng.Changes in endogenous abscisic acid and soluble sugars levels during dormancy-release in bulbs of Lilium rubellum[J].Scientia Horticulturae,2006,111(1):68-72.
[30] Pettersson O.Differences in cadmium uptake between plant species and cultivars[J].Swedish Journal of Agricultural Research,1977,7:21-24.
[31] Tudoreanu L,Phillips C J C.Modeling cadmium uptake and accumulation in plants[J].Advances in Agronomy,2004,84:121-157.
[32] Kloareg B,Quatrano R S.Structure of the cell walls of marine algae and ecophysiological functions of the matrix polysaccharides[J].Oceanography and Marine Biology,1988,26:259-315.
[33] Mori K,Ooi T,Hiraoka M,et al.Fucoxanthin and its metabolites in edible brown algae cultivated in deep seawater[J].Marine Drugs,2004,2(2):63-72.
[34] Athukorala Y,Lee K W,Kim S K,et al.Anticoagulant activity of marine green and brown algae collected from Jeju Island in Korea[J].Bioresource Technology,2007,98(9):1711-1716.
[35] 严小军,周天成,娄清香,等.褐藻多酚含量的季节变化[J].海洋科学,1996,20(5):39-42.
[36] 许亚如.褐藻多酚的抗氧化活性研究[D].宁波:宁波大学,2014.
Effect of cadmium stress on growth and accumulation of bioactive compounds in brown alga Sargassum horneri
LÜ Fang1,2, ZHAN Dong-mei1,2, GUO Wen1, WU Hai-yi1,2, DING Gang1,2, LUAN Qing3
(1.Marine Biology Institute of Shandong Province, Qingdao 266104, China; 2.Qingdao Macroalgae Engineering Technology Research Center, Qingdao 266104, China; 3.College of Life Science, Yantai University, Yantai 264005, China)
The effects of cadmium concentrations on growth,physiological biochemical characteristics including photosynthetic pigment, soluble sugar and soluble protein)and bioactive accumulation of fucoxanthin, alginate and phlorotannins were studied in brown alga Sargassum horneri exposed to cadmium concentrations of 0,0.1,0.5,1.0 and 5.0 mg/L prepared by CdCl2·2.5 H2O at water temperature of 15℃ for 15 days to evaluate effects of heavy metal polution on growth and quality of economically important sea weed.The results showed that the brown alga in control group had continual increase in specific growth rate(SGR)in thalli.The brown alga exposed to 0.1 and 0.5 mg/L Cd, however, showed gradual increase in SGR during the first 10 days and then stable to 15thday, the brown alga exposed to 1.0 mg/L Cd showing a fluctuation trend in SGR with time,and exposed to 5.0 mg/L having elevated SGR first and then being decreased.The physiological biochemical indices of the macroalgae were found to be varied with exposed period, on the 15thday, significantly lower contents of chlorophyll a, carotenoid and soluble protein than those in the control group(p<0.05), and significantly higher soluble sugar content than that in the control group(p<0.05).The contents of fucoxanthin and phlorotannins were found to be decreased significantly in the brown alga under Cd stress,with the greater decline range at higher concentration of Cd.There was no significant change in alginate content under Cd concentration of≤0.5 mg/L(P>0.05), significant decrease at Cd concentration of≥1.0 mg/L(p<0.05).The findings suggest that the heavy metal pollution be considered as an important factor in development of the brown alga industry in mariculture area.
Sargassum horneri; cadmium; photosynthetic pigment; fucoxanthin; alginate; phlorotannin
P735
A
10.16535/j.cnki.dlhyxb.2017.06.005
2095-1388(2017)06-0664-07
2017-04-01
国家海洋公益性行业科研专项 (201505022,201405040);山东省现代农业产业技术体系创新团队项目 (SDAIT26);山东省农业重大应用技术创新项目
吕芳 (1982—),女,博士,助理研究员。E-mail:lvfang8254@163.com
郭文 (1963—),男,研究员。E-mail:guowen1963@126.com
