沙利度胺抑制卵巢癌细胞SKOV-3体外生长的研究
2017-12-27,,,,,
,, , , ,
(1.皖南医学院第二附属医院 妇产科,安徽 芜湖 241000;2.皖南医学院 病理生理学教研室,安徽 芜湖 241002)
·临床医学·
沙利度胺抑制卵巢癌细胞SKOV-3体外生长的研究
张玲1,高红亮2,吴超2,程倩2,虞乐2,李曙2
(1.皖南医学院第二附属医院 妇产科,安徽 芜湖 241000;2.皖南医学院 病理生理学教研室,安徽 芜湖 241002)
目的:探讨沙利度胺对卵巢癌细胞株SKOV-3的增殖抑制以及凋亡的影响,为后续临床治疗及基础研究提供依据。方法采用MTT法测定不同浓度沙利度胺作用于SKOV-3细胞株24 h后的吸光度,测定其对SKOV-3的增殖抑制率,Tunel染色法鉴定细胞凋亡,流式细胞术检测细胞凋亡,Q-PCR法检测caspase3 mRNA表达水平,Western Blot法检测caspase3蛋白表达水平。结果沙利度胺的浓度从31 μg/mL增加至500 μg/mL时,对于SKOV-3的增殖抑制率从6.22%上升至86%;300 μg/mL沙利度胺处理SKOV-3 24 h后,流式细胞术检测其凋亡率上升为52.66%,明显高于空白对照(P<0.01)。Tunel法在荧光显微镜下观察,沙利度胺组可见大片绿色荧光。同时,沙利度胺处理后的SKOV-3的caspase3 mRNA及蛋白表达量与空白对照组相比也明显上升(P<0.01)。结论沙利度胺能够抑制卵巢癌细胞SKOV-3的增殖并且能够诱导其凋亡。
沙利度胺;卵巢癌细胞;凋亡
卵巢癌作为一种恶性的生殖肿瘤,已经成为发达国家妇女肿瘤致死率第五的疾病。在过去的40年,对于卵巢癌的治愈率并没有显著的改善[1]。目前的治疗手段主要以手术及化疗为主[2-3]。沙利度胺是一种消旋体谷氨酸衍生物,具有镇静、止吐作用,起初用于治疗妊娠呕吐,因严重致畸事件在1961年被禁用[4-5]。目前,欧洲药品管理局(European Medicines Agency,EMA)批准其适应证仅限于治疗多发性骨髓瘤,中国SFDA所批准的适应证仅限于控制瘤型麻风反应症。但临床实践中沙利度胺的应用范围已远远超出了FDA、EMA、SFDA所批准的适应证,在如肾癌、恶性黑素瘤、胶质瘤、淋巴瘤、结直肠癌、肝癌、前列腺癌等实体瘤中的治疗中有一定效果[6-7]。同时,近年的研究发现,沙利度胺具有调节免疫及抗血管生成等作用[8]。这使得沙利度胺再次成为研究的热点。本研究希望通过分子生物学手段来观察沙利度胺对于卵巢癌细胞株SKOV-3增殖凋亡的影响。
1 材料和方法
1.1 材料 人卵巢癌细胞SKOV-3购于中科院上海细胞库。沙利度胺购于常州制药厂,为纯品原料药,溶于二甲基亚砜(DMSO)后得终浓度为50mg/mL的溶液。四甲基偶氮唑蓝(MTT)试剂盒,TUNEL凋亡检测试剂盒购于碧云天生物有限公司。凋亡试剂盒购于美国Sigma公司。caspase3一抗购于CST公司,二抗购于碧云天生物有限公司。caspase3引物购于上海生工生物工程有限公司。
1.2 方法
1.2.1 细胞培养 SKOV-3细胞株于含有10%小牛血清的RPMI-1640的培养基中贴壁培养,同时加入双抗(1%青霉素和链霉素),置于37℃、含5%CO2的培养箱中培养。
1.2.2 增殖抑制率检测 采用MTT 法检测不同浓度沙利度胺处理SKOV-3 24 h后的增殖抑制率。将处于对数生长期的SKOV-3细胞消化,种于96孔板中,保持细胞浓度5×103/孔,培养24 h后,换液,加入沙利度胺终浓度分别为500 μg/mL、250 μg/mL、125 μg/mL、62 μg/mL、31 μg/mL的无血清培养基,每个浓度设3个副孔,培养24 h,加入MTT( 5g /L) 各20 μL,4 h 后,吸出培养液,再在每孔加入DMSO150 μL,避光轻微振荡5min使结晶充分溶解,在酶标仪570 nm 波长下测吸光度(C)值。细胞增殖抑制率(%)=(对照组C值-实验组C值)/对照组C值×100%。并计算出沙利度胺的IC50。
1.2.3 流式细胞术检测凋亡率 运用Annexin V- FITC /PI 双染检测沙利度胺作用于SKOV-3 24 h的凋亡率,沙利度胺作用SKOV-3,24 h后,PBS洗两遍,收集上清液离心,然后用0.25%不含EDTA的胰酶消化,制备单细胞悬液浓度1×106个细胞 /mL,离心2000 r/min,5min,PBS洗涤两次,收集细胞,用200 μL缓冲液重悬,分别加入5 μL FITC和10 μL PI,4℃避光孵育15min。用PBS将悬液补充至700 μL,上机检测。
1.2.4 Tunel检测细胞凋亡 采用一步法Tunel细胞凋亡试剂盒检测细胞凋亡,取用处于生长对数期的SKOV-3细胞,消化,种于6孔板中,贴壁培养24 h后,加入沙利度胺作用24 h后,按照试剂盒使用说明完成检测。
1.2.5 Q-pcr检测caspase3表达水平 用300 μg/mL沙利度胺作用处理SKOV-3 24 h,后用Trizol提取药物组与正常对照组细胞RNA。将RNA逆转录为cDNA,条件为:25℃ 10 min, 50℃ 30 min, 85℃5 min。以cDNA作为模板完成实时荧光定量PCR。基因的引物采用Primer5.0软件设计。caspase3的上游引物:5′-GCAAACCTCAGGGAAACATT-3′;下游引物:5′-ACCTGGACAACTGGACTTTT-3′。β-actin:的上游引物:5′-GATTACTGCTCTGGCTCCTAGC-3′;下游引物:5′-GACTCATCGTACTCCTGCTTGC-3′。
1.2.6 Western blot检测caspase3蛋白表达水平 沙利度胺处理SKOV-3 24 h后,用含有蛋白酶抑制剂的RIPA 1640强裂解液来提取细胞总蛋白。采用BCA法测定蛋白浓度,并将蛋白于-80℃冰箱保存。运用十二烷基硫酸钠聚丙烯酰胺凝胶电泳分离所提蛋白,并将蛋白转移至PVDF膜上。用5%BSA封闭2 h后,孵以一抗,4℃摇床过夜。次日,TBST清洗3次,每次5 min。二抗孵育2 h。用冷CCD成像系统观察蛋白表达。结果运用Image J软件分析。
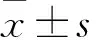
2 结果
2.1 沙利度胺处理后增殖抑制率的比较 通过计算得出沙利度胺的IC50约为300 μg/mL 。MTT实验结果显示:通过与空白组比较,沙利度胺处理后的SKOV-3的增殖能力减弱,并呈浓度依赖关系,其中200 μg/mL与500 μg/mL沙利度胺处理组与空白对照组比较差异具有统计学意义(P<0.01)。说明沙利度胺能够有效抑制SKOV-3的增殖,见表1。
表1 沙利度胺不同浓度组细胞增殖抑制率的比较
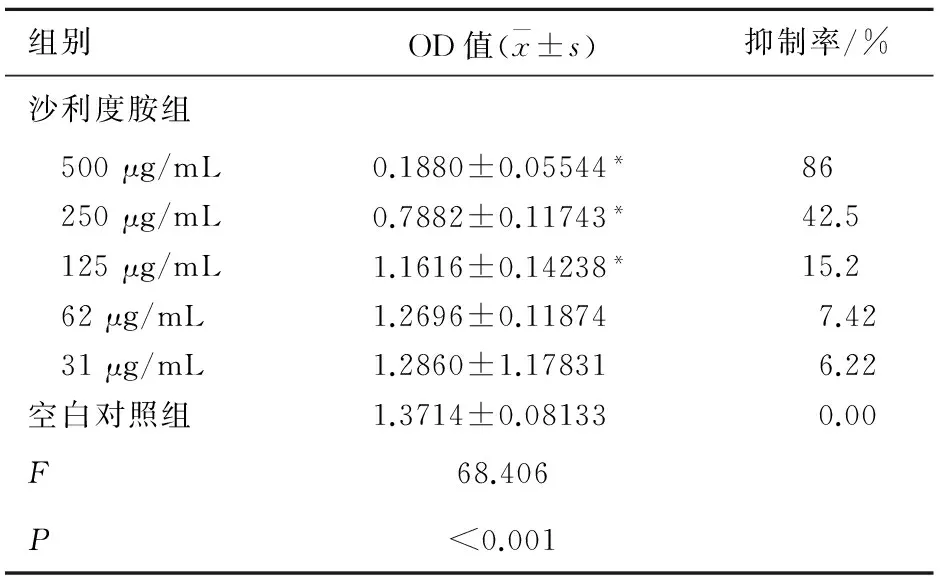
组别OD值(x±s)抑制率/%沙利度胺组 500μg/mL0.1880±0.05544*86 250μg/mL0.7882±0.11743*42.5 125μg/mL1.1616±0.14238*15.2 62μg/mL1.2696±0.118747.42 31μg/mL1.2860±1.178316.22空白对照组1.3714±0.081330.00F68.406P<0.001
*为与空白对照组比较,P<0.05。
2.2 沙利度胺处理后对SKOV-3细胞凋亡的影响 采用一步法Tunel凋亡染色和流式细胞术检测沙利度胺处理后的SKOV-3的凋亡率。在荧光显微镜下观察,沙利度胺处理组在镜下可见大量绿色荧光,说明凋亡率增加(图1A)。结果显现沙利度胺处理24 h后的凋亡率可达到52.66%,高于空白对照组(图1B),差异具有统计学意义(P<0.01)。
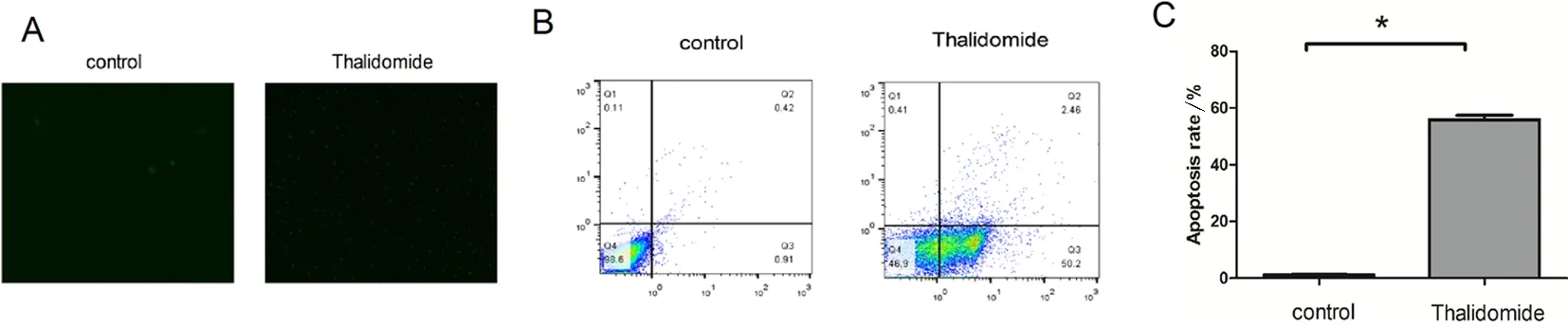
A.空白对照与沙利度胺处理组Tunel法凋亡检测的比较;B、C.流式细胞术检测空白对照与沙利度胺处理组的凋亡率。*P<0.01vscontrol。
图1 沙利度胺处理后对SKOV-3细胞凋亡的影响
2.3 沙利度胺处理后caspase3表达水平的比较 采用Q-PCR法分析沙利度胺处理组与空白对照组之间caspase3 mRNA的表达水平,发现沙利度胺处理组的SKOV-3细胞的caspase3的表达水平要远远高于正常细胞(图2A)。差异具有统计学意义(P<0.01)。沙利度胺处理组与空白对照组的caspase3表达量,通过Western Blot结果显示,沙利度胺处理组的caspase3的表达量明显高于空白对照组(图2B、C)。差异具有统计学意义(P<0.01)。说明沙利度胺能够促进SKOV-3的凋亡。

A.沙利度胺处理组与空白对照组caspase3 mRNA表达水平的比较;B、C.沙利度胺处理组与空白对照组caspase3蛋白表达水平的比较。
*P<0.01vscontrol。
图2 沙利度胺处理后caspase3表达水平的比较
3 讨论
卵巢癌是女性生殖系统常见的恶性肿瘤之一,发病率位居所有生殖器官恶性肿瘤的第三位。早期卵巢癌无明显典型症状,发现时,基本已属晚期,对妇女的生命健康造成了巨大的威胁[9-10]。沙利度胺最初作为镇静剂治疗妊娠呕吐,因有致畸作用(婴儿海豹肢)而被禁用。肿瘤患者多有免疫机能的异常, 正常情况下肿瘤与宿主的免疫防御之间处于动态平衡。这种平衡遭到破坏,可使肿瘤处于优势地位而得以发生增殖、扩散和转移。研究显示,沙利度胺对淋巴细胞有调节作用,能诱导细胞毒T 细胞的增殖,降低CD4+和CD8+细胞的比例,从而增加IFN-γ和IL-2 的分泌,IFN-γ和IL-2 本身具有直接抗肿瘤的作用。此外,通过增强NK 细胞活性还可以达到间接抗肿瘤的效果。另一方面,临床前和临床的证据显示,沙利度胺能够诱导T 淋巴细胞分泌IL-2 和IFN-γ,它们又会反馈刺激T 细胞增殖,进而增强机体的抗肿瘤免疫作用[11-13]。故我们希望通过了解沙利度胺在处理卵巢癌细胞SKOV-3后对其的增殖与凋亡的影响,从而为沙利度胺更好地用于临床抗肿瘤应用以及基础研究提供依据。在本研究中我们发现,沙利度胺处理SKOV-3 24 h后,细胞的增殖抑制率随沙利度胺浓度的上升而上升,在沙利度胺的浓度达到250 μg/mL时,增殖抑制率即可达到42%,说明沙利度胺对SKOV-3细胞的增殖具有一定的抑制作用。另外通过流式检测,发现经过沙利度胺处理后的SKOV-3的凋亡率与空白对照组比较明显上升。表明沙利度胺能够有效地诱导SKOV-3的凋亡。经典的凋亡途径分为两条,分别为胞外途径以及胞内途径,死亡受体与配体的结合最终导致死亡信号的传递,死亡受体的死亡结构域(death domain,DD)与信号传导分子结合,形成死亡诱导信号复合物,最终导致了caspase3及下游的caspase的活化。同时有大量研究表明,在多种细胞及各种因素的刺激下,caspase3是凋亡的关键执行者。故我们通过Western Blot及Q-PCR检测caspase3在沙利度胺处理组中的表达情况。结果发现经过沙利度胺处理后的SKOV-3,caspase3的表达量明显升高,说明通过沙利度胺的处理,能有效地激活caspase3,引起SKOV-3的凋亡。但是其中具体的分子机制尚不清楚,有待于后续研究证实。通过本实验,希望能够为以后沙利度胺更好地应用于临床提供研究基础。
[1] ROJAS V, HIRSHFIELD KM, GANESAN S,etal. Molecular Characterization of Epithelial Ovarian Cancer: Implications for Diagnosis and Treatment[J]. International Journal of Molecular Sciences, 2016, 17(12): 2113.
[2] BAX HJ, JOSEPHS DH, PELLIZZARI G,etal. Therapeutic targets and new directions for antibodies developed for ovarian cancer[C]//mAbs. Taylor & Francis, 2016, 8(8): 1437-1455.
[3] 刘云, 杜成, 刘文超. 卵巢癌治疗新进展[J]. 现代肿瘤医学, 2015, 23(4): 553-556.
[4] BAUDITZ J. Effective treatment of gastrointestinal bleeding with thalidomide-Chances and limitations [J]. World journal of gastroenterology, 2016, 22(11): 3158.
[5] MELLIN GW,KATZENSTEIN M. The saga of thalidomide. Neuropathy to embryopathy,with case reports of congenital anomalies[J].NEngl J Med,1962,267:123.
[6] ARAIH, FURUSUA, NISHINOT,etal.Thalidomide prevents the progression of peritoneal fibrosis in mice[J].Acta Histochem Cytochem, 2011, 44(2):51-60.
[7] RUAN J,MARTIN P,COLEMAN M,etal. Durable Responses with the Metronomic Regimen RT-PEPC in Elderly Patients with Recurrent Mantle Cell Lymphoma Cancer[J].Cancer,2010,116(11):2655-2664.
[8] LI TH, HUANG CC, YANG YY,etal. Thalidomide Improves the Intestinal Mucosal Injury and Suppresses Mesenteric Angiogenesis and Vasodilatation by Down-Regulating Inflammasomes-Related Cascades in Cirrhotic Rats[J]. PloS one, 2016, 11(1): e0147212.
[9] HENNESSY BT, COLEMAN RL, MARKMAN M. Ovarian cancer [J]. The Lancet, 2009, 374(9698): 1371-1382.
[10] COPUR M S, GAUCHAN D, RAMAEKERS R,etal. Neoadjuvant chemotherapy or primary debulking surgery for stage IIIC ovarian cancer[J]. Journal of Clinical Oncology, 2016,35(7):802-803.
[11] QUACH H,RITCHIE D,STEWART AK,etal. Mechanism of action of immunomodulatory drugs (IMiDS) in multiple myeloma[J]. Leukemia, 2010, 24(1):22.
[12] XU Y, SUN J, SHEARD MA,etal. Lenalidomide overcomes suppression of human natural killer cell anti-tumor functions by neuroblastoma microenvironment-associated IL-6 and TGFβ1[J]. Cancer Immunology, Immunotherapy, 2013, 62(10): 1637-1648.
[13] SIM GC, WU S, JIN L,etal. Defective STAT1 activation associated with impaired IFN-γ production in NK and T lymphocytes from metastatic melanoma patients treated with IL-2[J]. Oncotarget, 2016, 7(24): 36074.
InvitroinhibitingtheproliferationofhumanovarycancercelllineSKOV-3usingthalidomide
ZHANGLing,GAOHongliang,WUChao,CHENGQian,YULe,LIShu
Department of Gynecology & Obstetrics, The Second Affiliated Hospital of Wannan Medical College, Wuhu 241000, China
Objective:To investigate the effects of thalidomide on inhibiting proliferation and promoting apoptosis of human ovarian cancer cell line SKOV-3 for evidence in clinical use and fundamental research of this drug.Methods: MTT assay was performed to detect the absorbance value of different concentration of thalidomide acting on SKOV-3 24 h after administration for measurement of the inhibition rate. TTUNEL apoptosis detecting kit and flow cytometry were used to detect the cell apoptosis, and Q-PCR to detect the level of caspase-3 mRNA expression. Caspase-3 protein level was determined using Western blot.Results: MTT results showed that the inhibition rate rose up to 86% from 6.22% with thalidomide concentration of 500 μg/mL from 31 μg/mL. Apoptosis rate of SKOV-3 was up to 52.66% after thalidomide treatment by final concentration of 300 μg/mL, which was significantly higher compared to the control group(P<0.05). Large areas of the green fluorescence were observed under fluorescent microscope, and the mRNA and protein levels of caspase-3 in SKOV-3 after thalidomide administration were significantly increased as compared with the blank control group(P<0.01).Conclusion: Thalidomide is able to inhibit the proliferation and promote apoptosis of ovarian cancer cell line SKOV-3.
thalidomide; ovarian cancer; cell apoptosis
1002-0217(2017)05-0433-04
安徽省高校优秀青年人才支持计划重点项目(gxyqZD2016172);大学生创新训练计划(201510368038; 201610368116 )
2017-06-02
张 玲(1978-),女,主治医师,(电话)13855308893,(电子信箱)71926023@qq.com;李 曙,男,副教授,(电子信箱) yxx2003@126.com,通信作者。
R 737.31
A
10.3969/j.issn.1002-0217.2017.05.007
