棕榈酸对转化生长因子β1刺激的肝星状细胞增殖、凋亡及Caspase-12蛋白表达的影响*
2017-12-27李雅楠闫宇王铭刘芳肖永红
李雅楠 ,闫宇 ,王铭 ,刘芳 ,肖永红
(华北理工大学 1.公共卫生学院,2.临床医学院,河北 唐山 063000)
棕榈酸对转化生长因子β1刺激的肝星状细胞增殖、凋亡及Caspase-12蛋白表达的影响*
李雅楠 1,闫宇 2,王铭 1,刘芳 1,肖永红 1
(华北理工大学 1.公共卫生学院,2.临床医学院,河北 唐山 063000)
目的研究棕榈酸对转化生长因子β1(TGF-β1)刺激的肝星状细胞(HSC)增殖、凋亡及半胱氨酸天冬氨酸蛋白酶12(caspase-12)蛋白表达的影响。方法将液氮保存下的肝星状细胞株,于37℃、5%CO2孵箱中进行复苏传代培养,同步化后将细胞分为5组:空白组、TGF-β1(5 ng/ml)组、TGF-β1+低、中、高剂量棕榈酸组,即5 ng/ml TGF-β1刺激24 h,再分别加入50、100及200 μmol/L不同剂量棕榈酸作用24 h后,用MTT比色法检测细胞增殖、流式细胞仪检测细胞凋亡率、免疫细胞化学法测定Caspase-12蛋白表达。结果不同浓度棕榈酸均能抑制细胞增殖(P<0.05),且随着剂量的增加,细胞相对增殖率(RGR)降低,低、中、高剂量组分别为76.56%、60.93%和34.37%,组间比较差异有统计学意义(P<0.05)。透视电镜发现,不同剂量棕榈酸组出现细胞核变小,细胞出现大量线粒体空泡,染色质边集等典型凋亡表现。空白组、TGF-β1组、TGF-β1+低、中、高剂量棕榈酸组凋亡率分别为(3.32±0.29)%、(1.70±0.14)%、(7.26±0.46)%、(11.24±0.52)%及(15.55±0.31)%,组间两两比较差异有统计学意义(P<0.05);随着棕榈酸剂量的增加,细胞Caspase-12蛋白表达增加(P<0.05)。结论棕榈酸能抑制细胞增殖,增加Caspase-12蛋白表达,促进HSC凋亡。
肝星状细胞;棕榈酸;细胞增殖;细胞凋亡;半胱氨酸天冬氨酸蛋白酶12(caspase-12)
肝纤维化(hepatic fibrosis,HF)是对慢性肝损伤的愈合反应,为一个可逆的过程[1]。肝星状细胞(hepatic stellate cell,HSC)是肝脏分泌细胞外基质(extra cellular matrixc,ECM)的主要细胞,HSC 激活并转化为肌成纤维细胞样细胞是HF发生、发展的核心环节[2]。而转化生长因子β1(transforming growth factor beta-1,TGF-β1)可以激活HSC并增加多种促纤维化因子的表达,在肝纤维化中起重要作用[3]。如何逆转HF的进程是抗HF研究的重点之一。近年来,针对诱导活化的HSC凋亡成为研发抗HF药物的热点。棕榈酸是一种动植体内常见的高级饱和脂肪酸,有研究报道[4],棕榈酸刺激巨噬细胞的脂肪细胞脂肪酸结合蛋白(A-FABP)表达增加,可引起巨噬细胞内质网应激和凋亡,从而发挥促动脉粥样硬化作用。亦有研究报道[5-6],棕榈酸通过内质网应激途径诱导成骨细胞凋亡,且呈浓度和时间依赖性降低成骨细胞增殖活性,增加细胞凋亡,增高细胞内质网应激相关蛋白和基因的表达,但其具体机制目前尚不明确。本研究用棕榈酸作用于经TGF-β1刺激的HSC,观察细胞增殖、凋亡及ERS标志性蛋白Caspase-12的变化,旨在从ERS途径探讨棕榈酸对HSC凋亡的影响,以为HF的治疗提供新的靶点。
1 材料与方法
1.1 细胞株
表型为活化的HSC株,从四氯化碳刺激的大鼠肝细胞中分离并获得永生性。
1.1.1 药品与试剂棕榈酸(购自北京百威灵公司),二甲基亚砜(DMSO)、青霉素及链霉素混合液(双抗)(美国Sigma公司生产),胎牛血、DMEM高糖培养基、磷酸盐缓冲液及含体积分数0.25%乙二胺四乙酸(EDTA)胰蛋白酶(购自美国BI公司),TGF-β1(批号:PHG9204,购自美国Gibco公司),辣根过氧化物酶(HRP)标记的山羊抗兔二抗(美国Arigo公司),兔抗鼠Caspase-12一抗(武汉博士德有限公司),FITC Annexin V Apoptosis Detection Kit Ι(购自美国BD公司)。
1.1.2 仪器3111细胞孵育箱(美国Thermo公司),FACScalibur流式细胞仪(美国贝帝公司),AC24S1生物安全柜(新加坡ESCO公司),TS100F倒置相差显微镜(日本Nikon公司),Universal HoodⅡ凝胶成像分析仪,7500透射电子显微镜(日本Hitachi公司)。
1.2 方法
1.2.1 细胞培养将存放于液氮中的细胞复苏传代培养于含有6%胎牛血清、1%双抗(100 u/ml青霉素、100 μg/ml链霉素)DMEM 高糖培养基中,在37℃、5%二氧化碳CO2孵箱中进行孵育。当细胞长满密度达到80%时,胰蛋白酶进行传代并接种在细胞培养瓶中。
1.2.2 细胞分组及处理空白组,TGF-β1组,TGF-β1+低、中、高剂量棕榈酸组。空白组加入无血清培养基培养48 h,TGF-β1组加入5 ng/ml TGF-β1作用细胞48 h,TGF-β1+低、中、高剂量棕榈酸组先用5 ng/ml TGF-β1作用细胞24 h,再分别加入50、100及200 μmol/L棕榈酸,培养24 h后检测各项指标的改变。
1.2.3 MTT比色法检测HSC增殖 [7]细胞经常规培养后,以2.5×104个/孔的密度接种于96孔板中,每孔200 μl细胞悬液,每组设置5个复孔并在37℃、5%CO2孵箱中进行孵育48 h,在培养结束前,每孔加入20 μl MTT避光孵育4 h,4 h之后弃去上清液,加入200 μl DMSO,避光震荡10 min后酶标仪490 nm波长处读取光密度值(OD),计算细胞相对增殖率(relative growth rate,RGR)RGR= 实验组OD490/对照组OD490×100%。
1.2.4 透视电子显微镜观察HSC超微结构的改变[8]将细胞处理后进行消化、离心,预冷的PBS洗3遍,戊二醛4℃固定过夜。然后用PBS缓冲液洗2 h,锇酸固定1.5 h,PBS再次清洗2 h,然后依次经过酒精(30%、50%、70%、90%、100%)脱水,树脂包埋,AOE型钻石切片机进行超薄切片,枸橼酸铅,醋酸铀双染,透视电子显微镜观察HSC细胞内超微结构的改变。
1.2.5 AV/PI双染检测HSC凋亡[9]细胞经过处理后,预冷PBS清洗3遍,胰蛋白酶进行消化,离心,沉淀细胞,弃去培养基,预冷PBS再次清洗3遍;预留1/3空白组细胞,不加任何染料,作为阴性对照组,剩下细胞加入1×Binding buffer 195 μl+5 μl An-nexin V,轻轻吹打进行混匀,避光孵育30 min,离心沉淀细胞,弃上清液,加入1×Binding buffer 195μl+5 μl PI,轻轻吹打混匀,之后流式细胞仪检测。
1.2.6 免疫细胞化学法检测HSC内Caspase-12蛋白表达[9]取对数生长期的细胞,胰蛋白酶消化,接种在带有玻片的6孔板内,按照各处理组操作完成后,将培养板孔中的盖玻片取出,PBS冲洗2次,用4%多聚甲醛固定,按SP法试剂盒操作方法进行Caspase-12蛋白免疫细胞化学染色,DAB显色后,显微镜下观察后摄片。结果判定:以胞浆棕黄色为阳性表达。
图像分析:将染色后的细胞爬片经Image-pro plus专业图像分析系统进行半定量分析,200倍视野下每组图片随机选取6个视野,取其积分光密度值作为Caspase-12蛋白表达。
1.3 统计学方法
数据分析采用SPSS 17.0统计软件,计量资料以均数±标准差(±s)表示,采用方差分析,两两比较用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 细胞增殖情况
经单因素方差分析结果显示,各组OD值比较差异有统计学意义(F=195.25,P=0.000),TGF-β1组与空白组比较OD值增高(P<0.05);不同浓度棕榈酸均抑制细胞增殖(P<0.05),且随着剂量的增加,细胞RGR降低,低、中、高剂量棕榈酸组,组间两两比较差异有统计学意义(P<0.05)。见表1。
2.2 HSC细胞内超微结构的改变
空白组细胞体积较大,轮廓不规则,伸展性好,周缘伸出密集不规则的树枝状伪足。胞内超微结构可见正常微绒毛、线粒体、粗面内质网、游离核糖体和细胞核(见图1A);TGF-β1组和空白组无差异,有完整的细胞器,细胞核处于分裂相,染色质分布均匀(见图1B);TGF-β1+低剂量棕榈酸组,细胞表面微绒毛消失,表面平滑,胞浆收缩(见图1C);TGF-β1+中剂量棕榈酸组染色质凝集、浓缩(见图1D);TGF-β1+高剂量棕榈酸组染色质密度增加,沿核膜边集,厚薄不均,细胞质内出现大量空泡,细胞核变小等典型细胞凋亡特征(见图1E)。
2.3 各处理组细胞间凋亡率
流式细胞仪检测各处理肝星状细胞凋亡散点图,见图2。经统计学分析显示,不同处理组间细胞凋亡率差异均有统计学意义(F=707.27,P=0.000),TGF-β1组凋亡率低于空白组(P<0.05);随着棕榈酸剂量加大,细胞凋亡率增加。见表2。
2.4 HSC内Caspase-12蛋白表达
不同处理组HSC免疫组织化学结果见图3。与空白组比较,TGF-β1组HSC的细胞浆染色深浅不明显(见图3B);低、中、高剂量棕榈酸细胞浆出现棕黄色,且随着剂量的增加,细胞浆棕黄色逐渐加深(见图3C~E)。与空白组比较,TGF-β1组Caspase-12蛋白表达未见差异(P>0.05),不同剂量棕榈酸使HSC中Caspase-12蛋白表达增强(P<0.05)。见表3。
表1 不同处理组HSC吸光度的改变 (n=5,±s)
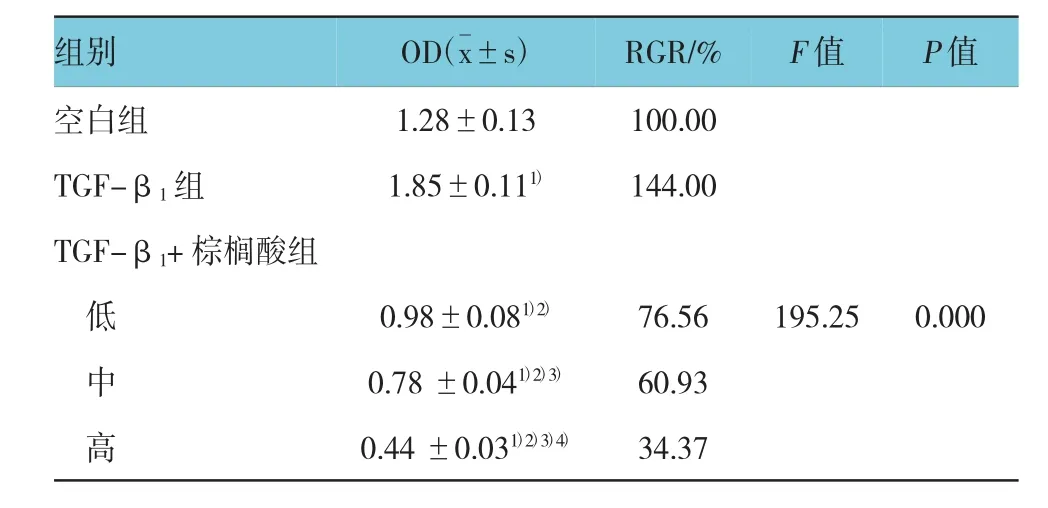
表1 不同处理组HSC吸光度的改变 (n=5,±s)
注:1)与空白组比较,P<0.05;2)与 TGF-β1组比较,P<0.05;3)与TGF-β1+低剂量棕榈酸组比较,P<0.05;4)与TGF-β1+中剂量棕榈酸组比较,P<0.05
空白组 1.28±0.13 100.00 TGF-β1组 1.85±0.111) 144.00 TGF-β1+棕榈酸组低0.98±0.081)2) 76.56 195.25 0.000中0.78 ±0.041)2)3) 60.93高0.44 ±0.031)2)3)4) 34.37

图1 透视电子显微镜下各处理组细胞的形态变化
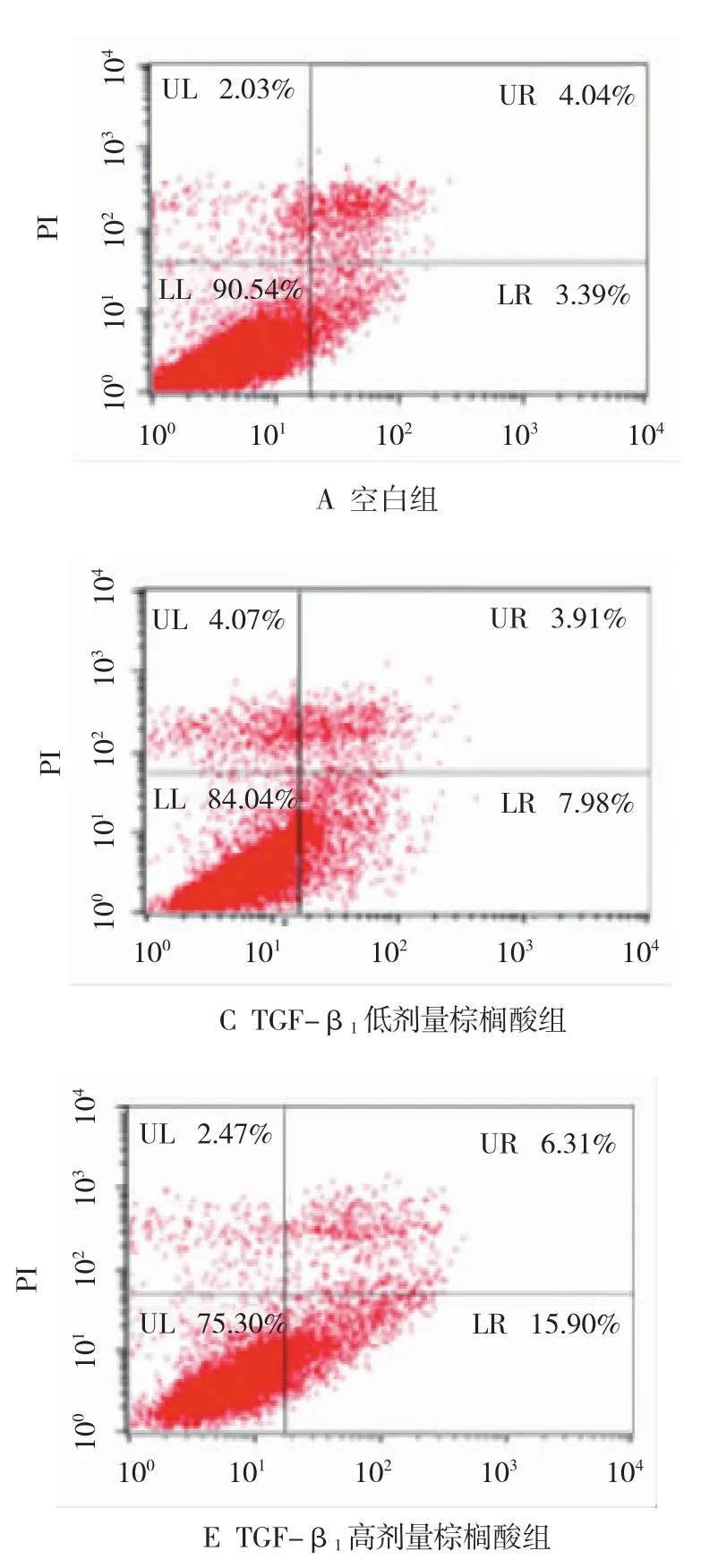
图2 不同处理组HSC凋亡散点图
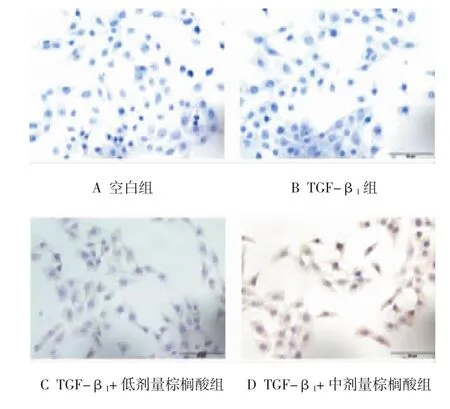
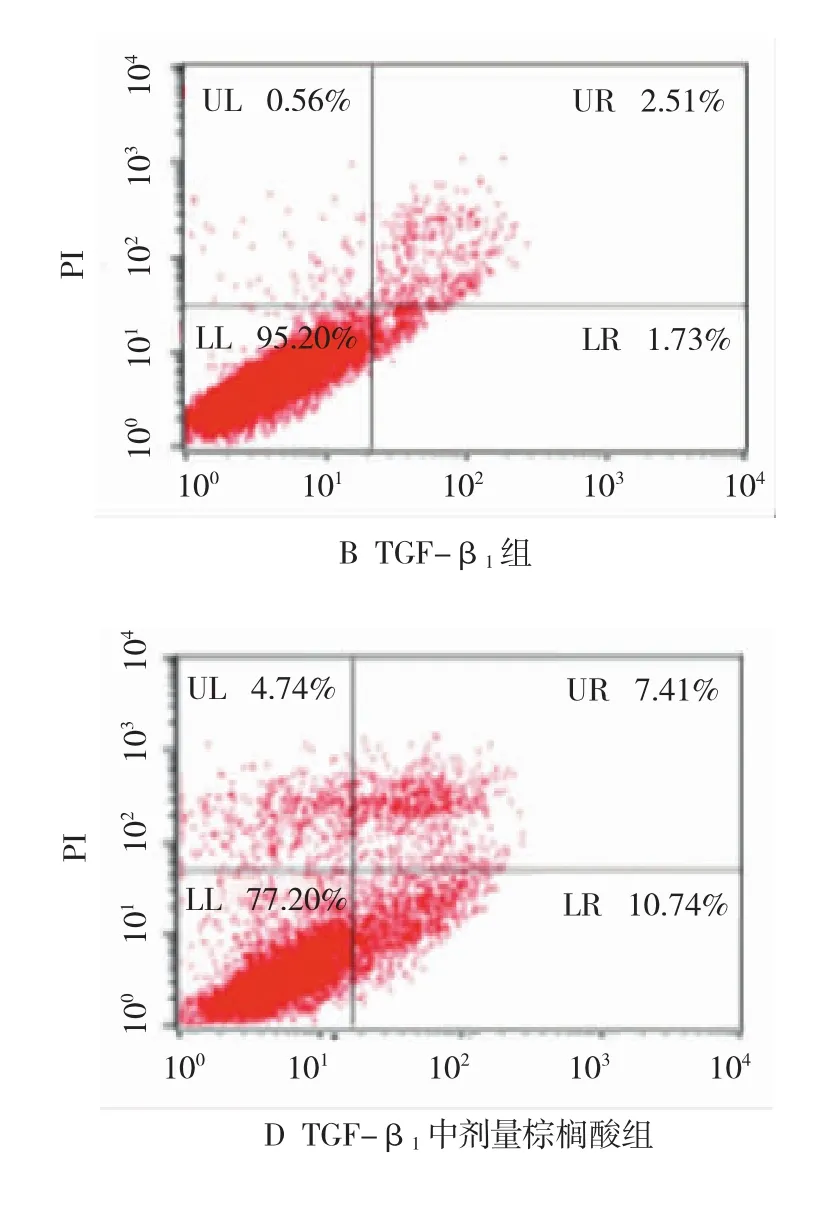
表2 不同处理组HSC凋亡率的改变 (n=3,%,±s)
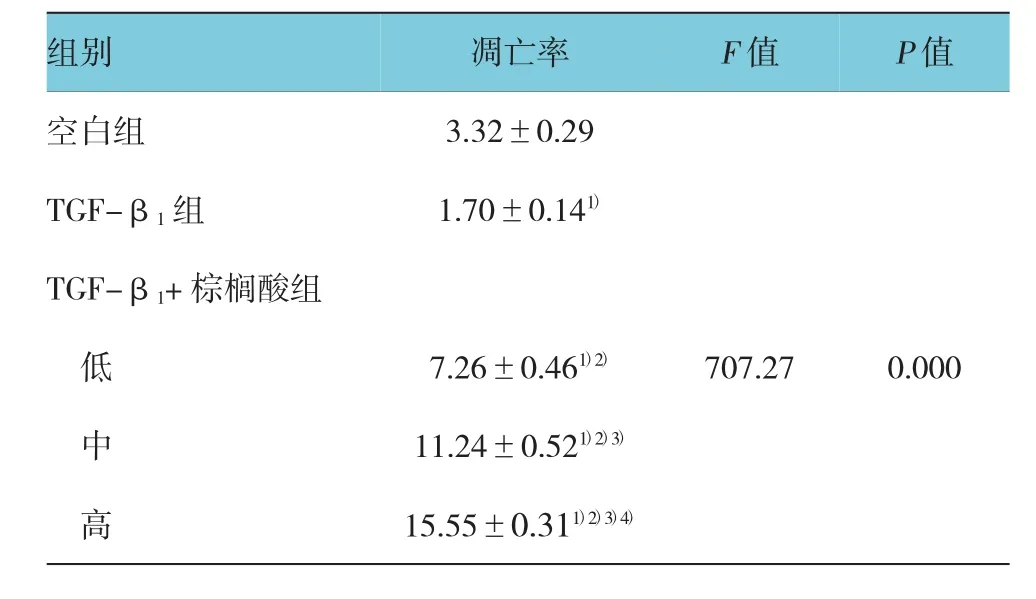
表2 不同处理组HSC凋亡率的改变 (n=3,%,±s)
注:1)与空白组比较,P<0.05;2)与 TGF-β1组比较,P<0.05;3)与TGF-β1+低剂量棕榈酸组比较,P<0.05;4)与TGF-β1+中剂量棕榈酸组比较,P<0.05
空白组 3.32±0.29 TGF-β1组 1.70±0.141)TGF-β1+棕榈酸组低7.26±0.461)2) 707.27 0.000中11.24±0.521)2)3)高15.55±0.311)2)3)4)
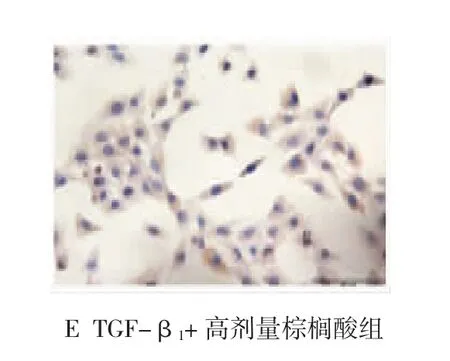
图3 各处理组细胞中Caspase-12蛋白的表达(免疫组织化学)
表3 各组HSC中Caspase-12蛋白表达 (n=6,±s)
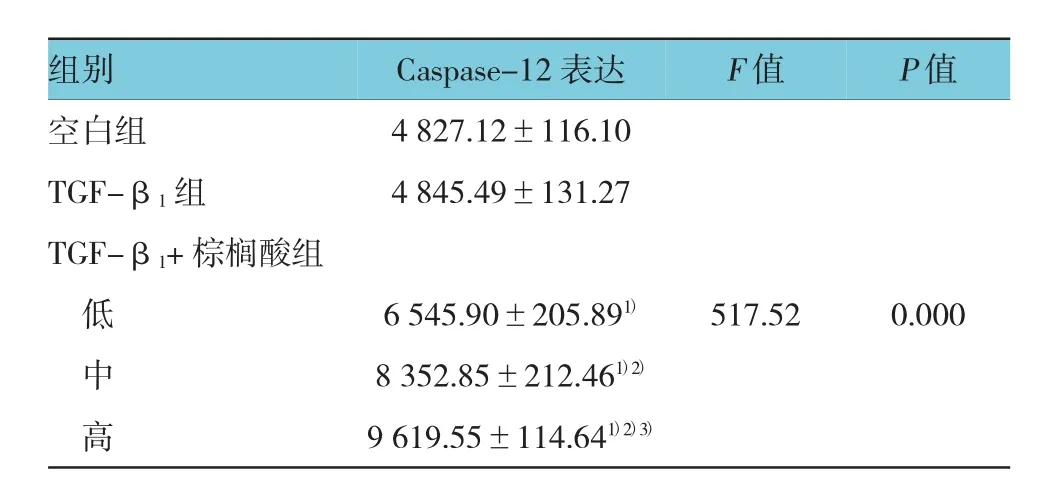
表3 各组HSC中Caspase-12蛋白表达 (n=6,±s)
注:1)与空白组比较,P<0.05;2)与 TGF-β1组比较,P<0.05;3)与TGF-β1+低剂量棕榈酸组比较,P<0.05
空白组 4 827.12±116.10 TGF-β1组 4 845.49±131.27 TGF-β1+棕榈酸组低6 545.90±205.891) 517.52 0.000中8 352.85±212.461)2)高9 619.55±114.641)2)3)
3 讨论
传统观点认为,HF形成过程中的关键效应细胞是HSC。TGF-β1刺激HSC可作为体外的HF模型,可以用于进行HSC基因表达调控、抗纤维化药物作用及纤维化发生机制等研究[3]。促进活化的HSC凋亡,有助于逆转HF。棕榈酸是一种在生物体内广泛存在的饱和脂肪酸,又称十六烷酸。有结果表明,棕榈酸对βTC6细胞增殖率及胰岛素的合成有抑制作用,并且呈时间-剂量依赖性作用,证实棕榈酸对βTC6细胞的毒性损伤作用[10]。本研究用不同剂量棕榈酸作用于经TGF-β1刺激的HSC,MTT结果显示,低、中、高剂量棕榈酸增殖率依次降低,说明棕榈酸明显抑制HSC增殖。
PARK等[11]发现,HSC经棕榈酸处理后其线粒体和内质网较对照组疏松,当加入Caspase、p53或内质网应激抑制剂能使细胞增殖水平恢复。表明棕榈酸能抑制细胞增殖可能与细胞凋亡、自噬和内质网应激有关。有研究发现[5],棕榈酸可诱导包括成骨细胞在内的多种细胞凋亡,内质网应激可能参与棕榈酸诱导成骨细胞凋亡过程。
内质网应激反应在棕榈酸诱导的人脐带间充质干细胞、胰岛细胞凋亡中也发挥重要作用[12-14]。内质网应激(endoplasmic reticulum stress,ERS)是继死亡受体活化和线粒体损伤之后第3条介导细胞凋亡的信号转导通路。其中ERS有1条特有Caspase-12途径,Caspase-12与其他的Caspases一样以无活性的酶原形式存在。ERS引起Caspase-12激活,激活的Caspase-12切割并激活Caspase-9,活化的Caspase-9激活Caspase-3等效应Caspases,导致细胞凋亡。BITKO等[15]研究发现,由呼吸道合胞病毒引起的A549人肺上皮细胞凋亡与Caspase-12活化及ERS有关。本实验通过免疫组织细胞化学检测法发现,低、中、高剂量棕榈酸上调细胞内Caspase-12表达水平。
研究结果表明,棕榈酸能抑制细胞增殖,增加Caspase-12蛋白表达,促进HSC凋亡。用棕榈酸干预可能为抗纤维化的治疗带来了新的提示。
[1]黄艳,黄成,李俊.肝纤维化病程中Kupffer细胞分泌的细胞因子对肝星状细胞活化增殖、凋亡的调控[J].中国药理学通报,2010,26(1):9-13.
[2]唐桂连.肝星状细胞与肝纤维化[J].国际消化病杂志,2012,32(5):270-273.
[3]ZHOU W C,ZHANG Q B,QIAO L.Pathogenesis of liver cirrhosis[J].World Journal of Gastroenterology,2014,20(23):7312-7324.[4]李卉.脂肪酸结合蛋白在棕榈酸诱导巨噬细胞凋亡中的作用和机制[D].长沙:中南大学,2012.
[5]辛莹.内质网应激介导棕榈酸诱导的成骨细胞凋亡[D].郑州:郑州大学,2015.
[6]NIELSON C M,MARSHALL L M,ADAMS A L,et al.BMI and fracture risk in older men:the osteoporotic fractures in men study(Mr OS)[J].J Bone Miner Res,2011,26(3):496-502.
[7]李喜艳,王加启,魏宏阳,等.MTT比色法检测赖氨酸、蛋氨酸对体外培养的奶牛乳腺上皮细胞增殖的影响[J].生物技术通报,2010,3(39):143-148.
[8]王铭,闫宇,李雅楠,等.衣霉素对转化生长因子β1的肝星状细胞增殖、凋亡及Caspase-9蛋白表达的影响[J].中国临床药理学杂志,2016,33(1):40-43.
[9]梁晓飞,王铭,肖永红.粉防己碱对小鼠肺成纤维细胞的凋亡及Caspase-3蛋白的影响[J].中国临床药理学杂志,2016,32(6):531-533.
[10]陈丹玲.ERp46在棕榈酸诱导的内质网应激中的保护作用及Exendin-4的干预研究[D].福州:福建医科大学,2012.
[11]PARKE J,LEE A Y,PARK S,et al.Multiple pathways are involved in palmitic acid-induced toxicity[J].Food and Chemical Toxicology,2014,67(5):26-34.
[12]LU J,WANG Q,HUANG L,et al.Palmitate causes endoplasmic reticulum stress and apoptosis in human mesenchymal stem cells:prevention by AMPK activator[J].Endocrinology,2012,153(11):5275-5284.
[13]ZHAO Y,TAN Y,XI S,et al.A novel mechanism by which SDF-1β protects cardiac cells from palmitate-induced endo plasmic reticulum stress and apoptosis via CXCR7 and AMPK/p38 MAPK-mediated interleukin-6 generation[J]. Diabetes,2013,62(7):2545-2558.
[14]SIMON-SZABÓL,KOKAS M,MANDLJ,et al.Metformin attenuatespalmitate-induced endoplasmic reticulum stress,serine phosphorylation of IRS-1 and apoptosis in rat insulinoma cells[J].PloS One,2014,9(6):e97868.
[15]NAKAGAWA T,ZHU H,MORISHIMA N,et al.Caspase-12 mediates ER_specific apoptosis and cytotoxicity by amyloid_β[J].Nature,2000,403(6765):98-103.
Effect of palmitic acid on caspase-12 and proliferation and apoptosis of hepatic stellate cells*
Ya-nan Li1,Yu Yan2,Ming Wang1,Fang Liu1,Yong-hong Xiao1
(1.College of Public Health,2.College of Clinical Medicine,North China University of Science and Technology;Tangshan,Hebei 063000,China)
ObjectiveTo investigate the effect of palmitic acid (PA)on caspase-12 and proliferation and apoptosis in rat hepatic stellate cells (HSCs)when stimulated by transforming growth factor-β1(TGF-β1).MethodsHSCs were randomly divided into five groups:Sham group,TGF-β1group,TGF-β1+low PA group,TGF-β1+middle PA group and TGF-β1+high PA group.HSCs were stimulated by TGF-β1(5 ng/ml)for 24 hours followed by co-incubation with PA under different doses(50,100,and 200 umol/L).No intervention was performed in Sham group.Cell proliferation was detected by MTT;morphological manifestations of cells were obtained by transmission electronmicroscope;apoptosis rate was determined by flow cytometry;expression levels of caspase-12 was measured by Immunohistochemistry.ResultsCellular proliferation was significantly inhibited with PA treatment in a dose dependent manner(P<0.05).Transmission electronmicroscope showed typical apoptotic features such as small nuclei,large numbers of mitochondria vacuoles and obvious edge sets of DNA.Treatment of PA dramatically increased apoptosis rate when compared with TGF-β1group[(7.26±0.46)%vs(1.70±0.14)%,P<0.05;(11.24±0.52)%vs(1.70±0.14)%,P<0.05;(15.55±0.31)%vs(1.70±0.14)%,P<0.05].Expression of caspase-12 protein increased significantly with PA in dose dependent manner (P<0.05).ConclusionPA inhibits cellular proliferation through promoting caspase-12 mediated apoptosis in HSCs.
hepatic stellate cell;palmitic acid;proliferation;apoptosis;caspase-12
R575.5
A
10.3969/j.issn.1005-8982.2017.30.003
1005-8982(2017)30-0015-06
2017-07-08
河北省自然科学基金资助项目(No:H2015209043)
肖永红,E-mail:kycxyh@tom.com;Tel:0315-8805226
(王荣兵 编辑)
