胃饥饿素对结肠癌细胞增殖和侵袭的影响及机制探讨
2017-12-27岳朝驰杨向东李俊陈小朝屈景辉
岳朝驰 ,杨向东 ,李俊 ,陈小朝 ,屈景辉
(1.西南医科大学附属医院 中医科,四川 泸州 646000;2.成都肛肠专科医院结直肠外科,四川 成都 610015)
临床研究·论著
胃饥饿素对结肠癌细胞增殖和侵袭的影响及机制探讨
岳朝驰 1,杨向东 2,李俊 1,陈小朝 2,屈景辉 2
(1.西南医科大学附属医院 中医科,四川 泸州 646000;2.成都肛肠专科医院结直肠外科,四川 成都 610015)
目的探讨胃饥饿素(Ghrelin)对结肠癌细胞增殖、侵袭的影响及作用机制。方法收集90例行手术切除的结肠癌(CRC)组织及癌旁组织,免疫组织化学染色检测组织Ghrelin表达,分析Ghrelin表达与结肠癌患者临床资料、生存预后的关系。按照转染类型将细胞分为3组:空白对照组(WT)、阴性对照组(NC)和sh-Ghrelin转染组。采用短发夹RNA(shRNA)技术抑制结肠癌HT29、SW480细胞Ghrelin表达,CCK-8法检测细胞增殖能力,流式细胞术检测细胞周期及早期凋亡的情况,划痕实验检测细胞迁移能力,Transwell实验检测细胞侵袭能力,Western blot检测磷脂酰肌醇 3- 激酶(PI3K)、蛋白激酶 B(Akt)、磷酸化蛋白激酶 B(p-Akt)、哺乳动物雷帕霉素靶蛋白(mTOR)、磷酸化哺乳动物雷帕霉素靶蛋白(p-mTOR)表达水平。结果结肠癌组织Ghrelin高表达率为64.4%(58/90),癌旁组织Ghrelin高表达率为27.8%(25/90),两者差异有统计学意义(χ2=24.347,P=0.001)。肿瘤直径≥5 cm组Ghrelin高表达率高于肿瘤直径<5 cm组,Ⅲ、Ⅳ期组Ghrelin高表达率高于Ⅰ、Ⅱ组,淋巴结转移组Ghrelin高表达率高于无淋巴结转移组,组间比较差异有统计学意义(P<0.05);Ghrelin表达与性别、年龄及肿瘤分级无关(P>0.05)。生存曲线分析显示,Ghrelin高表达组总生存期和无病生存率均低于Ghrelin低表达组(P<0.05)。在结肠癌HT29和SW480细胞中,sh-Ghrelin组细胞增殖能力低于NC组和WT组,处于S期比例、早期凋亡比例高于NC组和WT组(P<0.05)。处于G0/G1期比例低于NC组和WT组,差异有统计学意义(P<0.05)。sh-Ghrelin组细胞迁移距离、侵袭细胞数少于NC组和WT组(P<0.05)。Western blot检测结果显示,在HT29、SW480细胞中,sh-Ghrelin组PI3K、p-Akt及p-mTOR蛋白相对表达量低于NC组和WT组(P<0.05),NC组、WT组间PI3K、Akt、p-Akt、mTOR及p-mTOR蛋白相对表达量比较差异无统计学意义(P>0.05)。结论结肠癌组织Ghrelin表达上调,并与结肠癌患者生存预后有关。干扰Ghrelin表达能够抑制结肠癌细胞增殖、侵袭,其作用机制可能与抑制PI3K-Akt-mTOR信号通路有关。
胃饥饿素;结肠癌;增殖;细胞周期;侵袭;信号通路
结肠癌(colorectal cancer,CRC)是世界范围内常见的恶性肿瘤,居癌症相关死亡的第4位[1]。尽管结肠镜等腔镜技术的发展和普及有利于结肠癌早期发现,然而据世界卫生组织调查显示[2],全球每年结肠癌发病人口依然>100万,其中,60%的CRC患者确诊时已是中晚期。即使给予手术、放、化疗等,结肠癌患者远期生存依然不容乐观。因此了解结肠癌的发病机制具有重要的临床意义。胃饥饿素(Ghrelin)[3-4]是由胃合成和分泌的一种生长激素,在调控人体食欲、食物摄取及机体能量平衡方面发挥重要作用。近年来有研究报道[5-6],胃饥饿素对不同细胞的增殖和迁移有不同的影响,如胃饥饿素能够促进胰腺癌细胞的增殖,但对肺癌细胞则有抑制作用。也有报道称[7],饥饿素能促进肠道恶性肿瘤的发生和进展,结肠癌患者血清胃饥饿素水平高于正常人群,并且胃饥饿素水平与患者预后密切相关。但是关于胃饥饿素与结肠癌发病的关系及作用机制尚未见报道。鉴于此,本研究分别检测结肠癌组织和细胞胃饥饿素表达水平,并探讨不同胃饥饿素表达水平对结肠癌细胞增殖、侵袭的影响及作用机制,旨在为结肠癌的预防、治疗和诊断提供潜在的作用靶点。
1 资料与方法
1.1 样本收集
选取2010年4月-2011年4月本院收治的90例结肠癌患者。纳入标准:①入组前未接受任何抗癌治疗;②入院后拟行手术治疗;③术前签署知情同意书,并自愿捐献组织样本供本研究使用;④术后经病理学确诊。排除标准:合并其他恶性肿瘤、严重自身免疫性疾病及不宜或拒绝手术者。所有患者术中切除结肠癌组织及配对的癌旁组织(距癌组织切缘>5 cm),组织样本取出后分成两部分,一部分立即置于液氮中保存,另外一部分用10%甲醛固定用于免疫组织化学(免疫组化)染色。术后对患者进行电话随访或门诊复查,定义无病生存期(disease-free survival,DFS):从术后第2天开始至疾病复发、远处转移或因结肠癌死亡的时间;总生存期(overall survival,OS):从术后第2天开始至因任何原因引起死亡的时间。本研究随访截止时间2016年12月31日。本研究样本的采集、患者的治疗均得到医院伦理委员会的批准。
1.2 细胞来源
人结肠上皮细胞HIEC、人结肠癌细胞HT29及SW480均购自美国菌种保藏中心(美国弗吉尼亚州),所有细胞均接种于DMEM培养基(美国Thermo Fisher Scientific公司)。培养基含10%胎牛血清、100u/ml青霉素及100u/ml链霉素,在培养箱中37℃、5%二氧化碳CO2培养。每隔2天更换1次培养基,细胞融合达80%~90%时传代,选择传>3代细胞用于后续实验。
1.3 实验试剂
pGPU6/GFP/Neo-sh-Ghrelin表达载体(购自上海吉玛制药技术有限公司),短发夹RNA(shRNA)序列,正向引物:5'-GUAAUGAGGAGGGCUAUUA-3',反 向 引 物 :5'-CGU AUGCGCGUACUCUAAUTT-3'。Lipofectamine 2000TM购自(美国Invitrogen公司),Trizol试剂、RIPA裂解液(购自广州碧云天生物技术研究所),逆转录试剂盒、蛋白浓度检测试剂盒(购自美国Fermentas公司),CCK-8增殖活性测定试剂盒(购自长沙贝博生物科技有限公司),细胞周期检测试剂盒(购自北京雷根生物技术有限公司),Transwell小室、Matrigel人工基底膜(购自美国Sigma公司)。抗 Ghrelin(1∶100,武汉博士德生物公司)、抗磷脂酰肌醇3-激酶(phosphatidylinositol 3-hydroxy kinase,PI3K)(1∶50,上海生工生物工程有限公司)、抗哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)(1∶500,海门碧云天生物技术研究所)、抗磷酸化哺乳动物雷帕霉素靶蛋白(phosphorylation mTOR,p-mTOR)(phosphorylationAkt,p-Akt)(1∶200,海门碧云天生物技术研究所)、抗蛋白激酶 B(protein kinase B,Akt)(1∶100,上海生工生物工程有限公司)、抗磷酸化蛋白激酶B(phosphorylation Akt,p-Akt)(1∶100,上海生工生物工程有限公司)、抗β-actin(1∶200,武汉博士德生物公司),流式细胞仪(购自美国BD公司),PVDF膜、ECL化学发光试剂盒(购自美国Millipore公司)。
1.4 方法
1.4.1 免疫组化染色检测结肠癌组织Ghrelin表达将甲醛固定的结肠组织和癌旁组织常规石蜡包埋,制成5 μm的切片,脱蜡至水,加热修复抗原,加入H2O2消除内源性过氧化物酶。滴加2、3滴Ghrelin抗体,4℃孵育过夜。PBS冲洗3次,滴加1、2滴二抗,37℃孵育15 min,DAB显色液显色10 min,显微镜下观察图像。染色强度参考以下标准,0分:无染色,1分:弱阳性染色,2分:阳性染色,3分:强阳性染色。阳性细胞比例参考以下标准,1分:0~25%,2分:26%~75%,3分:76%~100%。每张切片随机选择5个视野,由2位病理科医师采用双盲法进行评价,若判定结果不一致,则由第3位医师做出最后判定。免疫染色评分(immunoreactive score,IRS)以染色强度和阳性细胞比例综合判定,两者相乘,IRS评分0~9分,其中0分为阴性,1~2分为低表达,3~9分为高表达。
1.4.2 细胞转染转染前24 h,将HT29和SW480铺于6孔板,细胞密度为1×106个/孔,加入培养基培养,待细胞达80%融合度,利用Lipofectamine 2000TM转染质粒。按照转染类型将细胞分为3组:空白对照组(WT)、阴性对照组(NC)和 sh-Ghrelin转染组,空白对照组加入等量Lipofectamine 2000TM试剂,阴性对照组加入阴性对照的质粒和Lipofectamine 2000TM试剂,sh-Ghrelin转染组加入sh-Ghrelin质粒和Lipofectamine 2000TM试剂。质粒和Lipofectamine 2000TM试剂按照1∶3比例进行配置,转染6 h后,再向每孔中加入300μl FBS,转染24h后更换为DMEM培养基,转染72h后采用实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)检测 Ghrelin mRNA表达以评价转染效率。
1.4.3 qRT-PCR检测Ghrelin mRNA表达取生长旺盛期细胞,弃去培养基,PBS冲洗3次,加入Trizol试剂,按照试剂说明书依次氯仿抽提、异丙醇沉淀、乙醇洗涤;将1 μg总RNA逆转录为cDNA,参考SYBR GREEN定量PCR说明书进行PCR反应,总反应体系30μl。反应条件:95℃预变性5min,95℃变性 5 s,60℃退火 30 s,72℃延伸 2 min,总计40个循环。Ghrelin正向引物:5'-GTTGGGTGTGATG GAGGGAAG-3',反向引物:5'-CCTTCTCAGTGGTGC AACTGTG-3';β-actin 正向引物:5'-CACCATTGGC AATGAGGGGTTC-3',反向引物:5'-AGGTCTTTGCG GATGTCCACGT-3'。定量分析结果以Ct值表示,以β-actin作为内参,2-△△Ct作为目的基因相对表达量。
1.4.4 CCK-8法检测细胞增殖活性将细胞铺于96孔板中(2×103个/孔),同时设置试剂空白对照孔和细胞空白对照空,孵育24 h后于每孔中加入预先配置好的CCK-8试剂(10 μl/孔),37℃继续孵育,于450 nm处检测吸光度值,并以标准曲线读出样品的光密度值(OD)。
1.4.5 流式细胞术检测细胞生长周期细胞铺于6孔板中(1×106个/孔),继续培养24 h,收集贴壁细胞,加入75%乙醇固定,4℃过夜;第2天弃去固定液,加入RNA酶以消除RNA的干扰;再加入PI染液(10 μl),上机检测,每次实验操作3次,取平均值。
1.4.6 流式细胞术检测细胞凋亡将细胞铺于6孔板中(1×106个/孔),继续培养24 h,收集贴壁细胞,依次加入 Annexin V(400μl)和 Annexin V-FITC(5 μl)染液,避光孵育 15 min,再加入 PI染液(10 μl),上机检测,每次实验操作3次,取平均值。
1.4.7 Transwell小室法检测细胞侵袭能力用不含血清的培养基将转染后细胞浓度调整为1.0×105个/ml,Transwell上室每孔接种150 μl细胞,下室加入600 μl含有20%胎牛血清的RPMI 1640培养基作为趋化剂,37℃培养48 h,轻轻拭去表面非侵袭性细胞,4%多聚甲醛固定,结晶紫染色10 min,显微镜下统计穿透滤膜的细胞数。
1.4.8 划痕实验检测细胞迁移能力将细胞接种于6孔板,Marker笔在培养板后均匀划间距为0.5 cm的横线,每孔中铺1×105个细胞,细胞融合度≥80%时用无菌用移液枪枪头在单层细胞沿底部划出“一”字划痕,PBS冲洗3次后,培养24 h后在显微镜下测量划痕愈合的宽度。
1.4.9 Western blot检测 PI3K、Akt、p-Akt、mTOR及p-mTOR蛋白表达取对数生长期细胞,弃去培养液,PBS冲洗,加入离心管中,再加入1 ml RIPA裂解液置于冰浴上裂解30 min,4℃条件下离心15 min,BCA蛋白浓度试剂盒检测蛋白纯度。将20 μg蛋白提取液置于10%SDS-PAGE电泳分离,常规湿法转膜,加入5%脱脂牛奶孵育封闭2 h。分别加入PI3K、Akt、p-Akt、mTOR 及 p-mTOR 抗体,4℃孵育 24 h。再滴加二抗37℃孵育2 h。PBS冲洗3次,按照ECL化学发光显影试剂盒显影,以β-actin作为内参照,分析目的条带相对表达量。
1.5 统计学方法
数据分析采用SPSS 19.0统计软件,计量资料以均数±标准差(±s)表示,组间比较采用方差分析,两两比较用SNK-q检验,计数资料以构成比(%)表示,分析用χ2检验,Kaplan-Meier法绘制ROC曲线,比较用Log-rank χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 Ghrelin在肺癌组织中表达
免疫组化染色结果显示,Ghrelin蛋白主要位于细胞浆和细胞质,出现棕色颗粒为阳性细胞(见图1)。结肠癌组织Ghrelin高表达率为64.4%(58/90),癌旁组织Ghrelin高表达率为27.8%(25/90),结肠癌组织Ghrelin高表达率高于癌旁组织(χ2=24.347,P=0.001)。
2.2 Ghrelin表达与结肠癌患者临床资料及生存预后的关系
Ghrelin表达与肿瘤大小、TNM分期及淋巴结转移有关,肿瘤直径≥5 cm组Ghrelin高表达率高于肿瘤直径<5 cm组,Ⅲ、Ⅳ期组Ghrelin高表达率高于Ⅰ、Ⅱ组,淋巴结转移组Ghrelin高表达率高于无淋巴结转移组,组间比较差异有统计学意义(P<0.05);Ghrelin表达与性别、年龄及肿瘤分级无关(P>0.05)(见附表)。90例结肠癌患者共计有82例获得完整随访,其中,低表达随访30例,高表达随访52例。生存曲线分析显示,Ghrelin高表达总生存期和无病生存率均低于Ghrelin低表达(χ2=4.983和4.001,P=0.034和0.043)。见图2。
2.3 靶向Ghrelin shRNA抑制目的基因mRNA的表达
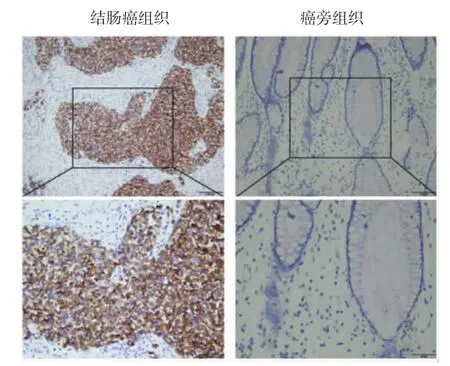
图1 结肠癌和癌旁组织Ghrelin表达 (免疫组化)
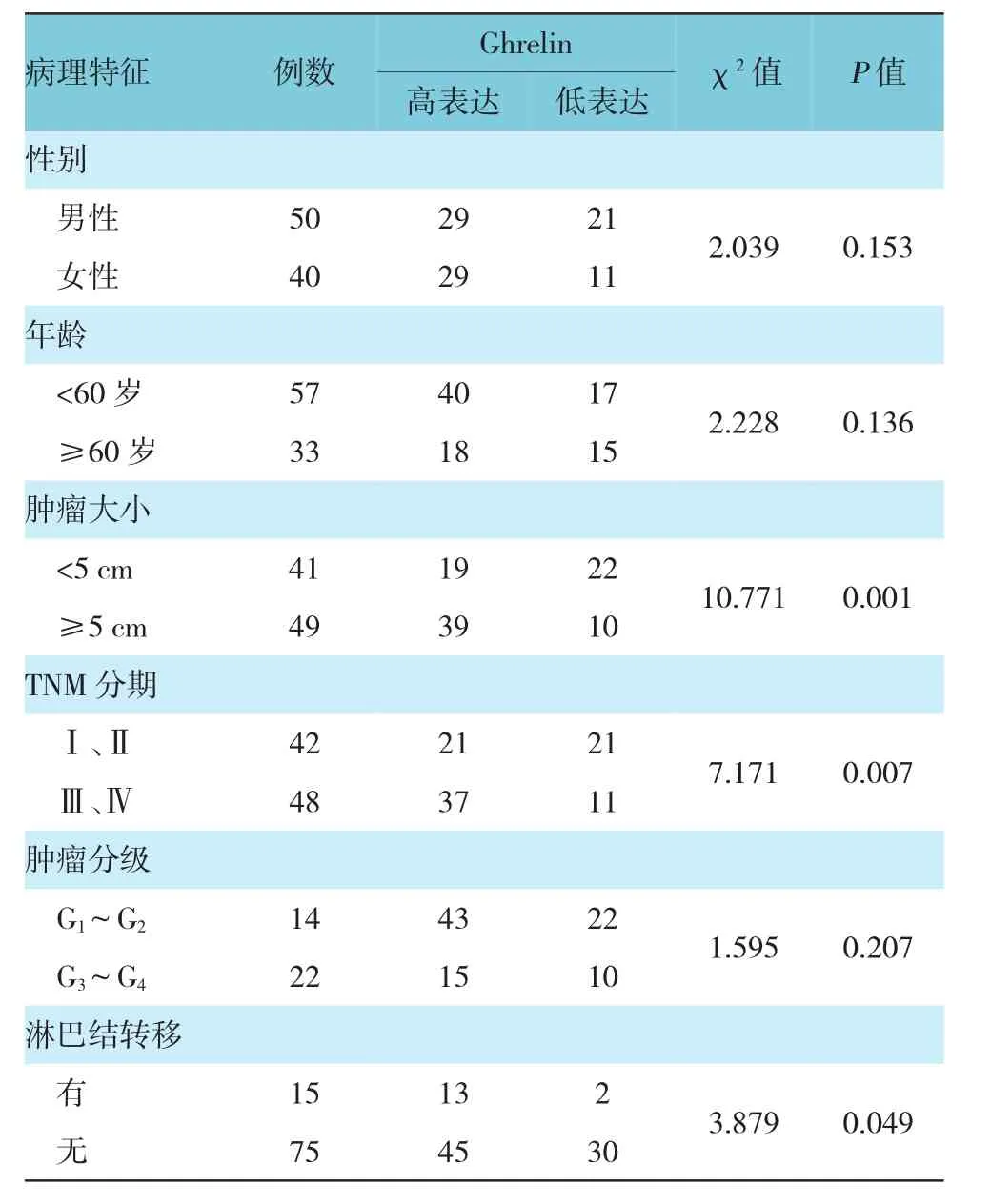
附表 Ghrelin表达与结肠癌患者临床资料的关系
HIEC、HT29及SW480细胞Ghrelin mRNA相对表达量比较差异有统计学意义(F=7.210,P=0.000)。HT29、SW480细胞Ghrelin mRNA相对表达量高于HIEC 细胞(P<0.05),HT29、SW480细胞间 Ghrelin mRNA相对表达量比较差异无统计学意义(P>0.05)(见图3A)。NC、WT及sh-Ghrelin组HT29细胞和SW480细胞的Ghrelin mRNA相对表达量比较差异有统计学意义(F=5.431和6.193,P=0.014和0.000),sh-Ghrelin组HT29和SW480细胞的Ghrelin mRNA相对表达量低于WT组和NC组(P<0.05)(见图 3B、C)。NC、WT及 sh-Ghrelin组 HT29细胞和SW480细胞的Ghrelin蛋白相对表达量比较差异有统计学意义(F=4.037和5.172,P=0.031和0.025),sh-Ghrelin组HT29和SW480细胞的Ghrelin蛋白相对表达量低于WT组和NC组(P<0.05)(见图3D、E),证实sh-RNA转染成功。

图2 Ghrelin表达与结肠癌患者生存预后的关系
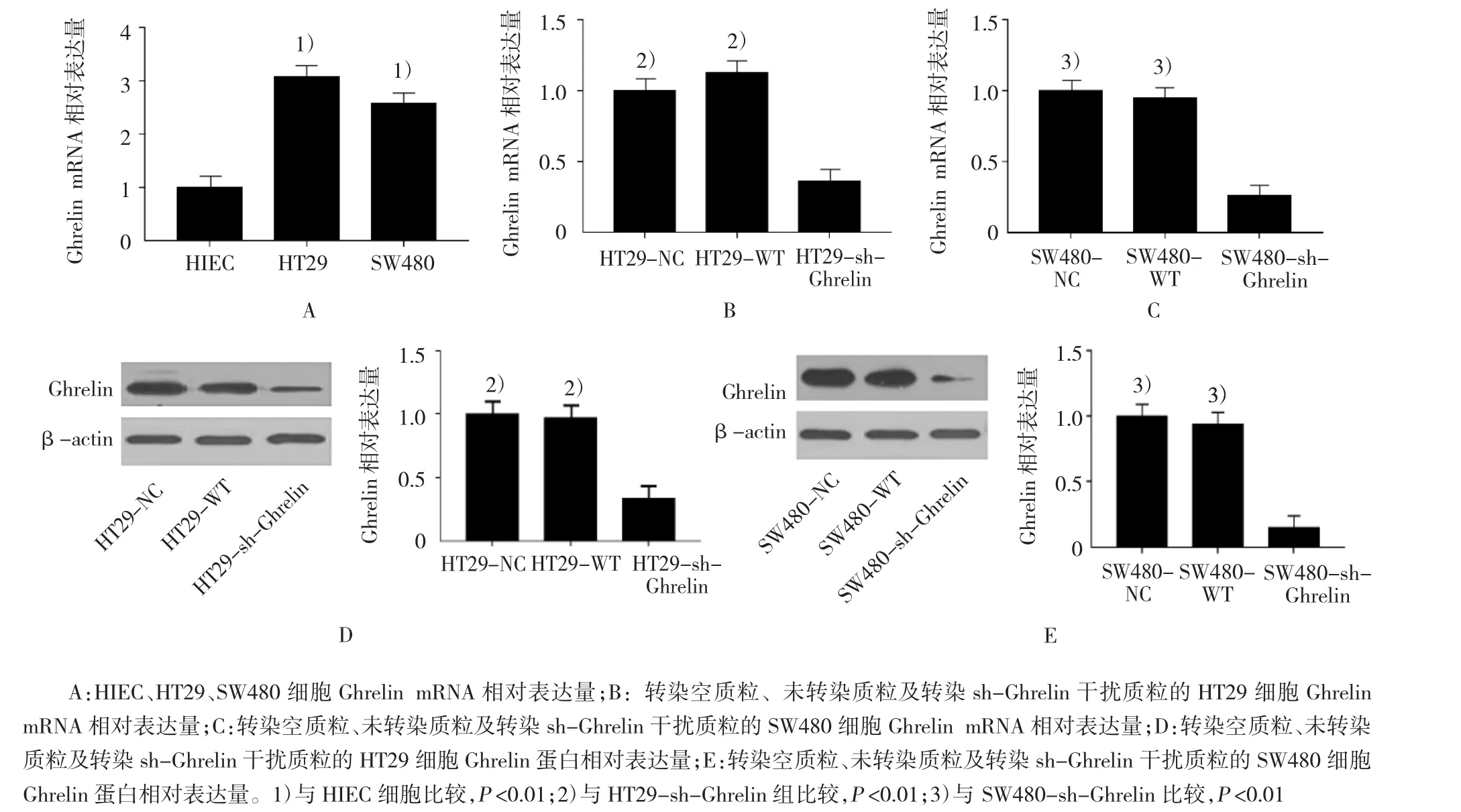
图3 各组细胞Ghrelin mRNA表达水平
2.4 靶向Ghrelin shRNA抑制结肠癌细胞的增殖
对HT29和SW480细胞的CCK-8检测结果显示,从培养的24~120 h,NC组和WT组细胞增殖能力比较差异无统计学意义(P>0.05);从48~120 h,sh-Ghrelin组细胞增殖能力低于NC组和WT组(P<0.05)(见图4A、B)。细胞周期检测结果显示,在HT29和SW480细胞中,sh-Ghrelin组细胞处于S期的比例高于 NC 组和 WT 组(FHT29=18.043,PHT29=0.000;FSW480=19.247,PSW480=0.000),而 NC 组、WT 组间比较差异无统计学意义(P>0.05)。见图4C、D。
2.5 靶向Ghrelin shRNA促进结肠癌细胞凋亡
利用流式细胞仪检测细胞早期凋亡情况,结果显示NC、WT及sh-Ghrelin组HT29和SW480细胞早期凋亡比例比较,差异有统计学意义(F=14.910和12.943,均P=0.000),在HT29和SW480细胞中,sh-Ghrelin组细胞早期凋亡比例高于NC组和WT组(P<0.05),NC组、WT组间细胞早期凋亡比例比较差异无统计学意义(P>0.05)。见图5。
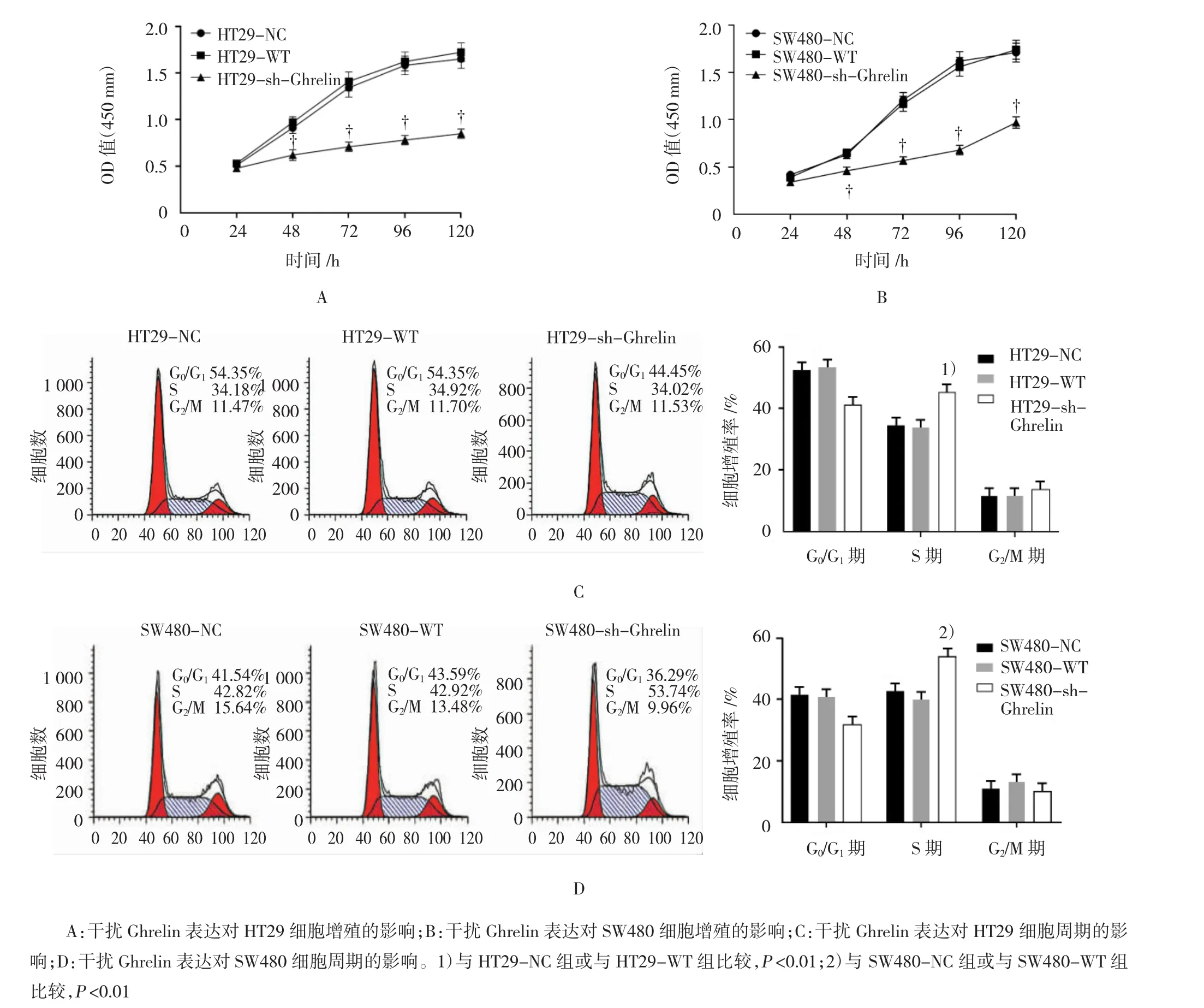
图4 各组细胞周期和增殖
2.6 靶向Ghrelin shRNA抑制结肠癌细胞侵袭和迁移
划痕实验显示,NC、WT及sh-Ghrelin组HT29、SW480细胞的迁移距离比较差异有统计学意义(F=75.016 和 72.940,均P=0.000),HT29、SW480 细胞中,sh-Ghrelin组细胞迁移距离少于NC组和WT组(P<0.05),NC组、WT组间细胞迁移距离比较差异无统计学意义(P>0.05)(见图 6A、B)。Transwell小室实验结果显示,NC、WT及 sh-Ghrelin组HT29、SW480细胞的侵袭细胞数比较差异有统计学意义(F=25.401 和 20.745,均P=0.000),HT29、SW480 细胞中,sh-Ghrelin组侵袭细胞数少于NC组和WT组(P<0.05),NC组、WT组间侵袭细胞数比较差异无统计学意义(P>0.05)。见图6。
2.7 靶向Ghrelin shRNA抑制PI3K-Akt-mTOR信号通路
Western blot检测结果显示,NC、WT及sh-Ghrelin组HT29细胞中PI3K、p-Akt以及p-mTOR蛋白相对表达量比较差异有统计学意义(FPI3K=7.641,PPI3K=0.001;Fp-Akt=6.218,Pp-Akt=0.000;Fp-mTOR=4.732,Pp-mTOR=0.002),NC、WT 及 sh-Ghrelin组SW480细胞中PI3K、p-Akt及p-mTOR蛋白相对表达量比较差异有统计学意义(FPI3K=6.590,PPI3K=0.000;Fp-Akt=7.321,Pp-Akt=0.000;Fp-mTOR=5.470,Pp-mTOR=0.011), 在 HT29、SW480 细胞中,sh-Ghrelin 组 PI3K、p-Akt、p-mTOR蛋白相对表达量低于NC组和WT组(P<0.05),NC组、WT 组间 PI3K、Akt、p-Akt、mTOR 及 p-mTOR 蛋白相对表达量比较差异无统计学意义(P>0.05)。见图7。

图5 各组细胞凋亡的影响
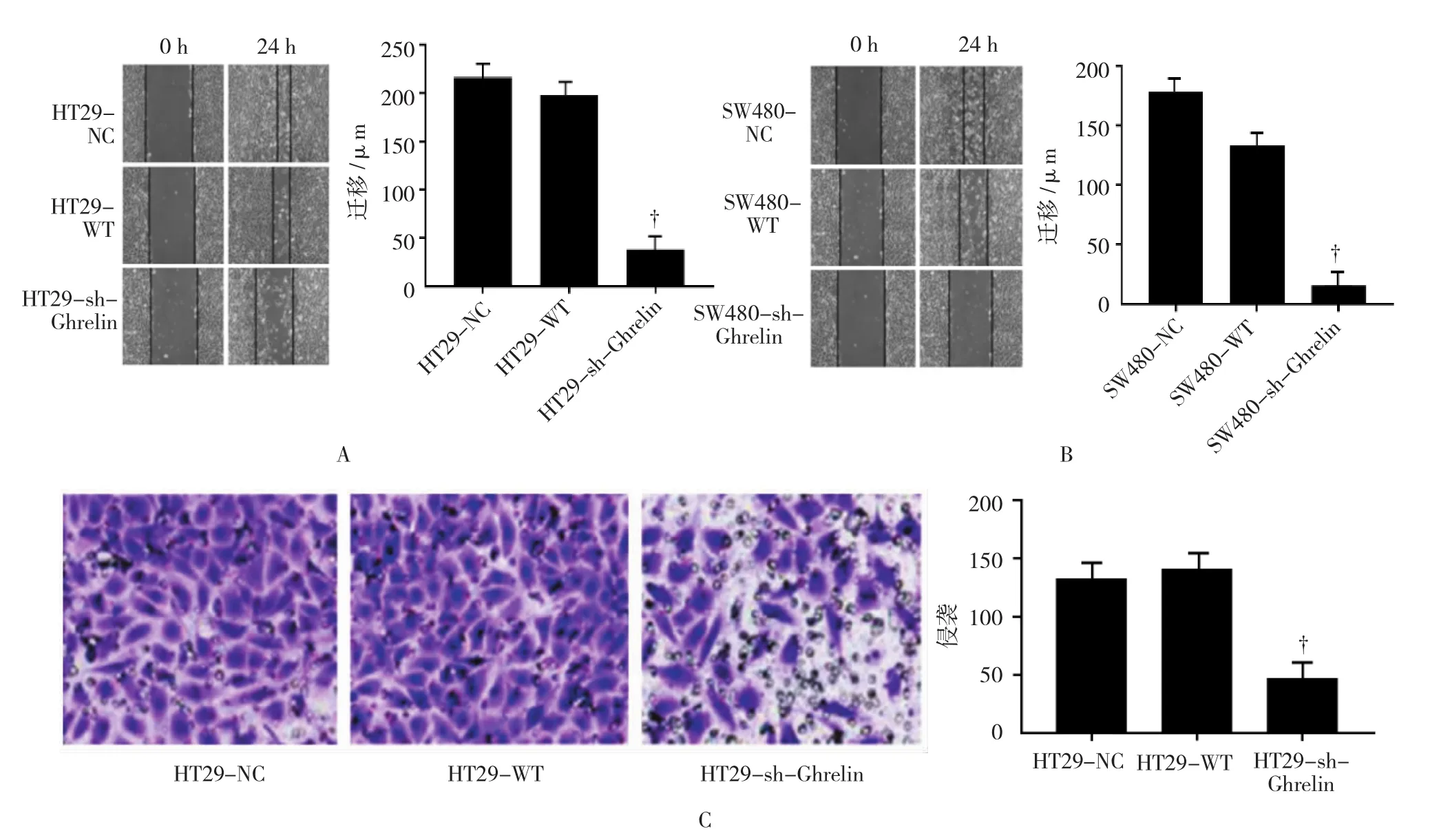

图6 各组细胞迁移、侵袭能力
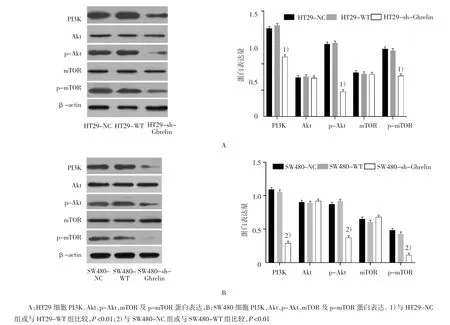
图7 干扰Ghrelin表达对PI3K-Akt-mTOR信号通路相关蛋白的影响
3 讨论
胃饥饿素是由胃黏膜细胞分泌的一种活性多肽,已被证实与迷走神经的兴奋性有关。胃饥饿素与内源性受体结合,刺激下丘脑摄食中枢,使食欲增加和减少脂肪分解。有研究发现[8],胃饥饿素能够维持葡萄糖稳态,在糖尿病及其并发症的治疗中展现潜在的价值。近年来大量研究指出,胃饥饿素在肿瘤的发生、进展方面发挥一定作用。杜成雄[9]报道,终末期、分化程度低的直肠癌患者血清胃饥饿素升高。TAKIGUCHI等[10]也证实,组织胃饥饿素表达水平与胃癌的浸润深度、分化类型及TNM分期密切相关。本研究显示,结肠癌组织Ghrelin高表达率高于癌旁组织,Ghrelin表达水平与结肠癌瘤体大小、TNM分期及淋巴结转移有关,提示胃饥饿素在结肠癌中可能起到类似癌基因的作用。TAKIGUCHI等[11]对行根治性远端胃切除术的胃癌患者进行随访观察,结果发现胃饥饿素可以使患者胃排空延迟,并导致术后化疗相关恶心呕吐;血浆胃饥饿素水平越高,患者3年生存率越低。本研究对结肠癌患者术后进行规律随访,结果发现Ghrelin高表达组总生存期和无病生存率均低于Ghrelin低表达组,提示胃饥饿素亦可以作为评价结肠癌预后生存的指标之一。
为进一步探讨Ghrelin对结肠癌生物学行为的影响及作用机制,本研究采用shRNA技术干扰人结肠癌细胞HT29和SW480中Ghrelin的表达,结果显示HT29、SW480细胞Ghrelin mRNA相对表达量高于HIEC细胞,说明结肠癌细胞Ghrelin高表达,Ghrelin可能是结肠细胞恶性病变的标志物。干扰HT29、SW480细胞 Ghrelin表达,sh-Ghrelin组细胞增殖能力低于阴性对照组(NC组)和野生组(WT组),说明敲除Ghrelin基因能够抑制结肠癌细胞的增殖能力。李振远等[12]报道,Ghrelin参与维持核糖体的正常功能,并促进DNA的复制和相关蛋白的合成,这也是肿瘤发生、发展的重要过程。抑制Ghrelin的表达,肿瘤细胞正常功能蛋白合成受阻,增殖功能也受到影响。细胞的增殖与分裂周期密切相关,本研究进一步发现抑制Ghrelin表达能够引起细胞分裂阻滞S期,从而抑制结肠癌细胞的生长。有研究显示[13],Ghrelin能够促进细胞周期相关基因的表达和Cyclins-CDKs复合物功能,使DNA合成加速并诱导瘤体生长。也有学者认为[14],特异性沉默Ghrelin基因,能够序贯性降低下游Cyclin D1基因的表达,导致调控细胞S周期转变“检查点”功能失调,细胞被特异性阻滞S周期。限本研究的设计方案,尚未深入探讨Ghrelin对细胞周期阻滞的具体机制。
细胞凋亡是真核生物最重要的生长调控机制,也是影响细胞增殖速度的主要因素。细胞凋亡由一系列凋亡途径所介导,细胞的凋亡增加,必然引起细胞增殖能力减弱。国外研究显示[15],抑制Ghrelin能够下调凋亡抑制基因Bcl-2和p53,并激活凋亡因子Caspase家族成员(Caspase-3、Caspase-9),导致细胞凋亡加速。本研究利用流式细胞术检测结肠癌细胞凋亡情况,结果显示,抑制Ghrelin可以提高结肠癌细胞早期凋亡比例。但需要注意的是,对绝大多数结肠癌细胞,p53在早期已经发生突变,理论上无法参与后续的凋亡信号途径,因此Ghrelin所介导的促凋亡效应可能与其他机制有关。有研究报道称[16],胃癌细胞发生EMT时,TGF-β能够促进Ghrelin表达,而Ghrelin过表达又能反过来刺激TGF-β表达增加,使细胞获得侵袭、迁移的能力。本研究也发现,HT29、SW480细胞中,sh-Ghrelin组侵袭细胞数、细胞迁移距离低于NC组和WT组,说明抑制Ghrelin可以阻断结肠癌细胞侵袭、迁移等生物学行为。但是本研究尚无法证实侵袭、迁移的抑制是否与阻断EMT有关。
PI3K-Akt-mTOR信号通路是调控肿瘤发生、发展的重要生物学信号转导通路[17-18],包括细胞周期调控、血管新生、基因的转录及翻译等。激活磷脂肌醇3-激酶可以诱导蛋白激酶B(Akt)磷酸化,活化的Akt又将信号传递至下游底物雷帕霉素靶体蛋白,并控制诸如凋亡、转录及翻译等生物学效应。研究显示[19],丝苏氨酸激酶抑制剂能够抑制PI3K-AktmTOR通路,阻断结肠癌细胞增殖和侵袭等行为。PARK等[20]也证实,PI3K-Akt-mTOR信号通路激活程度可以作为结肠癌患者预后的重要指标。本研究显示,结肠癌HT29、SW480细胞中,sh-Ghrelin组PI3K、p-Akt及p-mTOR蛋白相对表达量低于NC组和WT组,说明抑制Ghrelin表达能够阻断PI3KAkt-mTOR信号通路,并抑制细胞的增殖和侵袭。上述研究结果也说明Ghrelin可能是通过PI3K-AktmTOR信号通路调控结肠癌细胞增殖和侵袭等生物学行为。
综上所述,结肠癌组织Ghrelin表达上调,并与结肠癌患者生存预后有关。干扰Ghrelin表达能够抑制结肠癌细胞增殖、侵袭,其作用机制可能与抑制PI3K-Akt-mTOR信号通路有关。
[1]DAMANIA D,SUBRAMANIAN H,BACKMAN V,et al.Network signatures of nuclear and cytoplasmic density alterations in a model of pre and postmetastatic colorectal cancer[J].J Biomed Opt,2014,19(1):16016.
[2]POTTER M B.Strategies and resources to address colorectal cancer screening rates and disparities in the United States and globally[J].Annu Rev Public Health,2013,34(1):413-429.
[3]KASACKA I,ARCISZEWSKI M,ŁEBKOWSKI W.Extraordinary level of hormone and number of ghrelin cells in the stomach and duodenum of an obese woman[J].Acta Histochem,2014,116(1):230-234.
[4]高寅生,侯亚勃,杨晓军,等.胃饥饿素/肽YY/刺鼠相关蛋白信号在胃旁路手术治疗2型糖尿病中的作用[J].中华实验外科杂志,2016,33(5):1247-1249.
[5]EOM J,HONG M,CONE R D,et al.Zebrafish ghrelin is expressed in pancreatic endocrine cells and regulated by metabolic state[J].Biochem Biophys Res Commun,2013,439(1):115-120.
[6]NORTHRUP R,KURODA K,DUUS E M,et al.Effect of ghrelin and anamorelin(ONO-7643),a selective ghrelin receptor agonist,on tumor growth in a lung cancer mouse xenograft model[J].Support Care Cancer,2013,21(9):2409-2415.
[7]毕建成,田伟,王国文,等.结肠癌患者血清脂联素和胃饥饿素水平的临床分析[J].标记免疫分析与临床,2015,22(4):291-293.
[8]LIU B W,LU Q,MA C M,et al.The study of soluble intercellular adhesion molecule-1 and ghrelin in adolescents with family history of type 2 diabetes[J].Endocrine,2012,42(3):599-605.
[9]杜成雄.两种手术方式直肠癌术后应激反应期胃饥饿素的动态变化及其临床意义[J].中国普通外科杂志,2014,23(10):1440-1443.
[10]TAKIGUCHI S,TAKATA A,MURAKAMI K,et al.Clinical application of ghrelin administration for gastric cancer patients undergoing gastrectomy[J].Gastric Cancer,2014,17(2):200-205.
[11]TAKIGUCHI S,HIURA Y,TAKAHASHI T,et al.Effect of rikkunshito,a Japanese herbalmedicine,on gastrointestinal symptoms and ghrelin levels in gastric cancer patients after gastrectomy[J].Gastric Cancer,2013,16(2):167-174.
[12]李振远,李方方,张勇,等.胃饥饿素:生物学特征及对动物采食量的调控[J].动物营养学报,2016,28(1):35-42.
[13]WASEEM T,DUXBURY M,ASHLEY S W,et al.Ghrelin promotes intestinal epithelial cell proliferation through PI3K/Akt pathway and EGFR trans-activation both converging to ERK 1/2 phosphorylation[J].Peptides,2014,52(50):113-121.
[14]LEE J H,PATEL K,TAE H J,et al.Ghrelin augments murine T-cell proliferation by activation of the phosphatidylinositol-3-kinase,extracellular signal-regulated kinase and protein kinase C signaling pathways[J].FEBS Lett,2014,588(24):4708-4719.
[15]ZHU J,ZHENG C,CHEN J,et al.Ghrelin protects human umbilical vein endothelial cells against high glucose-induced apoptosis via mTOR/P70S6K signaling pathway[J].Peptides,2014,52(2):23-28.
[16]RODRÍGUEZ A,GÓMEZ-AMBROSI J,CATALáN V,et al.The ghrelin O-Acyltransferase-Ghrelin system reduces TNF-α-Induced apoptosis and autophagy in human visceral adipocytes[J].Diabetologia,2012,55(11):3038-3050.
[17]郭琳,王强.PI3K/Akt/mTOR信号传导通路与恶性肿瘤浸润和转移的研究进展[J].现代肿瘤医学,2009,17(8):1585-1589.
[18]周笑,杨鹏,于雁,等.PI3K/Akt/mTOR信号转导通路与肿瘤[J].国际免疫学杂志,2016,39(3):280-284.
[19]ZHANG X,SHI H,TANG H,et al.MiR-218 inhibits the invasion and migration of colon cancer cells by targeting the PI3K/Akt/mTOR signaling pathway[J].Int J Mol Med,2015,35(5):1301-1308.
[20]PARK J H,KIM J J,BAE Y S.Involvement of PI3K-Akt-mTOR pathway in protein kinase CKII inhibition-mediated senescence in human colon cancer cells[J].Biochem Biophys Res Commun,2013,433(4):420-425.
Regulation of Ghrelin in proliferation and invasion of colon carcinoma
Chao-chi Yue1,Xiang-dong Yang2,Jun Li1,Xiao-zhao Chen2,Jun-hui Qu2
(1.Department of Traditional Chinese Medicine,Affiliated Hospital of Southwest Medical University,Luzhou,Sichuan 646000,China;2.Department of Colorectal Surgery,the Anorectal Specialist Hospital of Chengdu,Chengdu,Sichuan 610015,China)
ObjectiveTo investigate the effect of Ghrelin on cellular proliferation and invasion of colon carcinoma and potential mechanisms.MethodsA total of 90 patients diagnosed with colon carcinoma were included in this study,and cancer as well as paracancerous normal tissue was collected.Expression of Ghrelin wasmeasured by Immunohistochemicalstaining assay;Co-relationship analysisbetween ghrelin expression and clinical manifestation of patients including survival rate was performed.Expression of Ghrelin in colon carcinoma cell line HT29 and SW480 was genetically inhibited by short hairpin RNA (shRNA).Cellular proliferation,cell cycle as well as apoptosis,migration,and cell invasion were determined by CCK-8 assay,Flow cytometry,Wound heal assay,and Transwell assay,respectively.Expression levels of PI3K,Akt,p-Akt,mTOR,p-mTOR protein were measured by Western blot.ResultsExpression of Ghrelin in cancer tissue,group with tumor diameter≥5 cm,and group with tumor underⅢ~Ⅳ phase was upregulated when compared with that in paracancerous tissue,group with tumor diameter<5 cm group,group with tumor under metastasis-free phase,respectively (P<0.05).No correlation between Ghrelin expression and gender,age and tumor grade respectively was observed (P>0.05).Overall survival and disease-free survival in group with highly expressed Ghrelin was significantly lower than that in group with lowly expressed Ghrelin (P<0.05).Proliferation,migration and invasion capacity of HT29 and SW480 cells decreased while ratio of cells in S phase and early apoptosis increased significantly in sh-Ghrelin group when compared with those in NC group and WT group(P<0.05).In HT29 and SW480 cells expression levels of PI3K,p-Akt,p-mTOR protein were dramatically down-regulated in sh-Ghrelin group when compared with those in NC group and WT group (P<0.05).No statistical difference in the expression of PI3K,Akt,p-Akt,mTOR,p-mTOR protein in NC group and WT group was observed (P>0.05).ConclusionsThe expression of Ghrelin is up-regulated in colon carcinoma tissue,which is closely associated with disease prognosis.Beneficial effect of Ghrelin is potentially mediated through inhibition of PI3K-Akt-mTOR signaling pathway.
Ghrelin;colon carcinoma;proliferation;cell cycle;invasion;signaling pathway
R735.35
A
10.3969/j.issn.1005-8982.2017.30.005
1005-8982(2017)30-0026-10
2017-05-04
(王荣兵 编辑)
