不典型脱屑性间质性肺炎一例
2017-12-27史鹏安东善付奎升王树岐孙伟红
史鹏 安东善 付奎升 王树岐 孙伟红
·病例报告·
不典型脱屑性间质性肺炎一例
史鹏 安东善 付奎升 王树岐 孙伟红
间质性肺疾病; 脱屑性间质性肺炎; 体层摄影术
脱屑性间质性肺炎(desquamative interstitial Pneumonia, DIP)是一种少见的特发性间质性肺炎,发病率相对较低,仅占10%~17%[1],其与吸烟相关,国内外相关报道较少。现将我们在临床中遇到的一例CT表现类似肺炎的脱屑性间质性肺炎报告如下。
临床资料
患者,男性,70岁,病史40 d,以干咳、气短为主要临床表现。2016年2月5日在门诊行肺部CT,检查诊断为“肺炎”,见图1。未行病原学检查。在当地诊所静点抗生素(具体不详),症状加重,咳嗽、咳痰增多,为大量黄白色黏痰,发热,体温最高达38.8 ℃,活动后气短明显,夜间呼吸困难,不能平卧,伴胸痛。2016年2月17日入住当地医院,肺CT示右肺上叶、中叶、下叶多发片状密度增高影,病灶见支气管通气征,右侧少量弧形密度影,诊断为"肺炎",见图2。临床用药左氧氟沙星、哌拉西林、氟康唑,患者气短减轻。3月5日患者再次出现发热,体温最高达37.8 ℃,夜间发热,白天体温正常,持续6 d。3月10日痰培养结果为肺炎克雷伯菌 ESBL(+)、产气肠杆菌、铜绿假单胞菌。3月15日转入我院。近40 d体重减轻10 kg。
既往史: 吸烟史约58年,每日60支,戒烟6年。退休10年,无特殊粉尘接触史。磺胺类药物过敏史。否认肝炎、结核等传染病病史。否认食物过敏史。近期无旅游病史。为布氏菌疫区。无饮酒史。否认家族遗传病病史。
入院查体:体温:36.4 ℃,脉搏:84次/min,呼吸: 20次/min,血压:130/70 mmHg,一般尚状态尚可,步入病房。呼吸略促,口唇无发绀,右肺叩诊实音,听诊右肺呼吸音减弱,右下肺可闻及广泛的干湿啰音,无胸膜摩擦音。肺部CT(3月2日)示病灶无明显吸收,见图3。布鲁氏杆菌抗体IgG 阴性;血常规:白细胞5.42×109/L,中性粒细胞比率49.00%,中性粒细胞数2.66×109/L,红细胞2.99×1012/L、血红蛋白88 g/L。血气分析:pH 7.40、PCO235 mmHg、PO254 mmHg、SaO288%、HCO3-21.7 mmol/L。传染病综合抗体(甲肝、乙肝、丙肝、艾滋病、梅毒):阴性。特殊细菌涂片检查:偶见革兰阳性球菌。
初步诊断为"肺炎、Ⅰ型呼吸衰竭、贫血(中度)"。根据入院前痰培养结果,选择美罗培南2.0,每8 h 1次静点。用药第6天,体温升高达37.5 ℃,此后体温37.1 ℃~37.5 ℃之间。逐渐出现气短,活动后明显加重,伴右侧胸痛、夜间多汗。查体:呼吸平稳(吸氧2 L/min),口唇无发绀,右肺语音震颤增强,叩诊呈实音,听诊呼吸音弱,可闻及散在的湿啰音,右下肺呼吸音消失。3月25日肺部CT,左肺上叶及右肺见多发片状高密度影,右肺病灶见含气支气管影。左肺下叶见多发微结节高密度影,直径约3 mm,右侧胸腔可见大量弧形液体密度影。双肺小叶间隔可见增厚。纵膈内可见多发肿大淋巴结影,见图4。10 d的抗感染治疗,无效。重新评估病情,提检感染相关检查:病毒检测、真菌葡聚糖试验、GM试验,结核菌T-SPOT试验,多次的痰培养和痰涂片(包括细菌、真菌、结核菌)。非感染相关检查:抗核抗体系列、抗0、类风湿因子、抗中性粒细胞胞浆抗体、自身抗体、免疫球蛋白。其中IgG 1 870 mg/dl(正常值:751~1 560)、IgA 502 mg/dl(正常值:82~453)、IgE 362 IU/ml(正常值:0~165),C-反应蛋白(C-reactive protein, CRP) 7.65 mg/dl(正常值:0~0.8)。其余检测均为阴性。排除感染性疾病。支气管镜下针吸活检(bronchos copic transbronchial needle aspiration, TBNA),病理结果无诊断意义。未行肺泡灌洗,无法明确细胞分类。征求患者同意,再行经皮肺穿刺,病理见肺泡均实变,其内充满增生的肺泡上皮,大量的巨噬细胞、间质纤维组织增生,肺泡间隔增宽不明显,并散在淋巴浆细胞浸润,见图5。根据病理,诊断为DIP。给予激素治疗,甲强龙40 mg/d,静点,共11 d。4月10日,肺部CT,右肺上叶、中叶、下叶可见磨玻璃影,片状实变影明显减少,胸腔积液吸收,疗效明显,见图6。
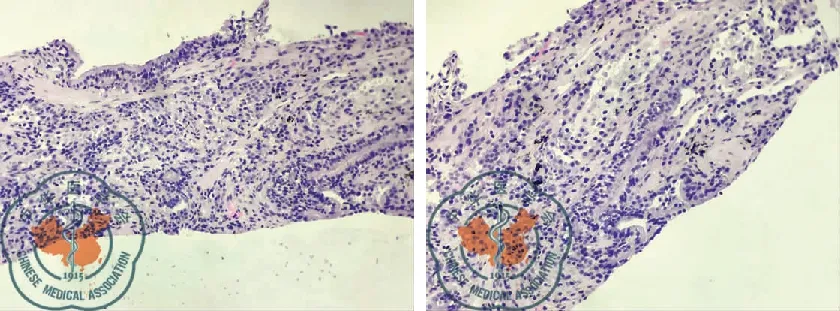
图5 肺穿刺组织病理片(HE×40)
讨 论
DIP是一种较少见的间质性肺病之一,属于吸烟相关性间质性肺病。DIP是首先由Liebow在1965年提出[2]。1978年,Carrington进一步确定了这个概念[3]。DIP的病理特征为肺泡内聚集大量的巨噬细胞,多数巨噬细胞带有棕色色素颗粒,被称为“吸烟者的巨噬细胞”。肺泡壁增厚伴有间质的炎症,有的可见淋巴细胞和嗜酸性粒细胞[4]。本病的病原尚不明确,多数认为与吸烟有关,但HCV感染、结缔组织病(类风湿关节炎、系统性红斑狼疮)、吸食毒品、吸入粉尘(如矽尘、石棉、滑石粉、碳化钨等尘埃)、吸入燃料的塑料气味、使用特殊发水、服用呋喃坦啶等也可诱发此病[5-7]。
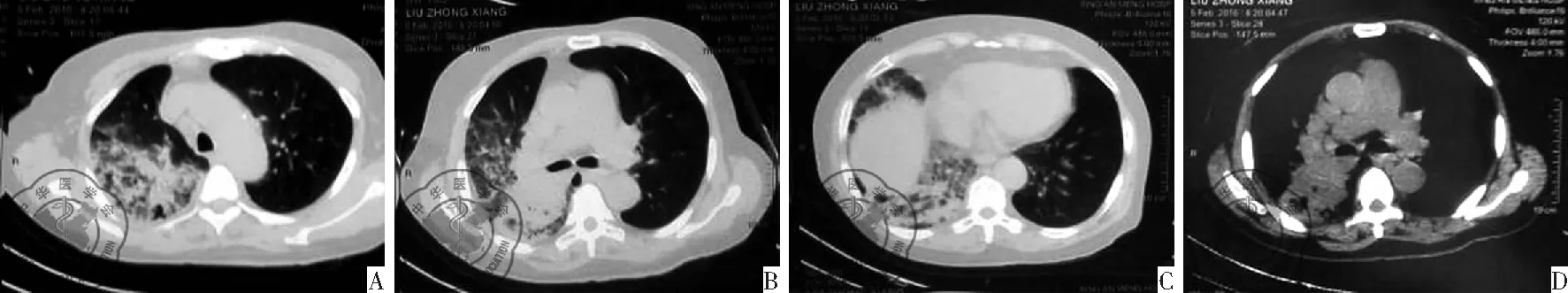
图1 2016年2月5日肺CT图

图2 2016年2月17日肺CT图
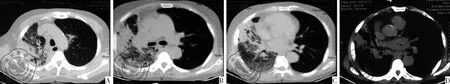
图3 2016年3月2日肺CT图
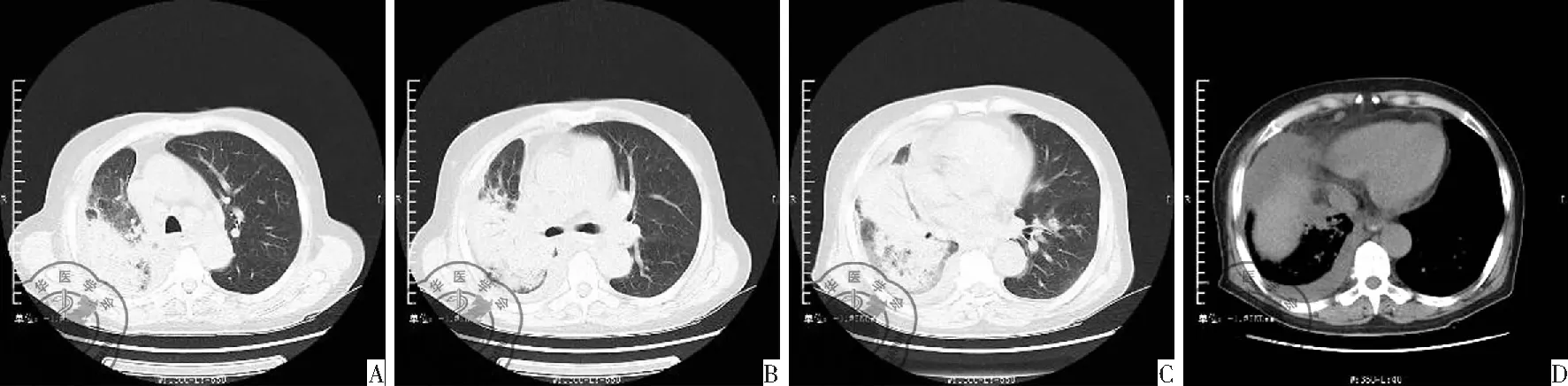
图4 2016年3月25日肺CT图

图6 2016年4月10日肺CT图
DIP多发生于40~50岁的患者,男性是女性的2倍。起病隐匿,主要临床表现为进行性呼吸困难,大多数患者有持续性或阵发性干咳,可以持续几周至几个月[3,5],部分有少量黏痰或痰中带血,约50%有胸痛或胸骨后疼痛。严重者体重明显减轻,且有疲劳、肌痛、多汗等表现。肺功能测定发现,几乎所有DIP患者都有不同程度的肺功能损害,大多数表现为用力肺活量下降,肺顺应性下降,残气量增加,晚期有弥散功能下降[5]。
本例患者为老年男性,吸烟史50年,每日60支,与文献报道的90% DIP患者有吸烟史相符。该患者病史40余天,以干咳、气短、间断发热为主要临床表现,文献报道多为亚急性起病(数周至数月) ,干咳和进行性加重的活动后气促是最常见的临床表现。本病例的临床和病理学特征与文献报道基本一致。不同点是该患者间断的发热,肺实质的改变和胸腔积液,肺部CT表现为肺炎样改变,相关报道少。
DIP与呼吸性细支气管炎伴间质性肺病(respiratory bronchiolitis interstitial lung disease, RB-ILD)均属于吸烟相关性间质性肺炎,在症状、治疗、病程和预后上都与DIP极易混淆。RB-ILD发病年龄平均是36岁,男性多于女性,临床表现类似DIP,双肺爆裂音。大约2/3患者高分辨CT扫描显示网状结节影,缺乏毛玻璃样改变。RB-ILD的病理改变与DIP类似,不同点在于RB-ILD相对局限在呼吸性细支气管及其周围的气腔,其内有大量含色素的巨噬细胞聚集,远端气腔不受累,并且有明显的呼吸性细支气管炎。本病例为老年人,肺部CT少见网格状改变,更重要的是病理改变为远端肺泡内充满增生的肺泡上皮,大量的巨噬细胞,支持DIP的诊断。
该病例特殊表现在于高分辨CT扫描显示,右肺多发的片状密度增高影,支气管通气征明显,胸腔积液。而国内外报道DIP的肺部CT典型表现为双肺弥漫的、均匀一致的磨玻璃影,位于双肺下野和胸膜下,有些伴有基底部的网格条索影[8-9]。该病例与国内外报道不同,以肺炎的影像改变为主,并伴有胸腔积液。这种DIP的影像学改变,在国内外尚无报道。这种肺部CT的改变与亚急性发病的间质性肺疾病-隐源性机化性肺炎(cryptogenic organizing pneumonia, COP)十分相似[10]。但COP的病理改变为小气道、肺泡管和肺泡内及其周围有肉芽组织过度生长、轻度间质性淋巴细胞浸润、Ⅱ型肺泡细胞增生和载脂肺泡巨噬细胞增加[11],该病例与其完全不同。
目前,病理诊断是DIP诊断的“金标准”,对于诊断不明确的间质性肺疾病,选择性地进行肺活检是十分必要的。肺活检方法包括TBLB、经皮肺穿刺活检和外科肺活检(包括开胸肺活检和经胸腔镜肺活检)。TBLB可作为常规检查,但受取材部位和标本量的限制(组织小),不能全面反映肺部病变的范围和程度。对于间质性肺疾病一类疾病,目前认为TBLB较难确定诊断。经皮肺穿刺在临床应用较为广泛,但其主要的并发症是气胸和出血。需要指出的是,虽然所取组织较TBLB大,但经皮肺穿刺的诊断阳性率仍不如外科肺活检高。外科肺活检因取得组织较大(2 cm×2 cm),病理阳性率较高[12],但需要掌握适应症。本例患者70岁,对于有创检查十分抵触,因此病情迁延。且本病例在首次的TBLB检查中无病理诊断意义。经皮肺穿刺过程中出现咯血,相对于外科肺活检组织块小,对于病理诊断可能存在一定的影响。
综上所述,本病例的影像学与过去的报道不同。虽然病理诊断明确,但临床症状和影像学检查,存在很多的不同。目前间质性肺疾病已经成为继慢性阻塞性肺疾病之后,发展更快的呼吸系统疾病,其与环境、吸入有害气体等因素关系密切。对于这种少见的间质性肺疾病的诊治,我们仍需要更多的临床病例,更完整的临床影像学和病理学的资料支持。
1 Costabel U, King TE. International consensus statement on idiopathic pulmonary fibrosis[J]. Eur Respir J, 2001, 17(2): 163-167.
2 Liebow AA, Steer A, Billingsley JG. Desquamative interstitial pneumonia [J]. Am J Med, 1965, 39: 369-404.
3 Carrington CB, Gaensler EA, Coutu RE, et al. Natural history and treated course of usual and desquamative interstitial pneumonia[J]. N Engl J Med, 1978, 298(15): 801-809.
4 Demedts M, Costabel U. ATS/ERS international multidisciplinary consensus classification of the idiopathic interstitial pneumonias[J]. Eur Respir J, 2002, 19(5): 794-796.
5 Tazelaar HD, Wright JL, Churg A. Desquamative interstitial pneumonia [J]. Histopathology, 2011, 58(4): 509-516.
6 Ryu JH, Myers JL, Capizzi SA, et al. Desquamative interstitial pneumonia and respiratory bronchiolitis- associated interstitial lung disease[J]. Chest, 2005, 127(1): 178-184.
7 Godbert B, Wissler MP, Vignaud JM. Desquamative interstitial pneumonia: An analytic review with an emphasis on aetiology[J]. Eur Respir Rev, 2013, 22(128): 117-123.
8 Sverzellati N, Lynch DA, Hansell DM, et al. American Thoracic Society-European Respiratory Society Classification of the Idiopathic Interstitial Pneumonias: Advances in Knowledge since 2002[J]. Radiographics, 2015, 35(7): 1849-1871.
9 姜寒水, 李惠萍, 易祥华, 等. 脱屑性间质性肺炎三例[J]. 中华结核和呼吸杂志, 2008, 31(11): 862-864.
10 潘纪戎. 发展中的胸部放射学[J]. 中华放射学杂志, 2001, 35(9): 645.
11 易祥华, 刘鸿瑞. 特发性间质性肺炎的分类及病理诊断[J]. 中华病理学杂志, 2004, 33(2): 171-175.
12 Ryu JH, Daniels CE, Hartman TE, et al. Diagnosis of interstitial lung diseases[J]. Mayo Clin Proc, 2007, 82(8): 976-986.
10.3877/cma.j.issn.1674-6902.2017.06.032
吉林省科技发展计划项目(20160101187JC)
吉林省卫生计生适宜技术推广课题(2014s013)
130021 长春,吉林省人民医院呼吸内科
史鹏, Email: shi_peng@yeah.net
R563
B
2017-02-05)
王亚南)
史鹏,安东善,付奎升,等. 不典型脱屑性间质性肺炎一例[J/CD]. 中华肺部疾病杂志(电子版), 2017, 10(6): 754-756.
