吸烟对轻度COPD患者血清中氧化应激及炎症因子的影响
2017-12-27吕华亮李洪涛张天托陈开容谭世繁宋一波刘传勇
吕华亮 李洪涛 张天托 陈开容 谭世繁 宋一波 刘传勇
·论著·
吸烟对轻度COPD患者血清中氧化应激及炎症因子的影响
吕华亮1李洪涛2张天托2陈开容1谭世繁1宋一波1刘传勇1
目的探讨吸烟对慢性阻塞性肺疾病(COPD)患者,体内血清氧化应激及炎症因子的影响。方法选取茂名城区40~79岁男性居民行肺功能检查,根据肺功能及吸烟情况分四组:COPD吸烟组、COPD非吸烟组、非COPD吸烟组以及非COPD非吸烟组,每组各40例,检测四组人群血清中的氧化应激指标(MDA、SOD)及炎症因子(IL-8、TNF-α)情况,对比其氧化应激失调及炎症因子情况,并进行统计学分析,了解其差异及相关性。结果与轻度COPD非吸烟组相比较,轻度COPD吸烟组患者的MDA、IL-8、TNF-α水平偏高、SOD水平偏低,除TNF-α差异显著(P<0.05)外,MDA、IL-8和SOD差异不显著(P>0.05);与非COPD吸烟组比较,轻度COPD吸烟组的IL-8、TNF-α水平偏高(P<0.05),SOD水平偏低(P<0.05),MDA偏高但差异不显著(P>0.05),但是SOD水平偏低(P<0.05),IL-8、TNF-α水平偏高(P<0.05);轻度COPD吸烟组的MDA、IL-8、TNF-α水平显著高于非COPD非吸烟组(P<0.05),而SOD偏低(P<0.05)。IL-8、TNF-α与MDA呈正相关(相关系数r分别为0.487、0.468,P值均<0.01);IL-8、TNF-α与SOD呈负相关(相关系数r分别为-0.463、-0.457,P值均<0.01);IL-8、TNF-α与FEV1%pred呈负相关(相关系数r、P值分别为-0.492、P<0.01,-0.697、P<0.01)。结论在非COPD患者中,与非吸烟人群相比,吸烟人群MDA、IL-8、TNF-α偏高,SOD偏低,而COPD人群上述差异更明显。在轻度COPD患者中,IL-8、TNF-α与MDA呈正相关,而与SOD、FEV1%pred呈负相关。提示吸烟所致氧化应激失调可能是由抗氧化剂减少引起,氧化应激失调会导致炎症因子升高,而炎症因子升高会加速肺功能下降,从而导致COPD的发生。
吸烟; 肺疾病,慢性阻塞性; 氧化应激; 炎症因子
慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)主要有以下特征:①持续气流受限; ②可以预防和治疗;③气流受限呈进行性发展; ④气道和肺组织对烟草烟雾等有害气体或有害颗粒的慢性炎症反应增强有关[1-2]。其发病机理尚未明确,目前与其有关的假说主要包括:气道和肺部慢性炎症、氧化应激、蛋白酶/抗蛋白酶失调等。其中以气道炎症和氧化应激失调最为重要,且相互影响。吸烟是COPD最重要的病因之一,在COPD疾病进展中起着重要的作用。吸烟所致的气道炎症和氧化/抗氧化失调是怎样的相关关系,仍是值得探讨的问题。本研究拟从吸烟病因着手,研究轻度COPD患者肺功能、血清炎症因子:白介素-8(interleukin-8, IL-8)、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)和氧化应激指标:丙二醛(malonaldehyde, MDA)、超氧化物歧化酶(superoxide dismutase, SOD)的变化及三者之间的相关关系,从而为临床诊断以及治疗提供新思路,为个体化治疗提供依据。
资料与方法
一、研究对象
选取2015年5月至2016年12月茂名市城区社区流行病学调查、来我院呼吸内科门诊就诊及体检中心体检的茂名城区40~79岁男性居民。所有入选者无过敏性鼻炎、哮喘、支气管扩张、肺结核、肺炎、肺癌等呼吸道及其他系统疾病病史,近1月内无呼吸道感染、抗氧化剂及激素等药物使用史,被调查人群均常住茂名市城区5年以上,所有入选者均签署知情同意书。根据肺功能情况,选择轻度COPD(FEV1/FVC<70%,FEV1%Pred≥80%)和正常对照组(即FEV1/FVC>70%)人群。
二、研究方法
采用日本CHESTGRAPH HI-101Rev.3便携式肺功能检测仪检测患者肺功能。肺功能分级标准:根据2013年中华医学会呼吸病学分会慢性阻塞性肺疾病防治指南[2]关于COPD的诊断标准:吸入支气管舒张药后仍存在FEV1/FVC%<70%预计值者,在排除其他心肺疾病后可诊断为COPD,根据FEV1占预计值的百分比分为四级,其分级标准如下:Ⅰ级(轻度):FEV1≥80%预计值;Ⅱ级(中度):50% ≤FEV1≤79%预计值;Ⅲ级(重度):30% ≤ FEV1≤49%预计值;Ⅳ级(极重度):FEV1<30%预计值。根据吸烟情况选择两类人群进行研究:吸烟者是指吸烟指数为301~500,非吸烟者是指一生中从不吸烟,或累计吸烟量少于20包或1斤烟草丝。根据肺功能情况,选择轻度COPD及体检健康者共160人,根据肺功能及吸烟情况分四组:COPD吸烟组40例,平均(60.1±15.8)岁;COPD非吸烟组40例,平均(59.5±16.2)岁,非COPD吸烟组40例,平均(60.6±17.1)岁,非COPD非吸烟组40例,平均(60.4±16.5)岁。空腹抽取每组40个人的静脉血标本3 ml用Elisa法行MDA、SOD、IL-8、TNF-α检测。
三、统计学方法
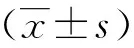
结 果
一、基数资料
1. 各组患者氧化应激及炎症因子指标结果,见表1。与轻度COPD非吸烟组相比较,轻度COPD吸烟组患者的MDA、IL-8、TNF-α水平偏高、SOD水平偏低(P>0.05);与非COPD吸烟组比较,轻度COPD吸烟组的MDA偏高(P>0.05),但是SOD水平偏低(P<0.05),IL-8、TNF-α水平偏高(P<0.05);轻度COPD吸烟组的MDA、IL-8、TNF-α水平显著高于非COPD非吸烟组(P<0.05),而SOD偏低(P<0.05)。
2. 吸烟和非吸烟COPD患者肺功能测定结果,见表2。COPD吸烟组和非COPD吸烟组比较,FEV1、 FVC、FEV1/FVC%、FEV1%pred稍低,但差异无统计学意义(P>0.05)。
二、COPD患者炎症因子与氧化应激及肺功能相关分析
对COPD患者炎症因子与氧化应激及肺功能进行相关性分析发现,炎症因子与氧化应激及肺功能存在有意义的相关关系,见表3。IL-8、TNF-α与MDA呈正相关(相关系数r分别为0.487、0.468,P值均<0.01);IL-8、TNF-α与SOD呈负相关(相关系数r分别为-0.463、-0.457,P值均<0.01);IL-8、TNF-α与FEV1%pred呈负相关(相关系数r、P值分别为-0.492、P<0.01,-0.697,P<0.05)。
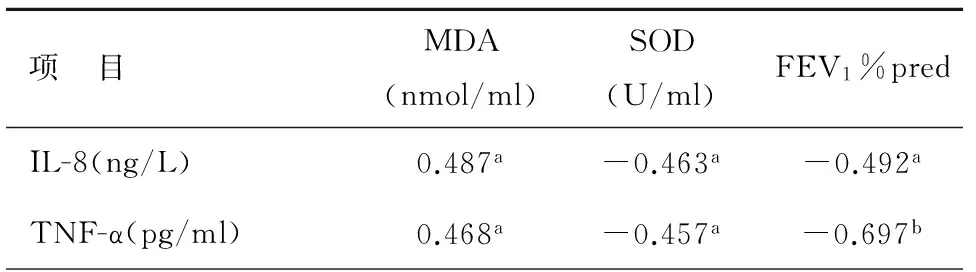
表3 COPD患者炎症因子与氧化应激及肺功能的相关性(r)
注:aP<0.01,bP<0.05
讨 论
COPD 的发病还没有一个确切的机制,炎症反应、氧化应激、蛋白酶抗蛋白酶失调、自身免疫等都是可能导致COPD发病的机制之一[3]。吸烟导致COPD的原因主要与其氧化应激有关[4]。正常情况下,机体的氧化与抗氧化系统之间能维持着一直动态平衡,而这种平衡一旦被打破,可产生氧化应激,并最终引致疾病的发生,比如COPD。体内MDA与氧自由基的生成是一致的,测定MDA可反映脂质过氧化水平。实验研究已经证实,脂质过氧化是导致肺损伤的机制之一,Shunemann等[5]的研究发现,吸烟者血清脂质过氧化物与肺功能呈明显负相关。本研究结果亦显示非吸烟轻度COPD患者、吸烟正常肺功能者以及吸烟轻度COPD者MDA水平均明显高于非吸烟正常肺功能者的MDA水平。因此,吸烟能够使体内的MDA水平增加,而COPD的发生发展也可能与MDA存在联系。很多研究也已经指出:在COPD患者体内,MDA水平与肺功能的下降存在密切相关,稳定期COPD患者呼出的气体和痰中脂质过氧化产物增加[6]。另外值得注意的是,本研究还发现在非COPD吸烟者中的MDA也是明显升高的。这与相关研究报道的结果相一致,该研究认为与正常人对比,COPD患者肺内的氧化应激水平更高,在没有患COPD的吸烟者中亦是如此[7]。这提示我们虽然有些吸烟者未表现出肺功能的损害,但是在其体内已经存在氧化-抗氧化水平功能的失衡。

表1 各组患者氧化应激及炎症指标比较
注: 注:a:与轻度COPD非吸烟组比较,P<0.05;b:与非COPD吸烟组比较,P<0.05;c:与非COPD非吸烟组比较,P<0.05

表2 COPD患者肺功能测定比较
注:两组比较,P>0.05
抗氧化物质的耗竭也是氧化和抗氧化失衡加重的重要原因,在COPD患者中已检测到酶和非酶抗氧化系统异常[8-9]。基于以上理论,本研究检测了抗氧化酶系统指标之一的SOD,结果显示在正常人中,无论是否吸烟,其体内的SOD水平大致相同。前面已经提到吸烟者体内的氧化剂MDA是升高的,那么为什么这些吸烟者未发生COPD,Tang 等[10]研究认为:饮食摄入的抗氧化剂和编码抗氧化酶遗传基因变异决定着吸烟所致肺功能下降的速度,这可能是部份同样吸烟指数人群不发生COPD的原因。另外一种可能的解释是:机体存在某种保护因素能够提高肺组织的抗氧化能力,直接或间接减轻了氧化应激对细胞的各种损伤[11-13]。本研究结果认为:体内抗氧化剂足够多,未达到氧化应激失衡,故而部份吸烟者并没有发展成为COPD患者。另外,本研究显示轻度COPD患者(吸烟或不吸烟)中的SOD明显低于正常人(吸烟或不吸烟)水平。体内SOD的高低是机体抗氧化能力的重要标志,它能够清除体内的氧自由基等。这也提示我们对轻度COPD患者进行SOD浓度的检测意义重要性,其能够对COPD患者体内的抗氧化能力进行评估,从而指导患者预防COPD进展。
氧化应激可以对气道和肺组织进行直接的伤害,而且促进炎症反应[14]。COPD患者存在持续的慢性炎症[2,15],巨噬细胞和上皮细胞分泌IL-8、MCP-1等多种炎症趋化因子,诱导循环系统中的中性粒细胞、单核细胞、淋巴细胞转移入肺[16],炎症细胞被激活后释放炎症介质来破坏肺结构,促进炎症反应[17]。TNF-α在COPD炎症反应中作用广泛,它是中性粒细胞重要的趋化因子,由被激活的巨噬细胞,肥大细胞和气道上皮细胞等炎症细胞产生。TNF-α还能引起气道高反应性,导致气道痉挛,引起患者肺功能下降。TNF-α还能刺激IL-8的分泌,而IL-8是也中性粒细胞和嗜酸细胞趋化因子。然而,也有体内实验表明,TNF-α能抑制中性粒细胞趋化,因此,它在COPD患者肺部炎症中的作用是复杂的,尚有待进一步研究[18]。在COPD稳定期,患者痰液中IL-8显著上升,并与疾病的严重程度相关[19]。临床通常认为TNF-α和IL-8两者互相促进,最终导致气道重塑和气流阻塞[20]。本研究显示轻度COPD人群无论吸烟与否,TNF-α、IL-8水平均无明显差异,但均比非COPD人群明显升高;吸烟非COPD人群炎症因子IL-8较非吸烟健康人群升高明显,但两者炎症因子TNF-α相差不大。另有研究人员发现[21],COPD患者不论发作与否,血中的IL-8水平均明显高于正常,而TNF-α只在发作期或病情恶化时才升高,并且随病情好转而降低。IL-8主要通过促进中性粒细胞在炎症部位及肺组织中的活化而导致炎症的级联反应和肺部持续、慢性炎症[22]。 可见IL-8可能在COPD慢性炎症过程中扮演更加重要的角色,是COPD稳定期应该重点监测的炎症因子。
COPD的发生发展过程中,氧化应激和炎症反应存在相互影响、相互促进。因此,我们将COPD患者的炎症因子(TNF-α、IL-8)与氧化应激指标(MDA、SOD)进行相关分析,结果发现IL-8、TNF-α与血清MDA呈正相关,而与SOD存在负相关。COPD患者体内的TNF-α和IL-8水平增高,炎症细胞释放ROS,参与氧化应激,自由基的一个主要攻击位点是位于细胞膜上的多价不饱和脂肪酸,能导致脂质的过氧化反应,这种脂质的过氧化反应可能会继续形成反应链而产生过氧化物和乙醛。因此,MDA等指标上升,而体内的抗氧化物SOD等物质在在氧化应激早期增强,后期因抗氧化剂的消耗而下降,无法与氧自由基等抗衡,从而使氧化和抗氧化失衡,最终引起不可逆气流受限。本研究中的炎症因子和肺功能的负相关性也符合COPD病理生理学特征,这也提示氧化应激失衡与COPD炎症因子的产生有关,形成恶性循环。ROS引起的氧化应激可使炎症细胞趋化、炎症反应增强。这与既往的研究相一致[13,20,23-25]。
总之,COPD患者的防治任务依然形势严峻,实行全民禁烟等措施将大大降低COPD患病率,从本研究结果可以看出对于轻度COPD患者进行IL-8、TNF-α、MDA以及SOD的监测也具有重要的意义,在早期给予患者有效的干预,阻止或延缓COPD患者的进展也能够在很大程度上减轻社会负担。
1 任成山, 钱桂生. 慢性阻塞性肺疾病发病机制研究现状与展望[J/CD]. 中华肺部疾病杂志(电子版), 2009, 2(2): 104-115.
2 中华医学会呼吸病学分会慢性阻塞性肺疾病学组. 慢性阻塞性肺疾病诊治指南(2013年修订版)[J]. 中华结核和呼吸杂志, 2013, 36(4): 255-264.
3 Tse HN, Tseng CZ. Update on the pathological processes, molecular biology, and clinical utility of N-acetylcysteine in chronic obstructive pulmonary disease[J]. Int J Chron Obstruct Pulmon Dis, 2014, 9: 825-836.
4 Cristóvão C, Cristóvão L, Nogueira F, et al. Evaluation of the oxidant and antioxidant balance in the pathogenesis of chronic obstructive pulmonary disease[J]. Rev Port Pneumol, 2013, 19(2): 70-75.
5 Schünemann HJ, Muti P, Freudenheim JL, et al. Oxidative stress and lung function[J]. Am J Epidemiol, 1997, 146(11): 939-948.
6 Tsukagoshi H, Shimizu Y, Iwamae S, et al. Evidence of oxidative stress in asthma and COPD: potential inhibitory effect of theophylline[J]. Respir Med, 2000, 94(6): 584-588.
7 MacNee W. Pulmonary and systemic oxidant/antioxidant imbalance in chronic obstructive pulmonary disease[J]. Proc Am Thorac Soc, 2005, 2(1): 50-60.
8 Drost EM, Skwarski KM, Sauleda J, et al. Oxidative stress and airway inflammation in severe exacerbations of COPD[J]. Thorax, 2005, 60(4): 293-300.
9 Rahman I, Swarska E, Henry M, et al. Is there any relationship between
plasma antioxidant capacity and lung function in smokers and in patients with chronic obstructive pulmonary disease[J]. Thorax, 2000, 55(3): 189-193.
10 Tang W, Bentley AR, Kritchevsky SB, et al. Genetic variation in antioxidant enzymes, cigarette smoking, and longitudinal change in lung function[J]. Free Radic Biol Med, 2013, 63: 304-312.
11 Inonu H, Doruk S, Sahin S, et al. Oxidative stress levels in exhaled breath condensate associated with COPD and smoking[J]. Respir Care, 2012, 57(3): 413-419.
12 Ben Moussa S, Sfaxi I, Tabka Z, et al. Oxidative stress and lung function profiles of male smokers free from COPD compared to those with COPD: a case-control study[J]. Libyan J Med, 2014, 9: 23873.
13 Vaitkus M, Lavinskiene S, Barkauskiene D, et al. Reactive oxygen species in peripheral blood and sputum neutrophils during bacterial and nonbacterial acute exacerbation of chronic obstructive pulmonary disease[J]. Inflammation, 2013, 36(6): 1485-1493.
14 钟琳晔, 杨汀, 肖飞. 氧化应激及其评价指标在慢性阻塞性肺疾病中的作用[J]. 中华结核和呼吸杂志, 2014, 37(7): 524-527.
15 王西凤, 邢华. 吸烟对老年COPD患者肺功能和气道炎性反应的影响[J]. 疑难病杂志, 2013, 12(2): 96-98.
16 Donnelly LE, Barnes PJ. Chemokine receptors as therapeutic targets in chronic obstructive pulmonary disease[J]. Trends Pharmacol Sci, 2006, 27(10): 546-553.
17 Van Pottelberge GR, Bracke KR, Joos GF, et al. The role of dendritic cells in the pathogenesis of COPD: liaison officers in the front line[J]. COPD, 2009, 6(4): 284-290.
18 Hill A, Gompertz S, Stockley R. Factors influencing airway inflammation in chronic obstructive pulmonary disease[J]. Thorax, 2000, 55(11): 970-977.
19 Beeh KM, Kornmann O, Buhl R, et al. Neutrophil chemotactic activity of sputum from patients with COPD: role of interleukin 8 and leukotriene B4[J]. Chest, 2003, 123(4): 1240-1247.
20 陈燕, 李桂英. 慢性阻塞性肺疾病患者氧化应激与肺功能的相关性[J]. 临床肺科杂志, 2012, (11): 1991-1992.
21 李芝兰, 申叶珍. COPD急性发作期白介素-8、肿瘤坏死因子-α的水平变化及预后分析[J]. 临床肺科杂志, 2013, 18(10): 1753-1755.
22 王菲菲, 李立宇. 炎性细胞因子与慢性阻塞性肺疾病关系的研究进展[J]. 实用心脑肺血管病杂志, 2014, 22(9): 4-7.
23 Ohbayashi O, Takizawa H. Neutrophils and macrophages related to the pathogenesis and disease development of chronic obstructive pulmonary disease by the inflammatory reaction[J]. Nihon Rinsho, 2011, 69(10): 1741-1747.
24 王艳蕾, 刘智群, 杨建军, 等. 氧化/抗氧化失衡与COPD急性加重期炎症反应的关系[J]. 天津医药, 2013, 41(4): 327-329.
25 向永红, 张云, 农智新, 等. Fractalkine与慢性阻塞性肺疾病并肺源性心脏病患者氧化应激相关性及机制探讨[J/CD]. 中华肺部疾病杂志(电子版), 2017, 10(1): 59-63.
Effectsofsmokingonserumoxidativestressandinflammatoryfactorsinpatientswithchronicobstructivepulmonarydisease
LyuHualiang1,LiHongtao2,ZhangTiantuo2,ChenKairong1,TanShifan1,SongYibo1,LiuChuanyong1.
1Departmentofrespiratory,thethirdaffiliatedhospital,SunYat-SenUniversity,Guangzhou510630,China;2Departmentofrespiratory,MaomingPeople′sHospital,Maoming525000,China
ZhangTiantuo,Email:zhtituli@163.com
ObjectiveTo investigate the effects of smoking on serum oxidative stress and inflammatory factors in patients with chronic obstructive pulmonary disease (COPD).MethodsThe male residents age ranged from 40 year old to 79 year-old of Maoming city were divided into four groups according to their lung function and smoking status including COPD smoke group, COPD non-smoke group, non-COPD smoke group , and non-COPD non-smoke group, 40 cases in each group. Oxidative stress indicators of serum (MDA, SOD) and inflammatory factors (IL-8, TNF-α) in the serum of the four groups were measured and analysis to understand their differences and relevance.ResultsCOPD: with mild non smoking group, smoking group of patients with mild COPD MDA, IL-8, TNF-α, SOD alpha level high level is low, in addition to TNF-α significant difference (P<0.05), MDA, IL-8 and SOD have no significant difference (P>0.05); compared with the non COPD smoking group, mild smoking group COPD IL-8 the high level of TNF-α, alpha (P<0.05), SOD (P<0.05), the low level of MDA is higher but the difference was not significant (P>0.05), but low levels of SOD (P<0.05), IL-8, TNF-α high level (P<0.05); mild COPD smoking group of MDA, IL-8, TNF-levels were significantly higher than non COPD group (non smokingP<0.05), and SOD (P<0.05). IL-8 and TNF-alpha were positively correlated with MDA (correlation coefficientr=0.487, 0.468,P<0.01); IL-8 was negatively correlated, TNF-alpha and SOD (correlation coefficientr=-0.463, -0.457,Pall <0.01); was negatively related to IL-8, TNF-alpha and FEV1%pred (correlation coefficientr,Pthe values were -0.492,P<0.01, -0.697,P<0.01). COPD: with mild non smoking group, smoking group of patients with mild COPD MDA, IL-8, TNF-α, SOD alpha level high level is low, in addition to TNF-α significant difference (P<0.05), MDA, IL-8 and SOD have no significant difference (P>0.05); compared with the non COPD smoking group, mild smoking group COPD IL-8 the high level of TNF-α, alpha (P<0.05), SOD (P<0.05), the low level of MDA is higher but the difference was not significant (P>0.05), but low levels of SOD (P<0.05), IL-8, TNF-α high level (P<0.05); mild COPD smoking group of MDA, IL-8, TNF-levels were significantly higher than non COPD group (non smokingP<0.05), and SOD (P<0.05). IL-8 and TNF-alpha were positively correlated with MDA (correlation coefficientr=0.487, 0.468,P<0.01); IL-8 was negatively correlated, TNF-alpha and SOD (correlation coefficientr=-0.463, -0.457,Pall<0.01); was negatively related to IL-8, TNF-alpha and FEV1%pred (correlation coefficientr,Pthe values were -0.492,P<0.01, -0.697,P<0.01).ConclusionsIn non-COPD group, compared with non-smokers, MDA, IL-8, TNF-αand SOD were higher in smokers and the differences were more obvious in COPD patients. Among patients with mild COPD, IL-8 and TNF-α were positively correlated with MDA, but negatively correlated with SOD and FEV1% pred. It suggested that the imbalance of oxidative stress caused by smoking may be caused by the reduction of antioxidants and oxidative stress imbalance can lead to increased inflammatory factors, and inflammatory factors will accelerate the decline in lung function, therefore leading to COPD.
Smoking; Chronic obstructive pulmonary disease; Oxidative stress; Inflammatory factors
10.3877/cma.j.issn.1674-6902.2017.06.010
广东省医学科学技术研究基金项目(No.A2015602)
525000 茂名,广东省茂名市人民医院呼吸内科1
510630 广州,中山大学附属第三医院呼吸内科2
张天托, Email: zhtituli@163.com
R563
A
2016-12-21)
王亚南)
吕华亮,李洪涛,张天托,等. 吸烟对轻度COPD患者血清中氧化应激及炎症因子的影响[J/CD]. 中华肺部疾病杂志(电子版), 2017, 10(6): 681-685.
