促甲状腺激素受体抗体水平与慢性非活动期Graves眼病疾病严重程度的临床相关性研究
2017-12-26甘小林
甘小林,李 曼
(1.延安大学附属医院 眼科,陕西 延安716000;2.宝鸡市人民医院 眼科,陕西 宝鸡721000)
促甲状腺激素受体抗体水平与慢性非活动期Graves眼病疾病严重程度的临床相关性研究
甘小林1,李 曼2*
(1.延安大学附属医院 眼科,陕西 延安716000;2.宝鸡市人民医院 眼科,陕西 宝鸡721000)
目的探讨促甲状腺激素受体抗体(TRAb)水平与慢性非活动期Graves眼病(GO)疾病严重程度的临床相关性。方法选择2008年1月-2013年12月间我院确诊的GO患者40例,对患者的随访均超过18个月。采用M22-TB II法和MC4-TSI测定法检测患者血清TRAb水平,对随访后GO患者利用统计软件比较临床活动性评分(CAS)和眼部改变分级(NOSPECS)与上述不同方法测定血清TRAb水平的相关性。结果40例患者中男12例,女28例;年龄35-72岁,平均(40.23±10.36)岁;眼病病程4-39个月,平均(11.32±9.55)月。其中,29例甲状腺功能正常,11例游离三碘甲状腺原氨酸(T3)超过正常。28例患者MC4-TSI水平阳性(>140 SRR%)、24例患者M22-TB II水平阳性(≥1.75 IU/L),18例患者MC4-TSI、M22-TB II水平均阳性。MC4-TSI水平和CAS评分无相关性(R=0.17,P=0.25),MC4-TSI水平和NOSPECS分级正相关(R=0.48,P<0.01);M22-TB II 水平和CAS评分、NOSPECS分级无相关性(P>0.05,P>0.05)。软组织受累(R=0.33,P<0.05)、眼外肌受累(R=0.35,P<0.05)与MC4-TSI水平呈正相关,其余参量无相关性(P>0.05)。此外,采用线性回归模型进行单因素分析MC4-TSI和M22-TB II水平预测CAS和NOSPECS评分,结果发现仅有MC4-TSI水平可显著预测NOSPECS评分(RR=0.15,P<0.05)。结论MC4-TSI水平跟踪可以更好地评估慢性非活动期GO患者的严重程度。
促甲状腺激素受体抗体;Graves眼病;慢性非活动期;相关性分析
Graves眼病(GO)是与Graves甲状腺功能亢进密切相关一种器官特异性自身免疫性疾病,是由促甲状腺激素(TSH)受体抗体(TRAb)作用于其受体而引起的,在大多数GO患者血液中也可以检测出TRAb,并且眼球后有促甲状腺激素受体(TSHR)及其转录物[1,2]。TRAb是一组多克隆抗体,可以分为刺激型(TSAb)和阻断型(TBN II)两种,分别作用在促甲状腺激素受体(TSHR)胞外区域不同的结合位点[3]。目前,有两种检测TRAb的方法:TSH结合抑制免疫球蛋白测定法(M22-TB II)和甲状腺刺激免疫球蛋白(MC4-TSI)测定法[4]。M22-TB II灵敏度高,可保持极佳的特异性,但不能区别刺激性和阻断性TRAb;甲状腺刺激免疫球蛋白(MC4-TSI)测定法可区分刺激性和阻断性TRAb,但特异性不强。有研究指出,TRAb和MC4-TSI与早期未经治疗的GO患者疾病活动性以及严重程度相关[5]。此外,还有报道显示GO患者高初始TRAb水平有严重疾病的风险更大[6]。然而,在GO慢性非活动期关于TRAb水平与后期患者疾病活动性及严重程度的报道却较少。本研究为探讨TRAb水平与GO慢性非活动期疾病严重程度的临床相关性,采用M22-TB II法和MC4-TSI测定法检测患者血清TRAb水平,对随访后GO患者利用统计软件比较临床活动性评分(CAS)和眼部改变分级(NOSPECS)与上述不同方法测定血清TRAb水平的相关性。
1 资料与方法
1.1 一般资料
选择2008年1月-2013年12月间我院确诊的GO患者40例,对患者的随访均超过18个月。40例患者中男12例,女28例;年龄35-72岁,平均(40.23±10.36)岁;眼病病程4-39个月,平均(11.32±9.55)月。其中,29例甲状腺功能正常,11例游离三碘甲状腺原氨酸(T3)超过正常。纳入标准:参照 1992 年美国等 18 个成员组成的 AdHoc 委员会推荐的慢性非活动期Graves眼病疾病临床评分标准,活动性突眼临床积分<3分患者;曾诊断为有眼病的症状和体征,如眼睑挛缩、不同程度眼球突出、双眼平视时上睑边缘超出上角膜巩膜缘、眼外肌功能障碍(限制性眼肌病、眼球活动受限、复视斜视或CT与MRI证实眼外肌增大)、眼睑肿胀、视神经功能障碍视敏度下降。排除标准:其他可能造成上述症状和体征改变的原因;眼眶减压或眼睑及肌肉手术;结膜炎,角膜炎等眼科疾病;颅内、球后肿瘤、重症肌无力低钾性麻痹等。
1.2 TRAb检测
所有患者治疗前抽取静脉血液5-10 ml,静置或离心后分离血清,储存于-20℃冰箱备用。M22-TB II法:又称体外测定法,基本原理是TRAb与生物素标记的M22竞争性结合,通过检测放射性标记M22与其受体结合的抑制性检测GO患者血清TRAb水平[7]。本研究使用全自动电化学发光免疫分析仪(德国罗氏诊断公司)检测GO患者血清TRAb水平。其中,阳性结果的临界值为1.75 IU/L。MC4-TSI法:又称生物学测定法,基本原理是通过培养的大鼠甲状腺细胞或表达人TSHR(CHO-R)的转染细胞与患者血清孵育来检测环腺苷酸(cAMP)的产生,进而计算TRAb水平[8]。本研究采用酶联免疫吸附法,使用TSI ELISA Kit(上海蔚霆生物科技有限公司)检测GO患者血清TRAb水平。其中,阳性结果的临界值为140%试样参考比(SRR)。
1.3 疗效标准
NOSPECS分级:参照前人方法[9],分级0-6级,分别为0 级:没有任何症状;第一级只有外表的变化,例如眼睛有直视,上眼睑挛缩或眼睛看下方时,上眼睑没有跟下来;第二级为有软组织的症状,例如主观上有过度的流泪、眼有异物感、眼球不舒服、怕光等,而外表出现结膜、眼睑水肿,结膜充血等;第三级为眼球突出,突眼超过16 mm;第四级眼球外肌受累,以致眼球转动受限、复视;第五级为角膜受损,出现角膜损伤或溃疡;第六级为视觉障碍。CAS评分:①自发眼眶疼痛;②眼球运动诱发疼痛;③眼睑水肿;④眼睑充血;⑤结膜充血;⑥球结膜水肿;⑦泪阜或皱襞炎症;⑧眼球突出度≥2 mm;⑨眼球运动减弱≥5°;⑩视力下降≥1行[10]。共10项,每一项计1分,共计10分。其中,疗效标准评定与TRAb检测同步进行。
1.4 统计学分析

2 结果
2.1 患者人口统计学资料
40例患者TSH值为(2.36±4.55)uIU/mL、游离T4为(1.16±0.52)ng/dL、游离T3值为(4.30±10.59)ng/dL、NOSPECS分值为(4.82±3.02)分、CAS分值为(0.51±0.80)分,MC4-TSI水平为(326.21±200.35)SRR%,M22-TB II水平为(7.51±9.62)IU/L,28例患者MC4-TSI水平阳性(>140 SRR%)、24例患者M22-TB II水平阳性(≥1.75 IU/L),18例患者MC4-TSI、M22-TB II水平均阳性,见表1。
2.2 MC4-TSI、M22-TB II水平和CAS评分、NOSPECS分级相关性分析
见图1,图2。40例患者MC4-TSI、M22-TB II水平和CAS评分、NOSPECS分级相关性分析结果显示:MC4-TSI水平和CAS评分无相关性(R=0.17,P>0.05),MC4-TSI水平和NOSPECS分级正相关(R=0.48,P<0.01);M22-TB II 水平和CAS评分、NOSPECS分级无相关性(P>0.05,P>0.05)。

表1 患者人口统计学资料
2.3 NOSPECS分级参量与M22-TB II、MC4-TSI水平的相关性分析
见表2。40例患者NOSPECS分级参量与M22-TB II、MC4-TSI水平的相关性分析结果显示:软组织受累(R=0.33,P<0.05)、眼外肌受累(R=0.35,P<0.05)与MC4-TSI水平呈正相关,其余参量无相关性(P>0.05)。此外,采用线性回归模型进行单因素分析MC4-TSI和M22-TB II水平预测CAS和NOSPECS评分,结果发现仅有MC4-TSI水平可显著预测NOSPECS评分(RR=0.15,P<0.05)。
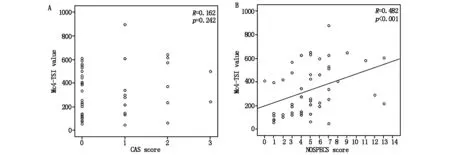
A:MC4-TSI水平和CAS评分相关性分析;B:MC4-TSI水平和NOSPECS分级相关性分析
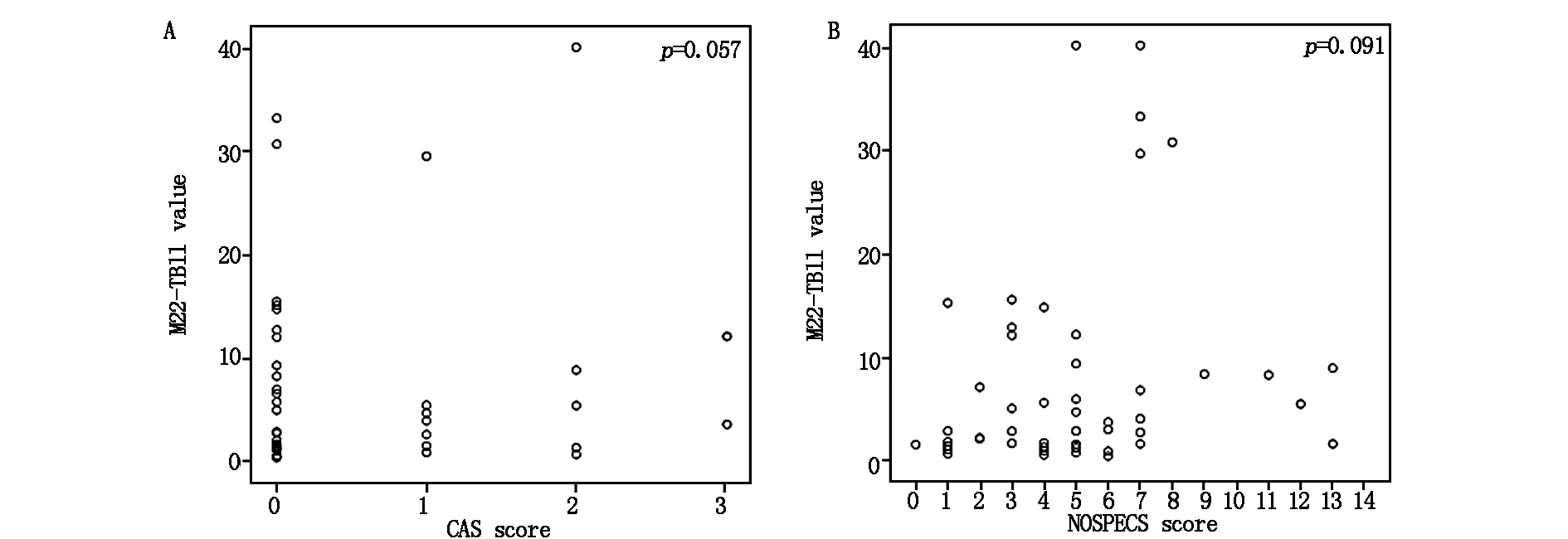
A:M22-TB II水平和CAS评分相关性分析;B:M22-TB II水平和NOSPECS分级相关性分析

表2 NOSPECS分级参量与M22-TB II、MC4-TSI水平的相关性分析
3 讨论
作为一种常规诊断和监测Graves病甲状腺功能亢进症的方法,TRAb检测技术已被广泛应用。该技术不仅可以提高特异性甲状腺功能亢进症诊断的敏感性和特异性,还可在临床常规检查中大量使用。在眼科领域,大量事实表明MC4-TSI水平可成为评估GO临床表现的重要指标[11]。并且,有文献报道MC4-TSI水平与未经治疗的GO疾病早期阶段的眼球活动和严重程度相关[12]。本研究主要针对在Graves眼病慢性非活动期TRAb水平进行相关研究,研究结果显示仅MC4-TSI水平和NOSPECS分级正相关(R=0.48,P<0.01),而MC4-TSI水平和CAS评分无相关性(R=0.17,P>0.05),M22-TB II 水平和CAS评分、NOSPECS分级也无相关性(P>0.05,P>0.05)。此外,40例患者NOSPECS分级参量与M22-TB II、MC4-TSI水平的相关性分析结果显示:软组织受累(R=0.33,P<0.05)、眼外肌受累(R=0.35,P<0.05)与MC4-TSI水平呈正相关,其余参量无相关性(P>0.05)。另外,采用线性回归模型进行单因素分析MC4-TSI和M22-TB II水平预测CAS和NOSPECS评分,结果发现仅有MC4-TSI水平可显著预测NOSPECS评分(RR=0.15,P<0.05)。
GO活动评分以及CAS评分在Graves眼病慢性非活动期与两种TRAb检测方法无相关性,一个重要的原因可能是由于本研究中大多数随访者CAS评分较低。本研究中,CAS分值为(0.51±0.80)分,有32例患者CAS分值介于0-1分之间。本研究结果与之前的研究结论不同,他们提示疾病活动在未经治疗的GO疾病早期阶段与TRAb水平相关[13]。此外,Ponto等人的研究指出MC4-TSI水平和球结膜水肿之间存在高相关性,并且在临床上可作为重要的急性炎症程度的标志物之一[6]。
MC4-TSI水平和NOSPECS分级相关,尤其是在肌病参数评分方面[14]。本研究意外发现即使炎症活动在完全消退的情况下,临床症状严重的部分患者MC4-TSI水平偏高。有研究显示在疾病的早期阶段,MC4-TSI水平偏高预示患者疾病程度严重,这表明他们机体内存在较高的抗体水平和更严重的慢性非活动期的疾病[15]。众所周知,抗甲状腺药物的使用会造成TRAb水平下降。Laurberg等人的研究指出在ATD治疗的前6个月,TRAb水平跌幅最大[16]。在本研究中,ATD持续治疗时间为(48.62±13.60)月,均已超出前人的TRAb水平最大跌幅期。然而,通过MC4-TSI测定法仍然可以说明TRAb水平与Graves眼病慢性非活动期疾病严重程度相关。
由于GO的发病机制还没有完全探清,但比较可能的机制是眼肌周围的成纤维细胞、眼球后脂肪组织的脂肪细胞和成纤维细胞的细胞膜上有促甲状腺激素受体,T细胞作用于上述有促甲状腺激素受体的细胞,分泌的细胞因子可刺激上述细胞增生,并促使上述细胞分泌糖胺聚糖和表达主要组织相容性复合物抗原,造成病情加重[17]。若按照上述机制,则在一定程度上很难解释MC4-TSI测定法与Graves眼病慢性非活动期疾病严重程度的相关性。有研究调查了引起MC4-TSI和M22-TB II水平差异的患者的临床特点,结果显示某些患者有相对高的MC4-TSI水平、相对低的M22-TB II水平也会有很高的CAS和NOSPECS评分。但是,甲亢患者更可能出现高M22-TB II和低MC4-TSI水平[7]。目前,本研究的局限性是它的回顾性差和样本数量少,但值得注意的是MC4-TSI水平与NOSPECS评分的相关性,特别是在慢性非活动期的MC4-TSI水平越高NOSPECS评分也越高。GO患者MC4-TSI水平跟踪可以更好地评估慢性非活动期疾病的严重程度。
[1]朱 巍,叶 蕾,焦 秦,等.Graves眼病的临诊应对[J].中华内分泌代谢杂志,2016,32(1):71.
[2]Lazarus J H.Epidemiology of Graves' orbitopathy (GO) and relationship with thyroid disease.[J].Best Practice & Research Clinical Endocrinology & Metabolism,2012,26(3):273.
[3]李 滔,李 军.促甲状腺素受体抗体检测在Graves诊治中的临床价值[J].长江大学学报(自科版),2013,10(6):28.
[4]Woo Y J,Sun Y J,Lim T H T,et al.Clinical Association of Thyroid Stimulating Hormone Receptor Antibody Levels with Disease Severity in the Chronic Inactive Stage of Graves' Orbitopathy[J].Korean Journal of Ophthalmology,2015,29(4):213.
[5]Lytton S D,Ponto K A,Kanitz M,et al.A novel thyroid stimulating immunoglobulin bioassay is a functional indicator of activity and severity of Graves' orbitopathy[J].Journal of Clinical Endocrinology & Metabolism,2010,95(5):2123.
[6]Ponto K A,Kanitz M,Olivo P D,et al.Clinical relevance of thyroid-stimulating immunoglobulins in graves' ophthalmopathy[J].Ophthalmology,2011,118(11):2279.
[7]Sun Y J,Dong Y S,Lee E J,et al.Clinical characteristics of Graves' orbitopathy in patients showing discrepancy between levels from TBII assays and TSI bioassay[J].Clinical Endocrinology,2014,80(4):591.
[8]Jang S Y,Shin D Y,Lee E J,et al.Correlation between TSH receptor antibody assays and clinical manifestations of Graves' orbitopathy[J].Yonsei Medical Journal,2013,54(4):1033.
[9]洪庆山,沈 洁,薛耀明,等.MRI在甲状腺相关眼病分级和分期的应用[J].中华内分泌代谢杂志,2010,26(3):215.
[10]俞丹洋,魏锐利,李玉珍,等.儿童及青少年Graves眼病的临床特点及疗效分析[J].中华实验眼科杂志,2016,34(8):716.
[11]梁雯丽,郑 艳,李 娜,等.Graves甲亢患者131I治疗后早期TRAb及TSAb变化的研究分析[J].国际放射医学核医学杂志,2016,40(1):13.
[12]齐少平.Graves'眼病早期眼外肌体积变化及影响因素的研究[D].天津医科大学,2014.
[13]Meyer Z H M,Pateronis K,Walz M K,et al.The Effect of Early Thyroidectomy on the Course of Active Graves' Orbitopathy (GO):A Retrospective Case Study[J].Hormone & Metabolic Research,2016,48(7):433.
[14]Jang S Y,Lee S Y,Lee E J,et al.Clinical features of thyroid-associated ophthalmopathy in clinically euthyroid Korean patients[J].Eye,2012,26(9):1263.
[15]Aass C,Norheim I,Eriksen E F,et al.Comparative proteomic analysis of tear fluid in Graves’ disease with and without orbitopathy[J].Clinical Endocrinology,2016,3(9):556.
[16]Laurberg P,Wallin G,Tallstedt L,et al.TSH-receptor autoimmunity in Graves' disease after therapy with anti-thyroid drugs,surgery,or radioiodine:a 5-year prospective randomized study[J].European Journal of Endocrinology,2008,158(1):69.
[17]王亚琼,李红.Graves眼病发病机制研究进展[J].国际眼科杂志,2012,12(1):65.
陕西省自然科学基金资助项目,编号:No2012JZ4003
*通讯作者
1007-4287(2017)12-2132-04
R771.3
A
2017-01-19)
