荧光金纳米簇/单壁碳纳米管(AuNCs/SWNTs)复合材料制备及体外细胞毒性研究
2017-12-26李英姿汪德州李迎彩宋文植尹万忠
李英姿,何 丹,汪德州,李迎彩,张 艳,刘 新,宋文植*,尹万忠*
(1.吉林大学中日联谊医院 口腔科,吉林 长春130033;2.吉林大学第一临床医院 耳鼻咽喉-头颈外科)
荧光金纳米簇/单壁碳纳米管(AuNCs/SWNTs)复合材料制备及体外细胞毒性研究
李英姿1,何 丹2,汪德州1,李迎彩1,张 艳1,刘 新1,宋文植1*,尹万忠2*
(1.吉林大学中日联谊医院 口腔科,吉林 长春130033;2.吉林大学第一临床医院 耳鼻咽喉-头颈外科)
目的制备新型荧光金纳米簇/单壁碳纳米管(AuNCs/SWNTs)复合材料并研究其体外细胞毒性。方法以牛血清白蛋白介导合成金纳米簇,并进一步合成AuNCs/SWNTs纳米复合材料,检测其荧光性,CCK-8方法检测其对人成纤维细胞的体外细胞毒性。结果制备的AuNCs/SWNTs纳米复合材料镜下有明显荧光,CCK-8结果显示,不同浓度AuNCs/SWNT材料分别与细胞共同培养24 h,各剂量组与正常对照组相比较,细胞存活率差异不具有统计学意义(P>0.05)。结论制备的荧光AuNCs/SWNTs纳米复合材料在本实验浓度范围内无体外细胞毒性,在肿瘤细胞成像及近红外热疗领域有潜在应用前景。
单壁碳纳米管;金纳米簇;CCK-8;细胞毒性
碳纳米材料的研究是当前世界上最为活跃的前沿领域之一,其中单壁碳纳米管(SWNTs)是一种具有独特层状中空管状结构的一维量子材料,具有巨大的比表面积和独特的近红外光吸收特性,易于修饰,在示踪成像、靶向载药、肿瘤热疗等领域具有引人注目的前景[1,2],其研究也正向多功能复合材料方向发展,因此本实验拟制备新型荧光金纳米簇/单壁碳纳米管(AuNCs/SWCNTs)复合材料,并检测其荧光性与体外细胞毒性,为此种材料的生物医学应用提供依据。
1 材料与方法
1.1实验试剂及材料单壁碳纳米管(SWNTs,中国科学院成都有机化学有限公司);四 氯 金 酸(HAuCl4·3H2O,国药集团化学试剂有限公司),无水丙酮,氨水(国药集团化学试剂有限公司),十二烷基硫酸钠(SDS, Amresco,美国),氢氧化钠(NaOH,美国Sigma公司),乙醇(C2H5OH北京化工厂),以上均为优级纯;高纯水(Milli-Q纯水仪,使用前减压蒸馏提纯),PTFE滤膜(Millipor,美国),DMEM培养基(GIBCO,美国),牛血清白蛋白(BSA,GIBCO,美国)CCK-8试剂盒(日本同仁)胰蛋白酶(DIFCO,美国)胎牛血清(TBD公司 ,中国)。
实验仪器: JEOL-2010透射电镜(日本电子),二氧化碳孵箱(美国SIM公司),超净工作台(安徽蚌埠市瑞风净化设备),JEM-2100F高分辨透射电镜(日本电子) BX51荧光显微镜(日本,奥林巴斯)。
1.2方法
1.2.1荧光金纳米簇单/壁碳纳米管(AuNCs SWNTs/)纳米复合粒子合成 参照文献制备金纳米簇(AuNCs):以次氯金酸为原料,以牛血清白蛋白(BSA)介导合成BAS-AuNCs金纳米簇材料[3],反应完毕溶液从浅黄色到浅棕色,最后成为深棕色的BAS-AuNCs金纳米簇溶液,4℃避光保存。
单壁碳纳米管(SWNTs)的纯化:将80 mg单壁碳纳米管与2 g SDS混和于200 ml超纯水中,冰水浴中超声 30 min。将超声后的混合物在4℃ 离心 4 h (12500 rpm/min),弃沉淀。小心收集约80%的上清液, 并用无水丙酮稀释,在此过程中,SDS从碳管上解离,使碳管发生絮凝聚集。 离心收集碳管,并用丙酮清洗数次以完全去除SDS,PTFE膜(0.45 μm)过滤,真空干燥。
取1 mg 纯化后的单壁碳纳米管加入1 ml BSA-AuNCs 溶液中,冰水浴中超声2 h至碳管完全分散,4℃下静止12 h。将此混合溶液以12 000 rpm /min离心 30 min,以除去未与碳管结合的BSA-AuNCs,弃上清液,超纯水洗涤3次,得到AuNCs /SWNTs 纳米复合粒子。镜下观察粒子形貌并检测其荧光性,得到的AuNCs/SWNTs 纳米复合粒子示意图如图1。
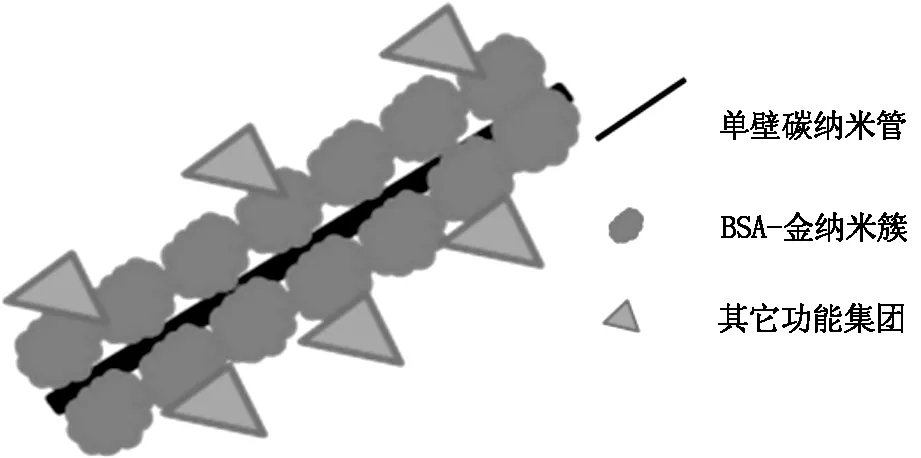
图1 AuNCs/SWNTs纳米复合粒子示意图
1.2.2AuNCs/SWNTs纳米复合粒子体外细胞毒
性检测 取手术切除的儿童新鲜包皮组织,参考文献[4]分离培养人成纤维细胞,传代,取对数生长期的细胞,胰酶消化,将细胞密度调整为1×105/ml,96孔板内接种,二氧化碳培养箱37℃孵育,单层细胞铺满孔底后,弃培养液,将制备的荧光金纳米簇/碳纳米管复合粒子用含100 u/ ml 青霉素-链霉素的DMEM细胞培养液稀释,每孔200 μl加入96孔板中,使6组SWNTs/AuNCs粒子终浓度分别为(0、6.25、12.5、25、50和100 μg/ml),每组3复孔,空白对照组只加细胞培养液。继续培养24 h,弃原培养液,每孔加入cck-8试剂10 μl及细胞培养液至100 μl,孵育2 h ,检测各孔吸光度值,参比波长450 nm。各组细胞存活率按以下公式计算:
细胞存活率(%)= (A加药-A空白)/(A无药-A空白)×100% 。
A加药:含细胞、CCK溶液和AuNCs/SWNTs纳米粒子溶液孔的吸光度;A空白:含DMEM培养基和CCK 溶液孔的吸光度;A无药:含细胞、DMEM培养基、CCK溶液孔的吸光度。
1.3统计学方法
实验结果统计学分析采用SPSS17.0统计软件处理,组与组间比较采用t检验。
2 结果
2.1AuNCsSWNTs/纳米复合材料表面形貌
AuNCs SWNTs/ 纳米复合粒子扫描电镜及高分辨电镜观察见图2。由图可看出,单壁碳纳米管能够有效的被分散于BSA-AuNCs溶液中,高分辨电镜下可见金纳米簇粒子连接于碳纳米管表面,形成复合纳米材料。

图2 金纳米簇/碳纳米管复合材料透射电镜及高分辨电镜图
2.2AuNCs/SWNTs 纳米复合材料荧光显微镜照片见图3。由图可见AuNCs/SWNTs 纳米复合粒子荧光显微镜下镜下仍有明显荧光。

图3 金纳米簇/碳纳米管复合材料荧光电镜图
2.3AuNCsSWNTs/纳米复合材料荧光光谱
金纳米簇/碳纳米管复合材料荧光光谱见图4。可见,当激发波长为470 nm时,荧光金纳米簇/碳纳米管复合材料最大发射波长在640 nm。
2.4AuNCs/SWNTs纳米复合材料体外细胞毒性检测
CCK-8法检测不同浓度AuNCs/SWNTs纳米复合材料对人成纤维细胞存活率的影响,结果见表1。
结果表明,不同浓度AuNCs/SWNTs分别与细胞共同培养,各浓度组与阴性对照组相比较,差异无统计学意义(P>0.05)。
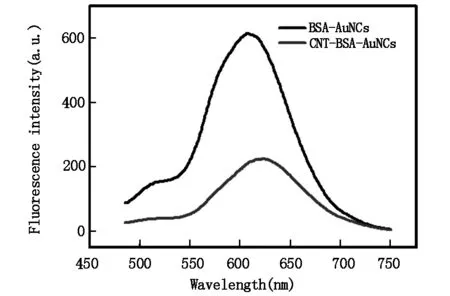
图4 金纳米簇/碳纳米管复合材料荧光发射光谱

复合粒子浓度(μg/ml)06.2512.52550100细胞存活率(%)100±0100.086±2.94397.449±1.61298.765±0.33195.274±1.05294.523±1.873
3 讨论
3.1单壁碳纳米管及其复合材料在肿瘤诊疗领域的应用
单壁碳纳米管(SWNTs)由单层石墨卷曲而成,直径为1-2 nm,长度50 nm-1 cm。在肿瘤诊疗领域,单壁碳纳米管因具有独特的近红外光学性能而成为恶性肿瘤光热治疗的理想介导材料[5]。同时因单壁碳纳米管是柔韧的一维结构,具有非常大的比表面积,因此易于修饰,可以同时装载多个分子,利于制备多功能纳米材料及生物传感材料,并可与一个细胞上的多个结合位点结合,因此在肿瘤诊疗领域展现出有价值的应用前景。具体来说有以下几个方面:
3.1.1生物传感器用于肿瘤早期诊断
单壁碳纳米管具有纳米尺度、石墨烯式的表面化学和电学性质,使其成为理想的制作化学与生物传感器的候选材料[6,7]。应用半乳糖修饰的单壁碳纳米管为生物传感器元件检测肿瘤细胞表面标记物半乳糖凝集素3[8],Liu[9]等用叶酸共价修饰的单壁碳纳米管组装至3-巯基丙酸(MPA)修饰的金基板负极,利用叶酸与细胞表面叶酸受体的高亲和比率检测人宫颈癌细胞,大大提高了宫颈癌早期检测精确度。目前研究认为应用单壁碳纳米管制作无标记电化学阻抗谱(EIS)生物传感器可以降低生物传感芯片背景信号,增加灵敏度,有望用于肿瘤相关糖蛋白的高通量,非标记质谱技术检测,在肿瘤早期诊断中发挥重要作用。
3.1.2药物载体
单壁碳纳米管能够与多种蛋白质、核酸、化学药物等有机或无机粒子结合,成为理想载体材料。以基因药物载体为例,传统的病毒等载体通过将核酸导入细胞质或细胞核内发挥治疗作用,Behnam等[10]将单壁碳纳米管与不同分子量的聚乙烯亚胺(PEIs)相连,证明聚乙烯亚胺修饰的单壁碳纳米管在体液环境下有良好的分散型及稳定性,体内体外都展示出高效的基因转染效率。Kam等[11]将PL-PEG修饰单壁碳纳米管,并通过二硫键与SiRNA相连,达到使目的基因沉默的目的。研究证明碳纳米管作为一种新型非病毒基因药物载体,与传统的核酸转运载体相比,己经表现出其独特的优势[12,13]。在恶性肿瘤化疗领域,化疗药物不仅有很强毒副作用,而且易产生耐药性影响治疗效果。Ajima[14]等以抗癌药物顺铂与单壁碳纳米管相连制备出纳米药物载体CDDP@SWNHox ,体外实验显示CDDP@SWNHox抑制肿瘤细胞增殖的作用较单纯的CDDP高4-6倍, 体内实验也较CDDP显示出更强的抑瘤作用。Bhirde等[15]针对膜高表达CD44的多药耐药细胞,开发出新型单壁碳纳米管复合药物输送系统CAHA-sSWCNT-DOX,证明此种药物复合载体可使抗癌药物DOX分子更多地聚集于癌细胞内,从而更有效地杀灭多药耐药卵巢癌细胞CAHA-sSWCNT-DOX,静脉注射的CAHA-sSWCNT-DOX结合808 nm激光热疗,可以使多药耐药卵巢癌OVCAR8/ADR细胞荷瘤裸鼠的肿瘤完全消失。Lin[16]等则制备了负载化疗药物阿霉素和磁共振增强剂的纳米复合材料Gd/SWCNTs-HA-ss-DOX,使化疗、光热治疗和磁共振成像功能集于一个纳米平台成为可能。
因此目前认为利用功能化碳纳米管作为药物和基因输送载体,具有转染效率高、减轻毒副反应、可有效作用于多药耐药细胞、实现药物控释和协同治疗等优点。
3.1.3成像及近红外光热治疗
700-1 100 nm范围的近红外光区是机体组织的透射窗口,而SWNTs有高吸收此范围光波的特性,因此SWNTs在受到近红外激光照射时可以快速产生光热转换,使肿瘤局部温度升高而达到有效温度42-45℃而不伤害周围健康细胞[17,18]。肿瘤细胞的近红外热疗有两种杀灭方式:热消融或诱导瘤细胞凋亡,一般认为是在多种机制共同作用下达到杀灭肿瘤细胞的效果。此外,因为SWNTs具有较大的散射截面,故具有了独特的拉曼信号增强功能[19,20],可用于拉曼探测和成像,在恶性肿瘤早期诊断、治疗监测中有重要意义。目前将SWNTs肿瘤靶向给药系统和近红外激光热疗联合应用可以达到更加有效的抗肿瘤作用。
3.2荧光金纳米簇/单壁碳纳米管复合材料的制备
由单壁碳纳米管和荧光物质共同组成的复合纳米材料在肿瘤多模态生物成像、光学传感等方面具有尤为重要的意义[21]。单壁碳纳米管荧光复合材料一般是通过共价结合的方式将荧光染料、半导体量子点等连接到碳纳米管表面。此类方法通常需要进行多步修饰,时间成本和经济成本较高。并且,荧光染料和半导体量子点在光稳定性和生物相容性等方面的不足限制了此类复合材料在生物和医学等领域的应用。
金纳米簇是近年来新发展起来的一类荧光材料[22,23]。与经典的荧光染料和半导体量子点相比,金纳米簇具有更好的光稳定性和生物相容性。金纳米簇的合成通常采用生物分子,如氨基酸、蛋白质、DNA等作为配体。一方面,这些配体分子能够给金纳米簇提供足够的保护作用,避免纳米簇在溶液中的聚集。另一方面,这些配体具有丰富的功能集团,为金纳米簇和其他材料的复合提供可能。因此本文中,我们利用牛血清白蛋白为配体制备金纳米簇,疏水性的单壁碳纳米管可以很好地分散于牛血清白蛋白/金纳米簇溶液中,并以非共价结合的方式结合,得到新型单壁碳纳米管/金纳米簇荧光复合材料,本实验中制备的金纳米簇/单壁碳纳米管材料分散性好且稳定,可以4℃保存1周而无沉淀,使验中牛血清白蛋白的存在防止了碳纳米管的荧光淬灭作用,使新型单壁碳纳米管/金纳米簇材料继续保持其良好的荧光性。
3.3荧光金纳米簇/单壁碳纳米管复合材料的生物相容性
一般认为疏水性的碳纳米管经过表面修饰后不仅增加其可溶性,而且可大大降低其细胞毒性,使之更加符合生物医学领域要求[24,25]。本实验以新型牛血清白蛋白/金纳米簇修饰单壁碳纳米管,不仅增加了其可溶性,而且采用简便准确的CCK-8方法研究其体外细胞毒性,从实验结果看,本实验条件下,各组不同浓度荧光金纳米簇/碳纳米管复合材料体外细胞毒性均为0-1级,说明此浓度范围的AuNCs/SWNTs纳米复合材料对人成纤维细胞无体外细胞毒性。可以认为经BSA-AUNCs功能化修饰的单壁碳纳米管更适于生物医学领域应用的要求。
因此本实验制备的荧光金纳米簇/碳纳米管复合材料结合了单壁碳纳米管的近红外光热转换功能和金纳米簇荧光性为一体,且在一定浓度范围内无体外细胞毒性,不仅可用于近红外热疗、成像诊断,而且后续还可望作为载体材料负载化疗、光动力治疗等药物,将在恶性肿瘤综合诊疗领域有广范应用。
[1]Sanginario A,Miccoli B,Demarchi D.Carbon Nanotubes as an Effective Opportunity for Cancer Diagnosis and Treatment[J].Biosensors,2017, 7(1): 9.
[2]Hemasa AL,Naumovski N,Maher WA,et al.Application of Carbon Nanotubes in Chiral and Achiral Separations of Pharmaceuticals,Biologics and Chemicals[J].Nanomaterials,2017,7(7): 186.
[3]Xie J,Zheng Y,Ying JY.Protein-directed synthesis of highly fluorescent gold nanoclusters[J].J of the American Chemical Society,2009,131(3):888.
[4]姜雅萍,宋文植,尹万忠,等.金纳米花粒子对体外人成纤维细胞的毒性作用[J].吉林大学学报医学版,2011,4:651.
[5]Murali VS,Wang R,Mikoryak CA,et al.The impact of subcellular location on the near infrared-mediated thermal ablation of cells by targeted carbon nanotubes[J].Nanotechnology,2016,27(42):425102.
[6]Garcia KE,Babanova S,Scheffler W,et al.Designed protein aggregates entrapping carbon nanotubes for bioelectrochemical oxygen reduction[J].Biotechnol Bioeng,2016 ,113(11):2321.
[7]Iverson NM,Strano MS,Wogan GN.In vivo delivery of nitric oxide-sensing,single-walled carbon nanotubes[J].Curr Protoc Chem Biol,2015,7(2):93.
[8]Park YK, Bold B, Lee WK,et al.D-(+)-galactose-conjugated single-walled carbon nanotubes as new chemical probes for electrochemical biosensors for the cancer marker Galectin-3[J].Int J Mol Sci,2011,12(5): 2946.
[9]Liu J,Qin Y,Li D,et al.Highly sensitive and selective detection of cancer cell with a label-free electrochemical cytosensor.Biosens Bioelectron[J]. Int J Pharm,2013,454(1):204.
[10]Behnam B,Shier WT,Nia AH,et al.Non-covalent functionalization of single-walled carbon nanotubes with modified polyethyleneimines for efficient gene delivery[J].Biomed Pharmacother,2012,66(5):334.
[11]Kam NW,Liu Z,Dai H.Functionalization of carbon nanotubes via cleavable disulfide bonds for efficient intracellular delivery of siRNA and potent gene silencing[J].J Am Chem Soc,2005,127(36):12492.
[12]Chen H,Ma X,Li Z,et al.Functionalization of single-walled carbon nanotubes enables efficient intracellular delivery of siRNA targeting MDM2 to inhibit breast cancer cells growth[J].Biomed Pharmacother,2012,66(5):334.
[13]Krajcik R,Jung A,Hirsch A,et al.Functionalization of carbon nanotubes enables non-covalent binding and intracellular delivery of small interfering RNA for efficient knock-down of genes[J].Biochem Biophys Res Commun,2008,369(2):595.
[14]Ajima K,Murakami T,Mizoguchi Y,et al.Enhancement of in vivo anticancer effects of cisplatin by incorporation inside single-wall carbon nanohorns[J]. ACS Nano,2008,2:2057.
[15]Bhirde AA,Chikkaveeraiah BV,Srivatsan A,et al.Targeted therapeutic nanotubes influence the viscoelasticity of cancer cells to overcome drug resistance[J].ACS Nano,2014,8(5):4177.
[16]Lin Hou,Xiaomin Yang,Junxiao Ren,et al.A novel redox-sensitive system based on single-walled carbon nanotubes for chemo-photothermal therapy and magnetic resonance imaging[J].Int J Nanomedicine,2016,11: 607.
[17]Liang X,Shang W,Chi C,et al.Dye-conjugated single-walled carbon nanotubes induce photothermal therapy under the guidance of near-infrared imaging[J].Cancer Lett,2016 ,383(2):243.
[18]Neves LF,Krais JJ,Van Rite BD,et al.Targeting single-walled carbon nanotubes for the treatment of breast cancer using photothermal therapy[J].Nanotechnology,2013 ,24(37):375104.
[19]Xi Chen,Bairen Zhu,Anmin Zhang,et al.Electronic Raman Scattering On Individual Semiconducting Single Walled Carbon Nanotubes[J] .Sci Rep,2014,4: 5969.
[20]John R,Shinde DB,Liu L,et al.Sequential electrochemical unzipping of single-walled carbon nanotubes to graphene ribbons revealed by in situ Raman spectroscopy and imaging[J]. ACS Nano,2014,8(1):234.
[21]Gong H,Peng R,Liu Z.Carbon nanotubes for biomedical imaging: the recent advances[J].Adv Drug Deliv Rev,2013,65(15):1951.
[22]Liang G,Xiao L.Gd3+-Functionalized gold nanoclusters forfluore scence-magnetic resonance bimodal imaging[J].Biomater Sci,2017 ,5(10):2122.
[23]Chakraborty S,Babanova S,Rocha RC,et al.A Hybrid DNA-Templated Gold Nanocluster For Enhanced Enzymatic Reduction of Oxygen[J].J Am Chem Soc,2015,137(36):11678.
[24]Wu P,Chen X,Hu N,et al.Biocompatible carbon nanotubes generated by functionalization with glycodendrimers[J].Angew Chem Int Ed Engl,2008,47(27):5022.
[25]Pasquini LM,Hashmi SM,Sommer TJ,et al.Impact of surface functionalization on bacterial cytotoxicity of single-walled carbon nanotubes[J].Environ Sci Technol,2012,46(11):6297.
国家自然科学基金项目(81372900);吉林省科技厅项目(201401010 55JC,20110708);吉林大学2014年交叉创新择优资助项目
*通讯作者
1007-4287(2017)12-2180-05
R780.1
A
2017-01-17)
