pH对污水生物处理中COD荧光法快速表征的影响*
2017-12-25于孝坤吴兆亮
黄 健 于孝坤 张 华 王 坤 张 勇 吴兆亮 张 雄
(水污染控制与废水资源化安徽省重点实验室,安徽建筑大学环境与能源工程学院,安徽 合肥 230601)
pH对污水生物处理中COD荧光法快速表征的影响*
黄 健 于孝坤 张 华#王 坤 张 勇 吴兆亮 张 雄
(水污染控制与废水资源化安徽省重点实验室,安徽建筑大学环境与能源工程学院,安徽 合肥 230601)
采用三维荧光光谱技术研究生物接触氧化工艺处理城市污水的反应过程中色氨酸特征峰荧光强度与COD浓度的相关性,考察了pH对色氨酸特征峰荧光强度与COD浓度间相关性的影响。结果表明,在生物接触氧化工艺的稳定期内,高激发波长类色氨酸和低激发波长类色氨酸特征峰荧光强度与COD浓度呈明显的线性相关关系,相关系数(R2)分别为0.930 4、0.959 3。色氨酸特征峰荧光强度与COD浓度的相关性受pH影响明显,pH为4.0~5.0时相关性较差,R2为0.021 2~0.322 6;pH为6.0~8.0时相关性较好,R2为0.895 9~0.982 2;当pH为9.0~10.0时相关性较差,R2为0.201 5~0.315 8。可见,在pH为6.0~8.0时,可以通过三维荧光光谱技术检测色氨酸特征峰荧光强度来快速分析COD浓度变化。
三维荧光光谱 荧光强度 COD pH 相关性
城市污水中的溶解性有机物(DOM)因来源不同,成分复杂多变[1]。DOM对污水生物可降解性、毒性及污染物迁移转化有着重要影响,而且是加氯消毒副产物的主要前驱物[2],因此,研究DOM组成、变化及去除规律对污水处理有着重要的作用[3]。三维荧光光谱技术由于灵敏度高、监测快速、不需使用化学试剂、不会对环境产生二次污染而广泛应用于地表水、地下水和垃圾渗滤液中DOM的研究中[4-7]。有研究表明,高碳氮废水处理过程中类蛋白特征峰的荧光强度与COD去除率呈负相关[8],但废水pH不同,水体中DOM的组成结构及光谱特征均会随pH的变化而改变[9-10]。为此,本研究利用三维荧光光谱法,以生物接触氧化工艺处理城市污水过程中的DOM为研究对象,探讨生物接触氧化工艺处理城市污水的过程中DOM荧光强度与COD浓度的相关性,并进一步研究不同pH对DOM荧光强度与COD浓度相关性的影响,为污水生物处理工艺中COD的快速无污染检测提供依据。
1 材料和方法
1.1 实验装置及水质
生物接触氧化的实验装置由有机玻璃柱制成,其内径为160 mm,高为380 mm,体积为7.6 L,曝气盘安装在装置底部,内部悬挂弹性立体填料,有效容积为6.0 L,排出比为1/2,整个系统由微电脑控制,可实现自动运行。实验用水为某污水处理厂实际污水,COD为110.00 mg/L,总氮为34.30 mg/L,氨氮为27.13 mg/L,硝酸盐氮为1.90 mg/L,亚硝酸盐氮为0.04 mg/L。
1.2 实验控制及水样采集
整个实验分为挂膜期和稳定期,经过15 d挂膜期后进入稳定期。稳定期反应器每天运行6个周期,每周期4 h,其中进水15 min,曝气223 min,排水2 min。每周期进水量3.0 L,曝气阶段DO维持在3~4 mg/L,水质pH为7.3左右。在稳定周期内进水结束后开始计时,反应0、45、105、165、223 min时取样进行三维荧光光谱分析。
1.3 分析项目及检测方法
COD采用重铬酸盐法测定;pH采用MP512-01型精密pH计测定;三维荧光光谱采用F-7000型荧光分光光度计(HITACHI公司,日本)测定。三维荧光光谱测定时激发波长(Ex)扫描范围为200~450 nm;发射波长(Em)扫描范围为250~550 nm。激发波长、发射波长的狭缝宽度均为5 nm,扫描速度均为2 400 nm/min。
2 结果与分析
2.1 稳定期内DOM荧光强度及其与COD浓度的相关性分析
稳定期内不同反应时间DOM的荧光光谱图如图1所示。
由图1可见,在整个稳定期内荧光光谱上均有5个特征荧光峰,分别为高激发波长类色氨酸荧光峰(峰A),Ex/Em中心位置在280 nm/335 nm附近;低激发波长类色氨酸荧光峰(峰B),Ex/Em中心位置在230 nm/335 nm附近;可见光区类富里酸荧光峰(峰C),Ex/Em中心位置在325 nm/425 nm附近;紫外光区类富里酸荧光峰(峰D、峰E),Ex/Em中心位置分别在290 nm/420 nm、240 nm/420 nm附近[11-12]。随着反应的进行,峰A、峰B的荧光强度逐步降低,峰C、峰D、峰E的荧光强度微弱增加。典型周期内,COD及色氨酸荧光峰强度的变化见图2。由图2可见,在一个稳定周期内,峰A的荧光强度从532.8降至382.1,峰B的荧光强度从668.2降低至495.2,COD质量浓度从55.8 mg/L降至27.6 mg/L,总体看来,色氨酸特征峰的荧光强度与COD浓度变化趋势一致,这是因为COD是衡量水中综合性有机物含量的指标,而DOM则是水中有机物的主要存在形式,DOM中色氨酸的结构不稳定,易被微生物降解,而色氨酸特征峰的荧光强度可以反映蛋白物质的多少[13]。因此,色氨酸特征峰的荧光强度可以间接反映COD浓度的变化。
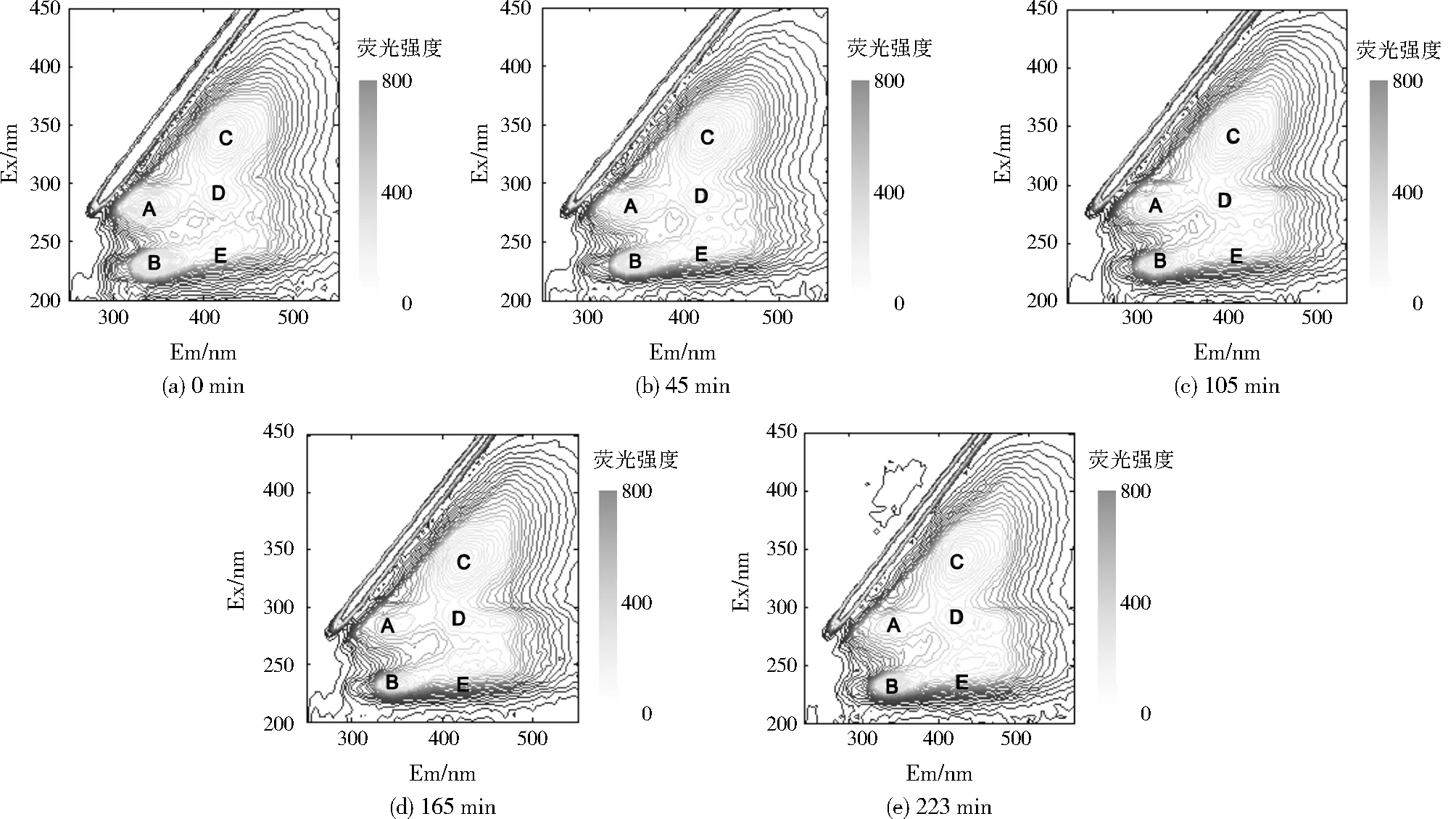
图1 稳定周期内DOM荧光光谱变化Fig.1 Change of fluorescence spectra of DOM in the stable period
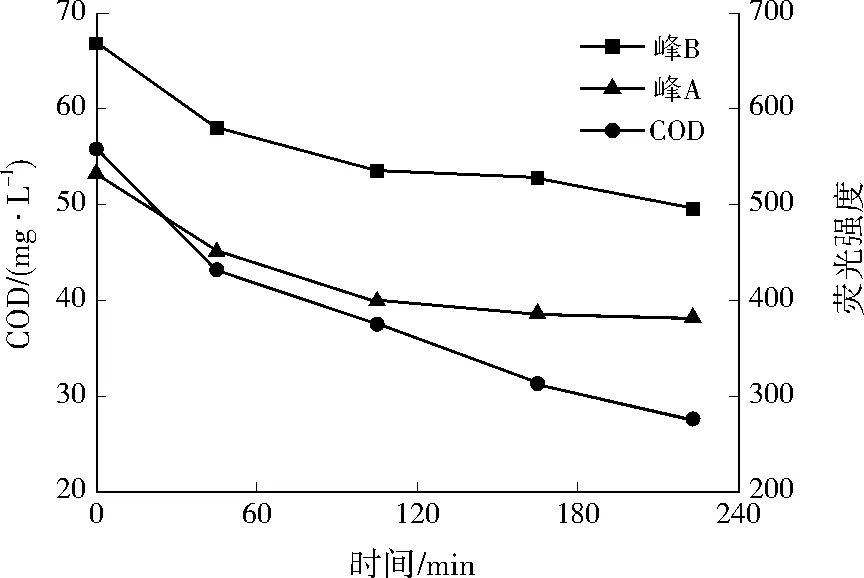
图2 COD及荧光强度的变化Fig.2 Change of COD and fluorescence intensity
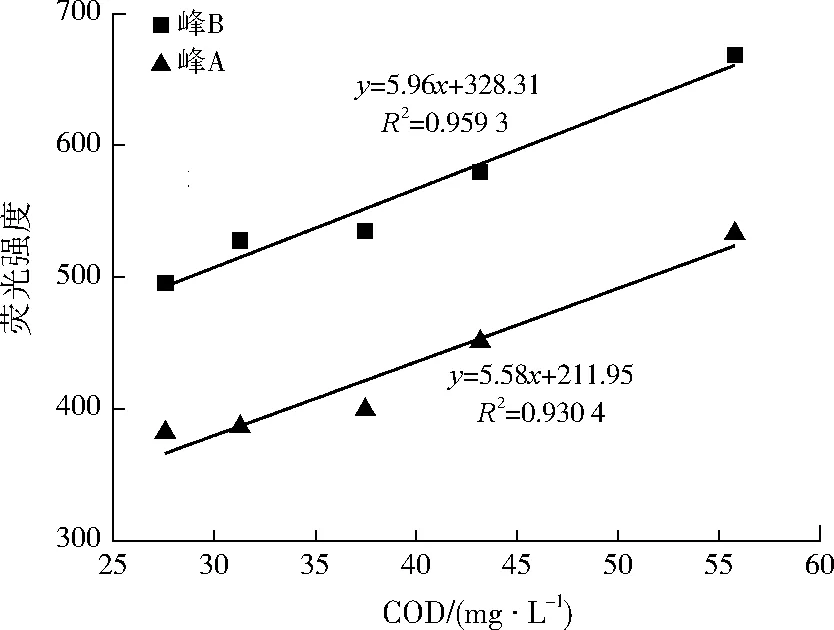
图3 COD与类色氨酸荧光强度的相关性Fig.3 Correlation between COD and tryptophan fluorescence intensity
建立稳定周期内峰A、峰B荧光强度与COD质量浓度的线性关系,结果见图3。由图3可见,稳定周期内COD质量浓度与峰A、峰B荧光强度均呈现较明显的线性关系,其相关系数R2分别为0.930 4、0.959 3,说明在生物接触氧化工艺的稳定期内,可通过三维荧光光谱技术检测高激发波长类色氨酸和低激发波长类色氨酸特征峰荧光强度来快速检测COD浓度。
2.2 pH对色氨酸特征峰荧光强度的影响
调节进水pH分别为4.0、5.0、6.0、7.3、8.0、9.0,考察稳定周期内峰A、峰B荧光强度的变化,结果分别见图4、图5。
由图4、图5可见,当pH由4.0上升到7.3时,峰A、峰B的荧光强度总体均呈增加趋势,随着pH的进一步增加,峰A、峰B的荧光强度逐渐减小。这是因为高激发波长类色氨酸和低激发波长类色氨酸的结构不稳定、易降解,随着pH的增大到7.3,酸性环境减弱,高激发波长类色氨酸和低激发波长类色氨酸分子间和分子内的氢键作用减弱,且DOM中大量阴离子与酚类官能团的排斥作用,使得高激发波长类色氨酸和低激发波长类色氨酸物质分子伸展而呈线性结构,导致荧光强度增加;随着pH的进一步增加,峰A、峰B的荧光强度又呈下降趋势,这主要是因为色氨酸在碱性条件下羟基发生电离,并使其荧光发生猝灭现象,从而使荧光强度下降。可见,pH通过改变有机大分子结构中的酸性基团及自身的分子构型进一步改变荧光光谱谱图[14-16],总体看来,pH在6.0~8.0时,峰A、峰B荧光强度的变化幅度较小。
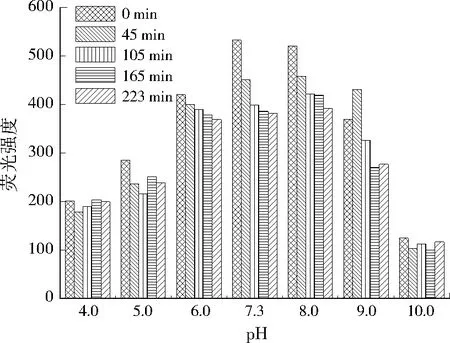
图4 峰A荧光强度随pH变化Fig.4 Change of fluorescence intensity of peak A at different pH
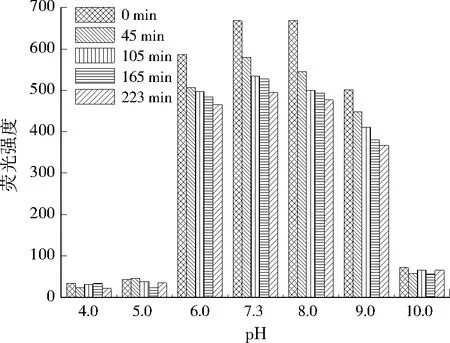
图5 峰B荧光强度随pH变化Fig.5 Change of fluorescence intensity of peak B at different pH
2.3 pH对COD浓度的影响
采用重铬酸盐法测定COD的浓度,不同pH条件下COD浓度变化如图6所示。由图6可见,当pH≤8.0时,COD浓度随pH的增加变化不大;当pH>8.0时,COD浓度随pH的增加而明显增大。因为COD是在强酸性条件下,采用重铬酸钾处理水样时有机物被氧化所产生的消耗量,当pH>8.0时,重铬酸钾在强碱性条件下转化为铬酸钾,氧化性减弱,所消耗氧化剂的量增加,导致水中COD浓度增加。
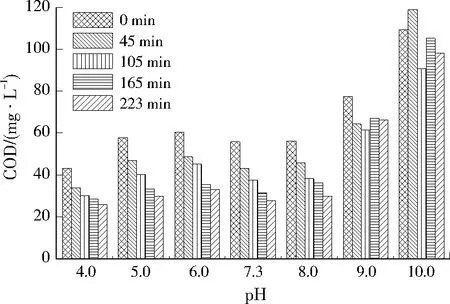
图6 不同pH下COD质量浓度变化Fig.6 Changes of COD mass concentration at different pH
2.4 pH对色氨酸特征峰荧光强度与COD浓度相关性的影响
为了研究三维荧光技术快速无污染测定COD浓度的有效pH范围,以荧光峰强度为因变量(y),COD质量浓度为自变量(x,mg/L),建立不同pH下峰A、峰B荧光强度与COD浓度的线性关系,结果见表1。由表1可见,pH为4.0、5.0时,峰A、峰B荧光强度与COD浓度之间的相关性较低,R2在0.021 2~0.322 6;pH为6.0~8.0时,峰A、峰B荧光强度与COD浓度之间相关性较高,R2在0.895 9~0.982 2;pH为9.0、10.0时,峰A、峰B荧光强度与COD浓度之间的相关性较低,R2在0.201 5~0.315 8。
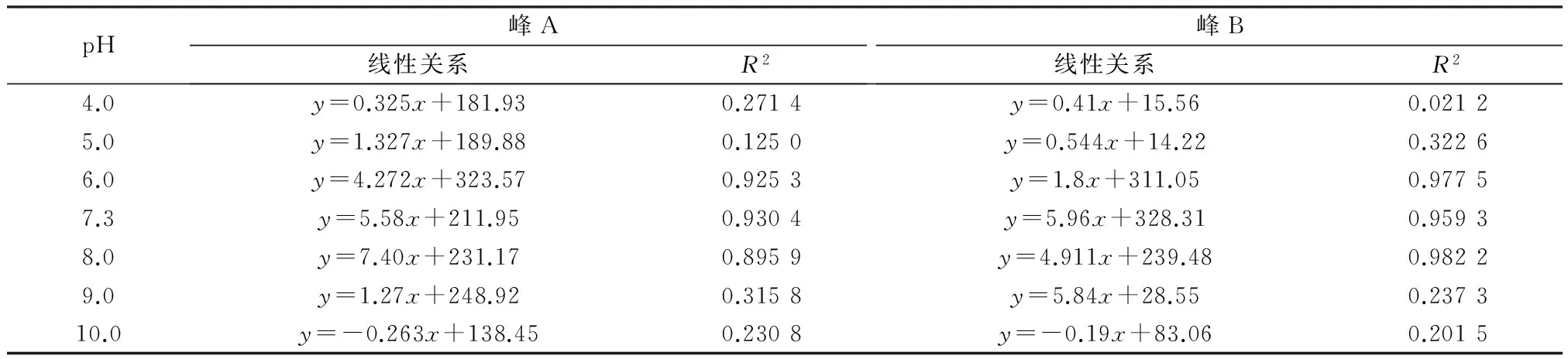
表1 不同pH下峰A、峰B荧光强度与COD质量浓度的线性关系
pH为6.0~8.0时峰A、峰B荧光强度与COD浓度间的相关性最好,这是因为在此pH范围内,峰A、峰B荧光强度与COD浓度变化均不大;pH为4.0、5.0时,峰A、峰B荧光强度大幅减弱而COD浓度增加幅度不大,pH为9.0、10.0时,峰A、峰B荧光强度减弱幅度不大而COD浓度增加幅度较大,导致在这两个pH范围下,峰A、峰B荧光强度与COD浓度相关性较差。研究表明,城市生活污水生物处理的适宜pH为6.0~9.0,此范围内微生物活性较好,当pH低于6.0或高于9.0时,微生物活性较差[17]。因此,在污水生物处理的pH范围内,可以利用三维荧光光谱法快速准确测定COD的浓度。
3 结 论
(1) 在生物接触氧化工艺的稳定期内,COD浓度与色氨酸特征峰荧光强度的变化趋势一致,呈现较好的线性关系,COD浓度与峰A、峰B的相关系数分别为0.930 4、0.959 3。
(2) 在不同pH条件下,色氨酸特征峰荧光强度变化明显。当pH为4.0~8.0时,色氨酸特征峰的荧光强度随着pH的升高而升高,其中pH为6.0~8.0时,色氨酸特征峰荧光强度的变化不大;pH为8.0~10.0时,色氨酸特征峰荧光强度随着pH的升高而减小。
(3) 在不同pH条件下,色氨酸特征峰荧光强度与COD浓度的相关性变化较大。当pH为4.0~5.0时,色氨酸特征峰荧光强度与COD浓度的相关性较低,R2在0.021 2~0.322 6;pH为6.0~8.0时,色氨酸特征峰荧光强度与COD浓度相关性较高,R2在0.895 9~0.982 2;pH为9.0~10.0时,色氨酸特征峰荧光强度与COD浓度的相关性较低,R2约为0.201 5~0.315 8。可见,pH为6.0~8.0时,可通过三维荧光光谱技术测定色氨酸特征峰荧光强度来快速反映工艺运行中COD的浓度变化,解决COD传统化学测量方法存在的耗时长、产生二次污染等问题。
[1] ROCHELLE NEWALL E J,FISHER T R.Chromophoric dissolved organic matter and dissolved organic carbon in Chesapeake Bay[J].Marine Chemistry,2002,77(1):23-41.
[2] ISHII S K L,BOYER T H.Behavior of reoccurring PARAFAC components in fluorescent dissolved organic matter in natural and engineered systems:a critical review[J].Environmental Science & Technology,2016,46(4):2006-2017.
[3] ZHANG H,WANG K,HUANG J,et al.Characterization of dissolved organic matter with intermittent aeration by fluorescence[J].Analytical Letters,2016,49(12):1874-1883.
[4] TANG J,LIANG S,SUN H,et al.Analysis of dissolved organic matters in Fu River of Baoding using three dimensional fluorescence excitation-emission matrix[J].Spectroscopy and Spectral Analysis,2014,34(2):450-454.
[5] 蔡先明,秦侠,张丽,等.催化湿式过氧化氢氧化处理垃圾渗滤液及其DOM光谱分析[J].环境科学学报,2015,35(9):2930-2935.
[6] 杨长明,汪盟盟,马锐,等.城镇污水厂尾水人工湿地深度处理过程中DOM三维荧光光谱特征[J].光谱学与光谱分析,2012,32(3):708-713.
[7] 张华,田纪宇,黄健,等.三维荧光光谱技术对污水处理中溶解性有机物转化过程的分析[J].环境污染与防治,2017,39(4):375-383.
[8] 黄健,王萌,宋箭,等.高碳氮废水处理中有机物的荧光光谱特征分析[J].中国给水排水,2015,31(3):28-31.
[9] 易黎丽,尚丽平,李占锋,等.温度、pH对含油污水荧光特性的影响[J].光谱学与光谱分析,2011,31(6):1571-1573.
[10] 徐慧敏,何国富,象伟宁,等.浓度和离子强度及pH对城市污水3DEEMs特性影响[J].环境科学与技术,2014,37(9):110-115.
[11] 冯伟莹,王圣瑞,张生,等.pH对洱海沉积物-上覆水溶解性有机质荧光特征影响[J].环境化学,2014,33(2):229-235.
[12] MAYER L M,SCHICK L L,LII T C L.Dissolved protein fluorescence in two Maine estuaries[J].Marine Chemistry,1999,64(3):171-179.
[13] 郝瑞霞,曹可心,邓亦文.三维荧光光谱法表征污水中溶解性有机污染物[J].分析实验室,2007,26(10):41-44.
[14] REYNOLDS D M.Rapid and direct determination of tryptophan in water using synchronous fluorescence spectroscopy[J].Water Reseach,2003,37(13):3055-3060.
[15] 赵越,何小松,席北斗,等.介质pH对渗滤液中水溶性有机物荧光光谱特性的影响[J].光谱学与光谱分析,2010,30(2):382-386.
[16] HALL K J,LEE G F.Molecular size and spectral characterization of organic matter in a meromictic lake[J].Water Reseach,1974,8(4):239-251.
[17] 陈茂霞,王欢,周后珍,等.异养硝化-好氧反硝化菌HN-02的筛选及其特性[J].应用与环境生物学报,2013,19(4):688-693.
EffectofpHonCODdetectionbythreedimensionalfluorescencemethodduringwastewaterbiologicaltreatmentprocess
HUANGJian,YUXiaokun,ZHANGHua,WANGKun,ZHANGYong,WUZhaoliang,ZHANGXiong.
(KeyLaboratoryofWaterPollutionControlandWastewaterReuseofAnhuiProvince,SchoolofEnvironmentandEnergyEngineering,AnhuiJianzhuUniversity,HefeiAnhui230601)
The correlation between COD concentration and fluorescence intensity of the tryptophan was researched during biological contact oxidation treatment of urban wastewater treatment using three dimensional fluorescence spectroscopy. In addition,the effects of pH on the correlation between COD concentration and fluorescence intensity of the tryptophan were also studied. The results indicated that obvious correlations were found between COD concentration and the fluorescence intensity of high/low excitation wavelength tryptophan,and the correlation coefficient was 0.930 4 and 0.959 0 respectively. The correlation between COD concentration and the fluorescence intensity of tryptophan was significantly affected by pH. The correlation coefficient (R2) was 0.021 2-0.322 6 when pH was 4.0-5.0;the correlation was better when pH ranged 6.0-8.0,withR2being 0.895 9-0.982 2;the correlation was poor when the pH was 9.0-10.0,withR2being 0.201 5-0.315 8. This study demonstrated that the concentration of COD could be analyzed rapidly by detecting the fluorescence intensity of tryptophan when pH was 6.0-8.0 using three dimensional fluorescence spectroscopy.
three dimensional fluorescence spectrum; fluorescence intensity; COD; pH; correlation
黄 健,男,1980年生,硕士,副教授,主要从事水处理理论与技术研究。#
。
*国家水体污染控制与治理科技重大专项(No.2014ZX07405-003-03);安徽省高校自然科学研究项目(No.KJ2016A817、No.KJ2016JD09);安徽省高校优秀青年人才支持计划重点项目(No.gxyqZD2017059);安徽省高校优秀青年骨干人才国内外访学研修项目(No.gxfx2017054)。
10.15985/j.cnki.1001-3865.2017.12.001
2017-03-03)
