镉对“标准化”背角无齿蚌的急性毒性及脂质过氧化和DNA损伤的影响
2017-12-25陈修报刘洪波苏彦平
陈修报,刘洪波,苏彦平,姜 涛,杨 健
镉对“标准化”背角无齿蚌的急性毒性及脂质过氧化和DNA损伤的影响
陈修报,刘洪波,苏彦平,姜 涛,杨 健*
(中国水产科学研究院淡水渔业研究中心,中国水产科学研究院长江中下游渔业生态环境评价和资源养护重点实验室,江苏 无锡214081)
为了探究“淡水贝类观察”研究体系的专用指示生物“标准化”背角无齿蚌(Anodonta woodiana)对镉(Cd2+)的毒性效应,研究了Cd2+对钩介幼虫(<24 h,平均壳长0.25 mm)、稚蚌(<5 d,平均壳长 0.27 mm)和幼蚌(6 months,平均壳长 50 mm)的急性毒性,并针对Cd2+积累的靶器官——鳃,分析了幼蚌脂质过氧化产物丙二醛(MDA)、成蚌(48 months,平均壳长85 mm)DNA损伤(OTM)对Cd2+的响应特征。结果表明:Cd2+对钩介幼虫 24 h半效应浓度(EC50)为 0.001 8 mg·L-1,对稚蚌和幼蚌 96 h EC50分别为0.004 7、4.5 mg·L-1;Cd2+浓度0.05 mg·L-1和0.5 mg·L-1暴露组MDA含量随时间延长呈降低的趋势,MDA含量变化与Cd2+浓度之间不相关(P>0.05);OTM随暴露时间的延长呈升高的趋势,OTM变化和Cd2+浓度之间表现为显著的线性正相关(p<0.05)。研究认为,钩介幼虫和稚蚌有作为Cd2+的灵敏受试物种的潜力,幼蚌和成蚌适于Cd2+污染的监测与评价,OTM可作为Cd2+污染预警的生物标志物。
“标准化”背角无齿蚌;生活史阶段;镉;急性毒性;生物标志物
我国渔业生态环境的镉(Cd2+)污染形势严峻。《2015年中国渔业生态环境状况公报》指出,我国江河天然重要渔业水域中Cd2+的超标面积为2.1%(约1万hm2),国家级水产种质资源保护区(内陆)Cd2+的超标面积为2.7%(约10万hm2)[1]。因其具有来源广、积蓄性、难以降解、易于沿食物链发生生物放大作用等特点,成为对水生生物和人类危害最大的污染物之一[2]。因此,对Cd2+的有效监测和毒性评价研究刻不容缓。
背角无齿蚌(Anodonta woodiana)具有营底栖生活、地理分布广泛、对污染物的高富集性和低代谢性、污染物积累量与水环境中污染物含量简单相关等特点[3-4],被筛选为“淡水贝类观察”研究体系的专用指示生物[3]。基于采集野生背角无齿蚌[3,5-6]及移殖“标准化”背角无齿蚌(人工繁育的生物因子相同、遗传质量稳定、污染本底值低)[7-8],已成功监测水环境Cd2+等重金属的污染状况。移殖监测在显示指示物可比性强、可以按照监测的需求被移殖到任何水域、能够反映污染时间动态等优势的同时,也存在贝类死亡率从0~100%巨大差异的制约因素[9],这可能与贝类所处的生长阶段不同以及水域环境条件之间的差别(如重金属含量不同)有关。因此,有必要弄清不同生活史阶段的“标准化”背角无齿蚌对Cd2+等重金属的耐受性。
应用生物标志物有望对重金属污染起到早期预警作用。研究初步显示,贝类的脂质过氧化产物丙二醛(MDA)[10-11]和 DNA 损伤[12-13]对 Cd2+的响应较为快速、灵敏。邢慧芳等[11]用Cd2+对背角无齿蚌进行96 h暴露,鳃和外套膜中MDA含量呈升高趋势;Kolarevic′等[13]发现背角无齿蚌的血细胞DNA损伤(以Olive尾矩表示,OTM)能够反映出自然水体Cd2+的季节性变化动态。然而,这些研究仅局限于野生的背角无齿蚌成蚌。
针对上述问题,本研究拟在前人报道背角无齿蚌成蚌及鳃MDA对Cd2+毒性效应的基础上[11],就Cd2+对“标准化”背角无齿蚌的钩介幼虫、稚蚌和幼蚌的急性毒性开展研究,进而以鳃(Cd2+积累的关键靶器官[14-15])作为研究对象,探索在移殖监测中被广泛选用的“标准化”背角无齿蚌幼蚌/成蚌[7-8]对Cd2+的MDA、OTM响应特征。以期为渔业生态环境Cd2+污染的移殖监测、早期预警,以及淡水贝类资源保护提供支撑。
1 材料与方法
1.1 材料
不同生活史阶段的“标准化”背角无齿蚌,包括钩介幼虫(<24 h,平均壳长 0.25 mm)、稚蚌(<5 d,平均壳长0.27 mm)、幼蚌(6月,平均壳长50 mm)和成蚌(48月,平均壳长85 mm),均来自中国水产科学研究院淡水渔业研究中心南泉实验基地,其人工繁养方法、水环境条件见参考文献[16-17]。挑选出发育成熟的母蚌,用针筒冲洗出外鳃中孕育的钩介幼虫。以黄颡鱼(Pelteobagrus fulvidraco)为宿主鱼,每条宿主鱼寄生的钩介幼虫达1672±787个(平均值±标准差,下同;n=6),变态成功率达(53.3±12.1)%,选取脱落高峰期的稚蚌进行流水培育和池塘吊养,进而生长发育为幼蚌和成蚌。
氯化镉(CdCl2)为分析纯,国药集团化学试剂有限公司生产。总蛋白和MDA用南京建成生物工程研究所提供的试剂盒进行测定。聚乙二醇辛基苯基醚(Triton X-100)、二甲基亚砜(DMSO)、三羟甲基氨基甲烷(Tris)、乙二胺四乙酸二钠(Na2EDTA)和溴化乙锭(EB)等来自上海生工生物工程有限公司。
1.2 急性毒性实验
鉴于我国尚缺乏淡水贝类的毒性实验标准,因此,本研究参照在业内被广泛认可的美国标准方法“Standard guide for conducting laboratory toxicity tests with freshwater mussel”(ASTM E2455-06)[18]进行 Cd2+的急性毒性研究。
1.2.1 钩介幼虫的急性毒性
钩介幼虫的成活率大于90%方可用于暴露实验。检测成活率的方法:吸取约100只钩介幼虫放入盛有2 mL去离子水的培养皿中,加一滴NaCl饱和溶液,并在1 min内记录开壳和闭壳钩介幼虫的数量。加入NaCl溶液后,闭壳的钩介幼虫定义为存活的个体,而加入NaCl溶液前闭壳的及加入NaCl溶液后开壳的钩介幼虫定义为死亡个体。存活率的计算:
存活率=(加NaCl后闭壳的钩介幼虫数量-加NaCl前闭壳的钩介幼虫数量)/钩介幼虫总数×100%
根据预实验结果,用人工配制软水(表1)[18]设定5 个 Cd2+浓度梯度,依次为 2.5、5.0、10、20、40 μg·L-1,对照组和实验组各设置3个平行。用500 mL玻璃培养皿作实验容器,实验液200 mL,每个培养皿各加入约1000个钩介幼虫。将培养皿置于智能光照培养箱中(PGX-250A,无锡沃信仪器有限公司),水温保持在 20±1℃,16 h光照,8 h黑暗,光照强度 1000 lx,溶解氧(DO)大于 5.0 mg·L-1。实验持续 24 h,并于 6 h 和24 h分别取约100个钩介幼虫进行检查。
1.2.2 稚蚌的急性毒性
将稚蚌暂养48 h后用于实验。在5 min之内,斧足伸出运动的稚蚌定义为活蚌,否则即认为是死亡个体。稚蚌存活率的计算:

根据预实验结果,以人工配制软水设定5个Cd2+浓度梯度,依次为 2.5、5.0、10、20、40 μg·L-1,设置 4个平行。用500 mL玻璃培养皿作实验容器,实验液200 mL,每个培养皿加入5个稚蚌,每48 h更换75%的实验液以保持Cd2+浓度稳定,实验期间不投饵。实验条件同1.2.1,于48 h和96 h分别检查各组稚蚌的成活率。实验期间要求对照组的成活率大于90%。
1.2.3 幼蚌的急性毒性
将幼蚌暂养48 h后用于实验。美国标准中判别幼蚌死亡的方法同上述稚蚌[18]。然而,背角无齿蚌幼蚌具有将斧足缩在贝壳内保持长时间不运动的特殊习性,遇到外界刺激更是采取紧闭双壳的保护措施[19],且贝壳不再透明无法看到内部斧足是否运动[17],所以该判别方法对背角无齿蚌幼蚌是无效的。针对此问题,本研究提出以幼蚌双壳张开(包括双壳闭合但用开壳器打开后不能恢复闭壳),用玻璃棒刺激不闭壳为死亡标准,即:
存活率=(幼蚌总数-双壳张开且刺激不闭壳的幼蚌数量)/幼蚌总数×100%
根据预实验结果,用人工配制软水设定0.625、1.25、2.5、5.0、10 mg·L-1的 Cd2+浓度梯度,设置 4 个平行。实验于贝类重金属暴露系统(上海海圣水族设备厂)中进行,向10 L一次成型的玻璃缸加入实验液2 L,每个玻璃缸加入5个幼蚌,于48 h更换75%的实验液以保持Cd2+浓度稳定,实验期间不投饵。其他实验条件同1.2.1,于48 h和96 h分别检查各组幼蚌的成活率。实验期间要求对照组的成活率大于90%。
1.3 幼蚌鳃脂质过氧化测定
根据Cd2+对幼蚌的安全浓度即96 h半效应浓度(EC50)×0.1[20],设计 3 个 Cd2+浓度梯度 0.005、0.05、0.5 mg·L-1,以人工配制软水为对照组,各设置3个平行。实验条件同1.2.3,于0、48 h和96 h分别从各浓度组取3只蚌。解剖分离出幼蚌的鳃,按质量体积比为1∶9加4℃预冷的生理盐水制备成10%的组织匀浆。匀浆液于 4℃,2500 r·min-1,离心 10 min获取上清液,用总蛋白定量测试盒(BCA法)测定总蛋白含量。匀浆液于95℃水浴80 min,流水冷却后4000 r·min-1离心10 min获取上清液,用MDA测试盒(TBA法)测定MDA含量。
1.4 成蚌鳃DNA损伤测定
根据 Cd2+对成蚌的 96 h EC50为 134.9 mg·L-1[11],即安全浓度为13.5 mg·L-1,设计3个Cd2+浓度梯度2.5、5.0、10 mg·L-1,以人工配制软水为对照组,各设置3个平行。实验条件同1.2.3,于0、48 h和96 h分别从各浓度组取3只蚌。
参考Singh等[21]的方法测定DNA损伤:调整细胞浓度约1×105cell·mL-1,将单细胞悬液与0.7%低熔点琼脂糖按1∶10混合均匀后,取75 μL均匀加入到彗星分析专用载玻片(3-Well Comet Slides,美国Cell Biolabs)的凹槽中;于裂解液(100 mmol·L-1Na2EDTA,2.5 mol·L-1NaCl,10 mmol·L-1Tris,用 NaOH 调节 pH为10,临用前加10%的DMSO和l%的Triton X-100)中裂解 2 h;再用碱性电泳液(300 mmol·L-1NaOH,1 mmol·L-1Na2EDTA,pH 值为 13)解旋 30 min,调节电压为 25 V、电流为 300 mA,电泳 20 min(DYY-6,北京六一仪器厂),中和(0.4 mol·L-1Tris,pH 值为 7.5)2 次后,用 75%乙醇固定,最后用 2 μg·mL-1EB染色 20 s。在荧光显微镜(BX51,日本 Olympus)的 515~560 nm的激发光下,放大200倍,每组随机观察30个细胞并拍照。用CASP彗星图像分析软件测定Olive尾矩(OTM),OTM=(尾部密度重心-头部密度重心)/尾部DNA含量[22]。

表1 人工配制软水的配制方法及水质指标Table 1 Quantities of chemicals required to prepare reconstituted soft water and the resulting water qualities
1.5 统计分析
用SPSS 16.0统计软件进行数据分析。采用概率单位分析(Probit Analysis)计算 EC50[23]。采用单因素方差分析(One-way ANOVA)对MDA含量和OTM进行组间差异性分析,p<0.05表示差异水平显著。用Pearson等级相关系数分析MDA含量、OTM与Cd2+浓度之间的相关性,并回归分析变量之间的关系[24]。
2 结果与讨论
2.1 不同生活史阶段的背角无齿蚌对Cd2+的敏感性
不同时间点,各浓度Cd2+暴露下钩介幼虫、稚蚌和幼蚌的死亡率见表2。受到Cd2+胁迫,钩介幼虫表现出聚集成团的趋势,稚蚌和幼蚌则表现为活动能力减弱、软组织粘液分泌增加,直至双壳张开而死亡。Cd2+对钩介幼虫 6、24 h的 EC50分别为 0.033 8、0.001 8 mg·L-1;对稚蚌 48、96 h 的 EC50分别为 0.007 5、0.0047 mg·L-1;对幼蚌96h的EC50为4.5mg·L-1(表2)。
Cd2+对生物体的毒性机制包括镉-蛋白质互作、镉-钙互作、镉-基因表达互作、氧化损伤和DNA损伤[25]。因此,暴露于Cd2+中的“标准化”背角无齿蚌发生了行为改变,并且死亡率明显增加。
钩介幼虫是淡水蚌类生活史中特有的阶段。背角无齿蚌的钩介幼虫由壳(包含壳钩)、外套膜、闭壳肌和足丝等简单器官构成,尚不能够独立存活(需寄生到鱼体完成变态发育)[16]。因此,本研究对钩介幼虫最长只进行了24 h的暴露,与Liu等[26]研究一致。“标准化”背角无齿蚌钩介幼虫对Cd2+特别敏感,24 h EC50(0.001 8 mg·L-1)明显低于同为无齿蚌属的Anodonta anatine钩介幼虫[27](24 h EC50约为0.75 mg·L-1)、淡水沟贝钩介幼虫[23](24hEC50大于0.008mg·L-1),以及毒理学常用试验物种大型蚤(Daphnia magna),其在pH为7.0时的24 h EC50为0.42 mg·L-1[28]。这可能是由于前者为有钩型且壳钩粗壮[16],遇到Cd2+的胁迫无法闭紧双壳,从而难以发挥贝类解毒机制第一道防线(闭紧双壳)[29]的保护作用。值得注意的是,Cd2+对“标准化”背角无齿蚌钩介幼虫的24 h EC50还低于我国渔业水质标准(GB 11607—1989)规定的 Cd2+限量(0.005 mg·L-1)[30],提示我国现行的渔业水质标准似乎无法对其进行有效保护。这可能是我国背角无齿蚌资源量锐减[17]的一个重要原因,同时也表明它有潜力作为Cd2+水质标准研究的受试物种。鉴于钩介幼虫的规格较小(平均壳长为256 μm[16]),在自然水域中难以采集[29],通过人工培育或采集野生的孕育母蚌,从而获取足够的成熟钩介幼虫作为受试生物,已被尝试应用于渔业水质基/标准的修订[23]。
稚蚌已具有独立存活能力,但是其对外界胁迫仍很敏感[16]。“标准化”背角无齿蚌稚蚌对Cd2+的敏感性明显高于其他水生生物,如淡水沟贝稚蚌(5 d)对Cd2+毒性的 48 h EC50为 0.042 mg·L-1,96 h EC50为 0.016 mg·L-1,分别是背角无齿蚌稚蚌的5倍和3倍以上[23];花鲢(Aristichthys nobills)仔鱼(10 h)、幼鱼(10 d)和鱼苗(50 d)对 Cd2+的 96 h LC50分别为 0.24、0.54、2.25 mg·L-1[31]。这可能是由两方面原因造成的:一是刚脱落的背角无齿蚌稚蚌的壳钩尚未退化完全,稚蚌和钩介幼虫一样不能紧闭双壳,从而无法阻止水体中Cd2+通过滤水和渗透进入体内;二是鳃此时还处于鳃原基阶段[17],不能高效积累Cd2+。值得注意的是,Cd2+对“标准化”背角无齿蚌稚蚌的96 h EC50(0.004 7 mg·L-1)依然低于我国渔业水质标准规定的Cd2+限量[30],提示我国现行的渔业水质标准似乎无法有效保护稚蚌。利用稚蚌对Cd2+等重金属的敏感性特点,人工繁育的稚蚌被尝试用作受试生物,以探索建立渔业水质Cd2+等污染物限量的新标准[23,32]。

表2 镉对不同生活史阶段“标准化”背角无齿蚌的死亡率(Mean±SD)和半效应浓度Table 2 Mortality rate(Mean±SD)and median effect concentrations(EC50)in acute toxicity tests with Cd2+for“standardized”Anodonta woodiana at different life stages
“标准化”背角无齿蚌幼蚌生长到60 d以后,外部形态已接近成体,内部器官包括鳃、斧足、内脏团、心脏、肠道等也已发育完全[17]。因此,幼蚌对Cd2+的耐受性比钩介幼虫、稚蚌显著增加(表1),也高于淡水沟贝幼蚌(6 months)对Cd2+的耐受性[23](96 h EC50为0.199 mg·L-1)。随着背角无齿蚌的生长,其对 Cd2+的耐受性也会进一步增强,如成蚌对Cd2+的96 h EC50可高达134.9 mg·L-1[11]。这与背角无齿蚌解毒功能的完善是分不开的。首先,幼蚌/成蚌能够紧闭双壳,通过减少滤水率和呼吸率以阻止对水体中Cd2+的吸收[19,29];其次,它们能够产生大量的金属硫蛋白与Cd2+络合[33],大幅度降低体内Cd2+的毒性[29]。这提示“标准化”背角无齿蚌发育到幼蚌以后便适宜用于渔业生态环境Cd2+的污染监测。笔者课题组之前的研究显示[3],背角无齿蚌成蚌对Cd的积累可高达53 μg·g-1。
值得注意的是,由于我国目前尚无淡水贝类的毒性实验标准,基于淡水贝类开展的毒理学研究的实验条件尚不统一,如实验用水的选择就分为曝气自来水[11,33]、去离子水[34]和人工配制水[26]等。而 Cd2+等重金属对水生生物的毒性,会受到水体的硬度、温度、pH值和溶解性有机物含量等理化因子的影响[28,34-35],从而难以准确掌握它们的毒性及受试生物的敏感性。鉴于此,可以参考美国的相关标准(ASTME2455-06)[18],并结合我国本土物种的特点和水质因子状况,建立较为标准的基于淡水贝类的毒理学实验规范,以有效保护我国淡水贝类资源。
2.2 Cd2+对幼蚌鳃MDA含量的影响
不同浓度Cd2+暴露48、96 h均对幼蚌鳃MDA产生了明显影响(图 1)。MDA 最高值(27.7 nmol·mg-1)出现在0.005 mg·L-1暴露48 h的组别,而最低值(0.3 nmol·mg-1)出现在 0.05 mg·L-1暴露 96 h 的组别。随着时间的延长,0.05 mg·L-1和 0.5 mg·L-1暴露组 MDA含量变化呈现降低的趋势,各组别MDA含量变化与Cd2+浓度之间不相关(P>0.05)。
脂质过氧化发生在生物膜上,是Cd2+等有毒物质诱导细胞内活性氧(ROS)增加,氧自由基攻击多不饱和脂肪酸(PUFA)的一种不断加合重复的化学反应,产生的MDA含量能够反映Cd2+对机体的损伤程度[10]。
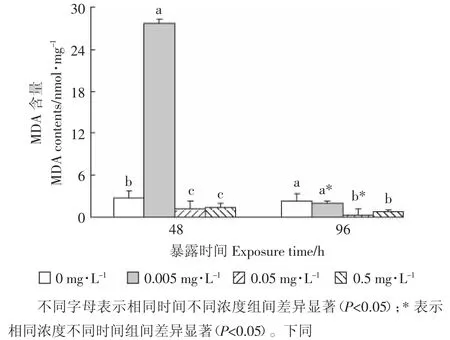
图1 镉对“标准化”背角无齿蚌幼蚌鳃MDA含量的影响Figure 1 Impact of Cd2+on MDA contents in gills of“standardized”Anodonta woodiana juveniles
本研究显示除了低浓度组(0.005 mg·L-1)的MDA呈现“诱导-抑制”的变化规律之外,其他组别总体上表现为抑制作用(图1)。这应该与“毒物兴奋效应”(Hormesis)有关,即低剂量化学物对生物体代谢表现为促进效应,而高剂量时表现为抑制作用[36]。“标准化”背角无齿蚌幼蚌MDA的这种变化趋势与海洋贻贝 Bathymodiolus azoricus[10]和褶纹冠蚌(Cristaria plicata)[37]类似,却有别于背角无齿蚌成蚌对Cd2+毒性响应为MDA含量不断升高[11]。这可能是由于暴露成蚌的Cd2+浓度很高(浓度梯度为 4.22、8.43、16.82、33.7、67.45 mg·L-1)[11],致使其抗氧化系统遭到破坏,超出了自我恢复能力。而本研究中暴露幼蚌的Cd2+浓度相对较低,有机体能够发挥“毒物兴奋效应”功能,表现为尽快修复胁迫引起的损伤,并保护生物体在其后的胁迫中免受或少受伤害[36]。也许正因为如此,幼蚌MDA含量和Cd2+浓度之间没有表现出明显的“剂量-效应”关系。
2.3 Cd2+对成蚌鳃DNA损伤的影响
图2为CASP软件分析Cd2+诱导成蚌鳃细胞DNA损伤的彗星图像。对比图片可以看出,Cd2+暴露对成蚌鳃细胞DNA产生明显的损伤作用。随着暴露时间的延长、Cd浓度的增加,OTM均呈现升高的趋势(图3)。暴露48 h和96 h,OTM变化和Cd2+浓度之间均表现为显著的线性正相关(p<0.05,图4)。
OTM综合了距离类和强度类指标,比彗星长度、彗尾长度、尾部DNA含量等单一指标能更灵敏、精确和全面地反映DNA的损伤程度[13,22],被广泛应用于海、淡水贝类对重金属如Cd2+的污染监测和毒性评价[13,38]。

图2 CASP软件分析Cd2+暴露“标准化”背角无齿蚌96 h的鳃细胞DNA损伤的彗星图像(×200)Figure 2 CASP software analyze comet images of DNA damage in gill cells of“standardized”Anodonta woodiana adults induced by Cd2+for 96 h(×200)
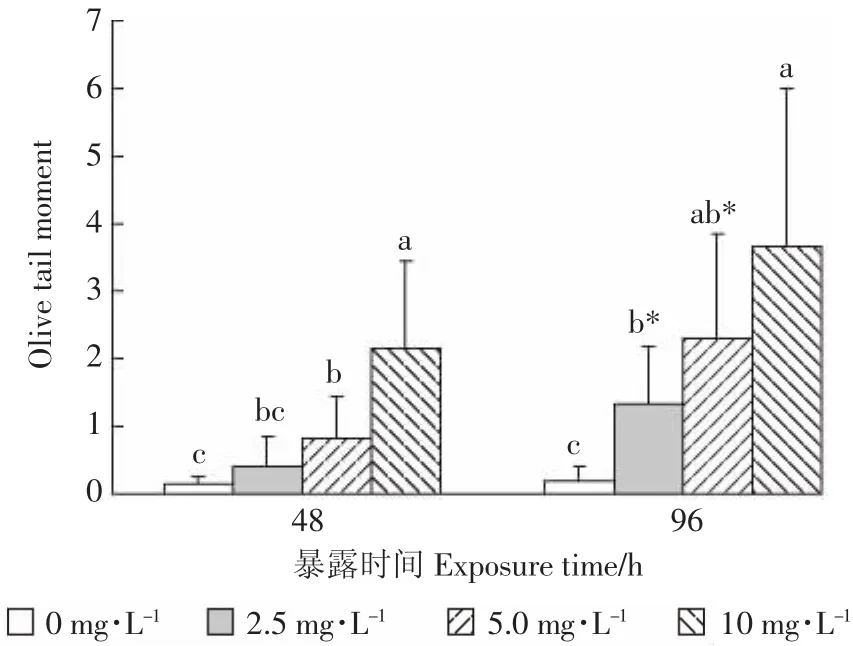
图3 镉对“标准化”背角无齿蚌成蚌鳃细胞DNA损伤(OTM)的影响Figure 3 Impact of Cd2+on DNA damage(OTM)in gills of“standardized”Anodonta woodiana adults
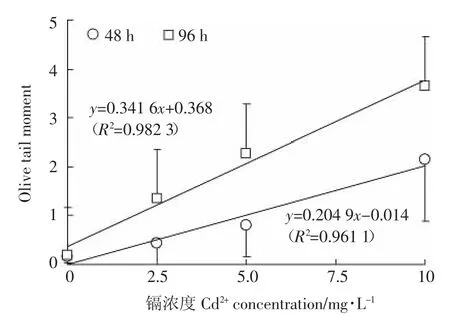
图4 “标准化”背角无齿蚌成蚌鳃细胞DNA损伤(OTM)与Cd2+浓度之间的关系Figure 4 Relationships between DNA damage(OTM)in gills of“standardized”Anodonta woodiana adults and Cd2+concentrations
“标准化”背角无齿蚌成蚌鳃细胞的OTM随着Cd2+暴露时间的延长而呈现明显的升高趋势(图3),且表现出显著的“剂量-效应”关系(图4)。这和斑马贻贝(Dreissena polymorpha)鳃细胞 OTM[38]及铜锈环棱螺(Bellamya aeruginosa)肝胰腺 OTM[34]对 Cd2+的响应趋势相一致,却有别于背角无齿蚌血细胞OTM对Cd2+不存在明显的“剂量-效应”关系(r=0.306,P=0.309 3)[13],初步显现了背角无齿蚌的鳃细胞可能比血细胞对Cd2+毒性更为灵敏。因为无齿蚌鳃是Cd2+积累的最重要的靶器官[14-15],而血液在循环过程中可能会将Cd2+运输至其他器官,从而稀释了血细胞中Cd2+的含量[39]。尽管如此,在今后的研究中还需通过同步比较、分析鳃细胞和血细胞OTM对Cd2+的响应特征来验证,同时表明成蚌鳃的OTM可以用作Cd2+污染评价、预警的生物标志物。根据Cd2+暴露96 h的“剂量-效应”的线性方程y=0.341 6x+0.368(图4)和我国渔业水质标准(GB 11607—1989)规定的Cd2+限量(0.005 mg·L-1)[30],初步得出 OTM 值达到 0.37 可作为水体Cd2+污染预警的参考阈值。值得注意的是,Cd2+对水生生物的毒性还与水体的理化因子密切相关[28,34-35]。因此,在利用OTM作为生物标志物监测自然水体Cd2+污染动态前,还需进一步探索这些环境因子对Cd2+致OTM变化的影响。
3 结论
(1)“标准化”背角无齿蚌的钩介幼虫和稚蚌对Cd2+特别敏感,具有作为受试物种完善渔业水质标准中Cd2+限量的潜力,而幼蚌和成蚌对Cd2+的耐受性强,适宜用于Cd2+污染的移殖监测。
(2)在 0.05 mg·L-1和 0.5 mg·L-1Cd2+暴露组中,幼蚌鳃MDA含量随着暴露时间的延长呈现降低的趋势,但是鳃MDA含量与Cd2+之间没有明显的“剂量-效应”关系。
(3)成蚌鳃细胞OTM随着Cd2+暴露时间的延长呈现升高的趋势,且与Cd2+之间具有显著的“剂量-效应”关系。鳃细胞OTM适宜作为渔业生态环境Cd2+污染的早期预警的生物标志物。
[1]农业部,环境保护部.2015年中国渔业生态环境状况公报[R].北京.Ministry of Agriculture,Ministry of Environmental Protection.Report on the state of the fishery eco-environment in China[R].Beijing,2015.
[2]Campbell P G C.Cadmium-a priority pollutant[J].Environmental Chemistry,2006(3):387-388.
[3]Liu H B,Yang J,Gan J L.Trace element accumulation in bivalves Anodonta woodiana from the Taihu Lake,China[J].Archives of Environmental Contamination and Toxicology,2010,59(4):593-601.
[4]Spyra A,Jędraszewska N,Strzelec M,et al.Further expansion of the invasive mussel Sinanodonta woodiana(Lea,1834)in Poland-establishment of a new locality and population features[J].Knowledge and Management of Aquatic Ecosystems,2016,DOI:10.1051/kmae/2016028.
[5]Królak E,Zdanowski B.The bioaccumulation of heavy metals by the mussels Anodonta woodiana(Lea,1834) and Dreissena polymorpha(Pall.)in the heated Konin Lakes[J].Archives of Polish Fisheries,2001,9:229-237.
[6]陈修报,苏彦平,孙 磊,等.不同污染背景生境中背角无齿蚌的重金属积累特征[J].农业环境科学学报,2013,32(5):1060-1067.CHEN Xiu-bao,SU Yan-ping,SUN Lei,et al.Bioaccumulation characteristics of heavy metals in bivalve Anodonta woodiana from different habits with different pollution background[J].Journal of Agro-Environment Science,2013,32(5):1060-1067.
[7]陈修报,苏彦平,刘洪波,等.移殖“标准化”背角无齿蚌监测五里湖重金属污染[J].中国环境科学,2014,34(1):225-231.CHEN Xiu-bao,SU Yan-ping,LIU Hong-bo,et al.Biomonitoring of heavy metal pollution in Wulihu Bay of Taihu Lake by transplanting“standardized”Anodonta woodiana[J].China Environmental Science,2014,34(1):225-231.
[8]孙 磊,陈修报,苏彦平,等.东湖移殖背角无齿蚌中重金属的含量变化[J].水生生物学报,2014,38(1):203-208.SUN Lei,CHEN Xiu-bao,SU Yan-ping,et al.Variation of heavy metal contents in swan mussels(Anodonta woodiana)transplanted into Donghu Lake[J].Acta Hydrobiologica Sinica,2014,38(1):203-208.
[9]Bervoets L,Voets J,Covaci A,et al.Use of transplanted zebra mussels(Dreissena polymorpha)to assess the bioavailability of microcontaminants in Flemish surface waters[J].Environmental Science and Technology,2005,39:1492-1505.
[10]Company R,Serafim A,Cosson R,et al.Temporal variation in the antioxidant defence system and lipid peroxidation in the gills and mantle of hydrothermal vent mussel Bathymodiolus azoricus[J].Deep-sea Research Part I,2006,53:1101-1116.
[11]邢慧芳,李涌泉,杨慧珍,等.镉对背角无齿蚌外套膜和鳃抗氧化酶活性及脂质过氧化的影响[J].环境科学学报,2013,33(3):856-860.XING Hui-fang,LI Yong-quan,YANG Hui-zhen,et al.Effects of cadmium on antioxidant enzyme activities and lipid peroxidation in the mantle and gill of the freshwater bivalve A.woodiana woodiana[J].Acta Scientiae Circumstantiae,2013,33(3):856-860.
[12]吴 伟,杨 健,瞿建宏,等.太湖背角无齿蚌组织中8-羟基脱氧鸟苷的含量及在水体污染评价中的初步应用[J].生态环境学报,2010,19(1):1-5.WU Wei,YANG Jian,QU Jian-hong,et al.Level of 8-hydroxy-2-deoxyguanosine in swan mussels Anodonta woodiana from Taihu Lake and its preliminary application to assess water pollution[J].Ecology and Environmental Sciences,2010,19(1):1-5.
[13]Kolarevic′S,Kneževic′-Vukcˇevic′J,Paunovic′M,et al.Monitoring of DNA damage in haemocytes of freshwater mussel Sinanodonta woodiana sampled from the Velika Morava River in Serbia with the comet assay[J].Chemosphere,2013,93:243-251.
[14]李 威,杨 健,陈修报,等.背角无齿蚌组织中的元素分布研究[J].农业环境科学学报,2010,29(3):597-603.LI Wei,YANG Jian,CHEN Xiu-bao,et al.The distribution of elements in the tissues of mussel Anodonta woodiana[J].Journal of Agro-Environment Science,2010,29(3):597-603.
[15]Sohail M,Khan M N,Qureshi N A,et al.Monitoring DNA damage in gills of freshwater mussels(Anodonta anatina)exposed to heavy metals[J].Pakistan Journal of Zoology,2017,49(1):305-311.
[16]陈修报,杨 健,闻海波,等.椭圆背角无齿蚌发育关键阶段形态结构以及寄生有效积温的研究[J].南京农业大学学报,2010,33(4):100-104.CHEN Xiu-bao,YANG Jian,WEN Hai-bo,et al.Studies on the morphology of Anodonta woodiana elliptica at several important developmental stages and its effective temperature sum during parasitism[J].Journal of Nanjing Agricultural University,2010,33(4):100-104.
[17]Chen X B,Liu H B,Su Y P,et al.Morphological development and growth of the freshwater mussel Anodonta woodiana from early juvenile to adult[J].Invertebrate Reproduction and Development,2015,59(3):131-140.
[18]American Society for Testing and Materials.Standard guide for conducting laboratory toxicity tests with freshwater mussels[S].E2455-06.2009.
[19]Liu H B,Chen X B,Kang I J,et al.The valve movement response of three freshwater mussels Corbicula fluminea Müller 1774,Hyriopsis cumingii Lea 1852,and Anodonta woodiana Lea 1834 exposed to copper[J].Hydrobiologia,2016,770:1-13.
[20]赵艳芳,宁劲松,翟毓秀,等.栉孔扇贝不同组织中镉的微区分布特征及其变化规律[J].水产学报,2016,40(8):1023-1030.ZHAO Yan-fang,NING Jin-song,ZHAI Yu-xiu,et al.Research on the subcellular fate and transformation of cadmium in different tissues of the scallop Chlamys farreri[J].Journal of Fisheries of China,2016,40(8):1023-1030.
[21]Singh N P,McCoy M T,Tice R R,et al.A simple technique for quantitation of low levels of DNA damage in individual cells[J].Experimental Cell Research,1988,175(1):184-191.
[22]Końca K,Lankoff A,Banasik A,et al.A cross-platform public domain PC image-analysis program for the comet assay[J].Mutation Research,2003,534:15-20.
[23]Wang N,Ingersoll C G,Ivey C D,et al.Sensitivity of early life stages of freshwater mussels(unionidae) to acute and chronic toxicity of lead,cadmium,and zinc in water[J].Environmental Toxicology and Chem-istry,2010,29(9):2053-2063.
[24]周 侃,欧阳珊,吴小平,等.SCGE技术检测镉对背角无齿蚌血细胞 DNA 的损伤[J].生态科学,2008,27(2):90-94.ZHOU Kan,OUYANG Shan,WU Xiao-ping,et al.Detection of DNA damages in hemocytes of A.woodiana woodiana induced by cadmium with single cell gel electrophoresis assay[J].Ecological Science,2008,27(2):90-94.
[25]吴 微,胡 佳,周宜开.镉的毒性机理及其作用机制[C].中国环境科学学会学术年会论文集,2014:6075-6078.WU Wei,HU Jia,ZHOU Yi-kai.Toxic mechanism of cadmium and its effect[C].Academic Essays of Chinese Society for Environmental Sciences,2014:6075-6078.
[26]Liu H B,Chen X B,Su Y P,et al.Effects of calcium and magnesium ions on acute copper toxicity to glochidia and early juveniles of the Chinese pond mussel Anodonta woodiana[J].Bulletin of Environmental Contamination and Toxicology,2016,97:504-509.
[27]Hanstén C,Heino M,Pynnönen K.Viability of glochidia of Anodonta anatine(Unionidae)exposed to selected metals and chelating agents[J].Aquatic Toxicology,1996,34(1):1-12.
[28]曲瑞娟.不同环境条件下镉对几种水生生物的毒性研究[D].南京:南京大学,2015.QU Rui-juan.The toxicity of cadmium to several aquatic organisms under different environmental conditions[D].Nanjing:Nanjing University,2015.
[29]Farris J L,Hassel J H V.Freshwater bivalve ecotoxicology[C].Boca Raton,Florida:CRC Press,and Pensacola,Florida,SETAC Press,2007.
[30]环境保护部.GB 11607—1989渔业水质标准[S].北京:中国标准出版社,1989.Ministry of environmental protection of the people′s republic of China.GB 11607—1989 Water quality standard for fisheries[S].Beijing:China Standards Press,1989.
[31]陈锡涛.镉对花鲢Aristichthys nobills仔鱼,鱼苗和鱼种的急性毒性及其安全浓度的评价[J].环境科学与技术,1991(4):7-10.CHEN Xi-tao.Acute toxicity and safety assessment of cadmium to larvae,fry and fingerlings of bighead carp(Aristichthys nobills)[J].Environmental Science and Technology,1991(4):7-10.
[32]Wang N,Ingersoll C G,Hardesty d,et al.Acute toxicity of copper,ammonia,and chlorine to glochidia and juveniles of freshwater mussels(unionidae)[J].Environmental Toxicology and Chemistry,2007,26(10):2036-2047.
[33]Li Y,Yang H,Liu N,et al.Cadmium accumulation and metallothionein biosynthesis in cadmium-treated freshwater mussel Anodonta woodiana[J].PLoS ONE,2015,10(2):e0117037.
[34]Ma T,Wang M,Gong S,et al.Impacts of sediment organic matter content and pH on ecotoxicity of coexposure of TiO2nanoparticles and cadmium to freshwater snails Bellamya aeruginosa[J].Archives of Environmental Contamination and Toxicology,2017,72:153-165.
[35]闫振广,孟 伟,刘征涛,等.我国淡水水生生物镉基准研究[J].环境科学学报,2009,29(11):2393-2406.YAN Zhen-guang,MENG Wei,LIU Zheng-tao,et al.Biological criteria for freshwater Cd in China[J].Acta Scientiae Circumstantiae,2009,29(11):2393-2406.
[36]顾晓军,田素芬.毒物兴奋效应概念及其生物学意义[J].毒理学杂志,2007,21(5):425-428.GU Xiao-jun,TIAN Su-fen.Concept of hormesis and its biological significance[J].Journal of Toxicology,2007,21(5):425-428.
[37]李 琰,吴 丹,文春根,等.镉对褶纹冠蚌抗氧化因子的影响[J].农业环境科学学报,2012,31(11):2108-2113.LI Yan,WU Dan,WEN Chun-gen,et al.Effects of cadmium on the antioxidant factors of Cristaria plicata[J].Journal of Agro-Environment Science,2012,31(11):2108-2113.
[38]Michel C,Vincent-Hubert F.DNA oxidation and DNA repair in gills of zebra mussels exposed to cadmium and benzo(a)pyrene[J].Ecotoxicology,2015,24(9):2009-2016.
[39]Wang W X,Fisher N S.Assimilation of trace elements and carbon by the mussel Mytilus edulis:Effects of food composition[J].Limnology and Oceanography,1996,41(2):197-207.
Acute toxicity of cadmium and its effects on lipid peroxidation and DNA damage in“standardized”Anodonta woodiana
CHEN Xiu-bao,LIU Hong-bo,SU Yan-ping,JIANG Tao,YANG Jian*
(Key Laboratory of Fishery Eco-Environment Assessment and Resources Conservation in Middle and Lower Reaches of the Yangtze River,Freshwater Fisheries Research Center,Chinese Academy of Fishery Sciences,Wuxi 214081,China)
This study was undertaken to investigate the toxic effect of waterborne Cd2+on the freshwater bivalve“standardized”Anodonta woodiana,a unique bioindicator used in the“Freshwater Mussel Watch”project.Glochidia(< 24 h,mean length 0.25 mm),early juveniles(< 5 days,mean length 0.27 mm),and late juveniles(6 months,mean length 50 mm)were exposed to various Cd2+concentrations for the acute toxicity test.Furthermore,late juveniles or adults(48 months,mean length 85 mm)were used to investigate the temporal variation of lipid peroxidation[malondialdehyde(MDA)content]and DNA damage[Olive tail moment(OTM)]in gills,which are the target organs of Cd2+accumulation.The results showed that the 24-h median effect concentration(EC50)for glochidia was 0.001 8 mg·L-1,whereas the 96-h EC50values for early and late juveniles were 0.004 7 mg·L-1and 4.5 mg·L-1,respectively.MDA content was continuously reduced over time in both the 0.05 mg·L-1and 0.5 mg·L-1groups,and was not related to Cd2+concentration(P>0.05).In contrast,the OTM values increasedover time,and were linearly and positively correlated with Cd2+concentration(p<0.05).These results indicate that glochidia and early juveniles may be used as sensitive test organisms for Cd2+toxicology research,late juveniles and adults may be suitable for biomonitoring Cd2+pollution,and OTM is a valuable biomarker for early warning of Cd2+contamination.
“standardized”Anodonta woodiana;life stages;cadmium;acute toxicity;biomarker
X171.5
A
1672-2043(2017)10-1960-08
10.11654/jaes.2017-0430
陈修报,刘洪波,苏彦平,等.镉对"标准化"背角无齿蚌的急性毒性及脂质过氧化和DNA损伤的影响[J].农业环境科学学报,2017,36(10):1960-1967.
CHEN Xiu-bao,LIU Hong-bo,SU Yan-ping,et al.Acute toxicity of cadmium and its effects on lipid peroxidation and DNA damage in "standardized"Anodonta woodiana[J].Journal of Agro-Environment Science,2017,36(10):1960-1967.
2017-03-23 录用日期:2017-07-13
陈修报(1983—),男,博士,助理研究员,从事渔业生态环境评价与保护研究。E-mail:chenxb@ffrc.cn
*通信作者:杨 健 E-mail:jiany@ffrc.cn
国家自然科学基金青年科学基金项目(31502166);江苏省自然科学基金项目(BK20161144);中央级公益性科研院所基本科研业务费专项资金项目(2015JBFM13)
Project supported:The Young Scientists Fund of the National Natural Science Foundation of China(31502166);The Natural Science Foundation of Jiangsu Province,China(BK20161144);Central Public-interest Scientific Institution Basal Research Fund(2015JBFM13)
