p-STAT3及Twist在乳腺浸润性导管癌(非特殊类型)中的表达及相关性分析
2017-12-25,,,,,
,,,,,
(广州医科大学附属惠州医学 惠州市第三人民医院病理科,广东 惠州 516002)
·基础医学·
p-STAT3及Twist在乳腺浸润性导管癌(非特殊类型)中的表达及相关性分析
谭秋芬,胡惠军,范晓娟,胡雪梅,邹伟文,林小龙*
(广州医科大学附属惠州医学 惠州市第三人民医院病理科,广东 惠州 516002)
目的探讨磷酸化信号传导与转录激活因子3(STAT3)和Twist在乳腺浸润性导管癌组织中的表达情况及其临床意义。方法利用免疫组织化学染色的方法检测60例乳腺浸润性导管癌组织及其相应癌旁正常组织中p-STAT3和Twist蛋白表达,分析两者的相关性以及两者的表达率与乳腺浸润性导管癌患者临床病理特征的关系。结果p-STAT3和Twist蛋白在乳腺浸润性导管癌中的阳性率明显高于癌旁正常组织的阳性率。p-STAT3和Twist蛋白在乳腺癌晚期、淋巴结及脉管及组织学分级为Ⅲ-Ⅳ级的患者中阳性率明显增高,但两者在不同年龄及肿瘤大小不同的患者中阳性表达率不变。在乳腺浸润性导管癌组织中,p-STAT3和Twist蛋白的表达呈正相关性。结论p-STAT3与Twist蛋白的表达在乳腺浸润性导管癌中具有明显的相关性,且两者的阳性率在淋巴及脉管转移、分化较差及晚期的患者中明显升高。这些结果表明磷酸化的STAT3蛋白可能通过上调Twist表达促进乳腺浸润性导管癌的侵袭和转移。
p-STAT3; Twist; 乳腺浸润性导管癌; 免疫组织化学
乳腺癌是女性常见的恶性肿瘤之一,近年来其发病率逐年上升并呈现出年轻化的趋势。造成乳腺癌死亡的原因很多,其中最主要的原因是肿瘤细胞的侵袭及转移[1]。研究发现,核转录因子STAT3 的磷酸化,可以介导多种信号分子,调控肿瘤细胞增殖及凋亡影响肿瘤进展[2],但其作用机制尚不明确。而Twist作为重要的转录因子,其能够诱导肿瘤细胞的上皮—间质转化,促进肿瘤细胞的增殖和分化, 其过度表达与多种恶性肿瘤的转移和预后不良有关[3]。然而目前在乳腺浸润性导管癌的研究中尚未见关于p-STAT3及Twist相关性的报道。因此,本文采取免疫组化的方法对乳腺浸润性导管癌中p-STAT3及Twist的表达进行检测,同时分析两者关系,以及两者与乳腺浸润性导管癌各临床病理因素间的关系,从而探讨两者在乳腺癌癌变过程中的意义,进一步明确乳腺癌进展的可能机制,为乳腺癌治疗提供新的途径。
1 材料与方法
1.1标本收集选择本院病理科2012 年1 月~2015年12 月的手术切除乳腺浸润性导管癌患者的标本制成的蜡块60例及20例癌旁组织作为对照。所有的标本用10 %中性甲醛进行固定并且用石蜡包埋,HE 切片则由副高以上的病理医生确诊。所有患者病检前均未进行任何治疗,均有完整的临床及病理资料。乳腺癌病理学分型及组织学分级参照2003年乳腺癌WHO 分类和分级标准[4]。
1.2实验试剂鼠抗人Twist 单克隆抗体( H-81,SC15393 )及兔抗人STAT3 多克隆抗体均购于Santa Cruz 公司,SP试剂盒及DAB显色剂均购自武汉博士德生物技术开发有限公司。
1.3免疫组织化学染色所有标本经10%中性甲醛固定,石蜡包埋,以4 μm 厚度连续切片,常规脱蜡和水化后,免疫组织化学参照SP试剂盒说明书操作步骤进行,DAB 显色,苏木素复染,封片。免疫组化结果的判断:p-STAT3 蛋白的阳性表达定位于胞核;而Twist蛋白阳性表达则定位于细胞浆。其中每张切片细胞的阳性强度按:无着色、淡黄色、棕黄色和棕褐色分别记0,1,2,3 分;着色面积则通过:无着色、着色<1/3,着色1/3~2/3,着色>2/3 分别记0,1,2,3 分。随后根据这两项的得分之和对结果进行判定:<3 分为阴性,≥3 分则为阳性。每张切片均选取代表性的区域在200 倍视野下进行计数,计数8个视野,取平均值进行分析[5-6]。
1.4统计分析用SPSS10.0进行数据统计, 其中计量资料采用t检验,计数资料采用χ2检验及Spearman相关分析对数据进行分析,P<0.05表示差异有统计学意义。
2 结 果
2.1乳腺浸润性导管癌中p-STAT3及Twist蛋白的表达p-STAT3 蛋白的阳性表达定位于细胞核,38例(63.3%)乳腺浸润性导管癌的病例呈阳性表达,而癌旁正常组织中只有4例(20%)弱表达(P<0.01)。Twist蛋白的阳性表达定位于胞浆,浸润性导管癌组织中44 例(73.3%)Twist表达阳性,而癌旁组织中只有5例(25%)弱表达(图1、表1)。

图1 p-STAT3及Twist蛋白在乳腺浸润性导管癌及癌旁正常组织中的表达(免疫组织化学染色SP法,×200)A:癌旁组织中p-STAT3表达;B:癌组织中p-STAT3表达;C:癌旁组织中Twist表达;D:癌组织中Twist表达

组别np-STAT3阳性阴性Twist阳性阴性乳腺癌组织6038(63.3)22(36.7)44(73.3)16(26.7)癌旁组织204(20.0)16(80.0)5(25.0)15(75.0)χ214.12816.423P<0.01<0.01
2.2 p-STAT3蛋白与Twist蛋白的相关性分析表2结果提示p-STAT3 表达与Twist蛋白呈正相关(均P<0.001)。
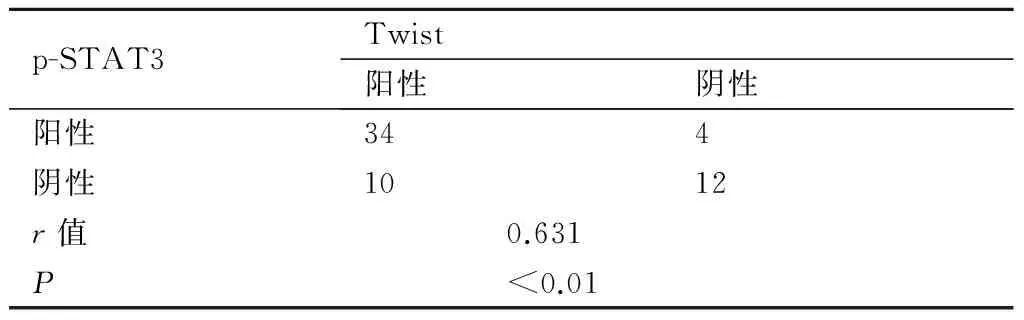
表2 p-STAT3蛋白与Twist蛋白在乳腺浸润性导管癌的相关性分析(例)
2.3不同临床病理特征的乳腺浸润性导管癌患者中p-STAT3及Twist蛋白阳性表达率的比较由表2及表3可知,p-STAT3 及Twist蛋白表达率在组织分级为Ⅲ级、发生淋巴结转移及脉管转移、临床分期为Ⅲ~Ⅳ期的患者中表达率均明显升高(均P<0.05);而在不同年龄及肿瘤大小不同的患者中表达率变化不大(P>0.05)。见表3、表4。
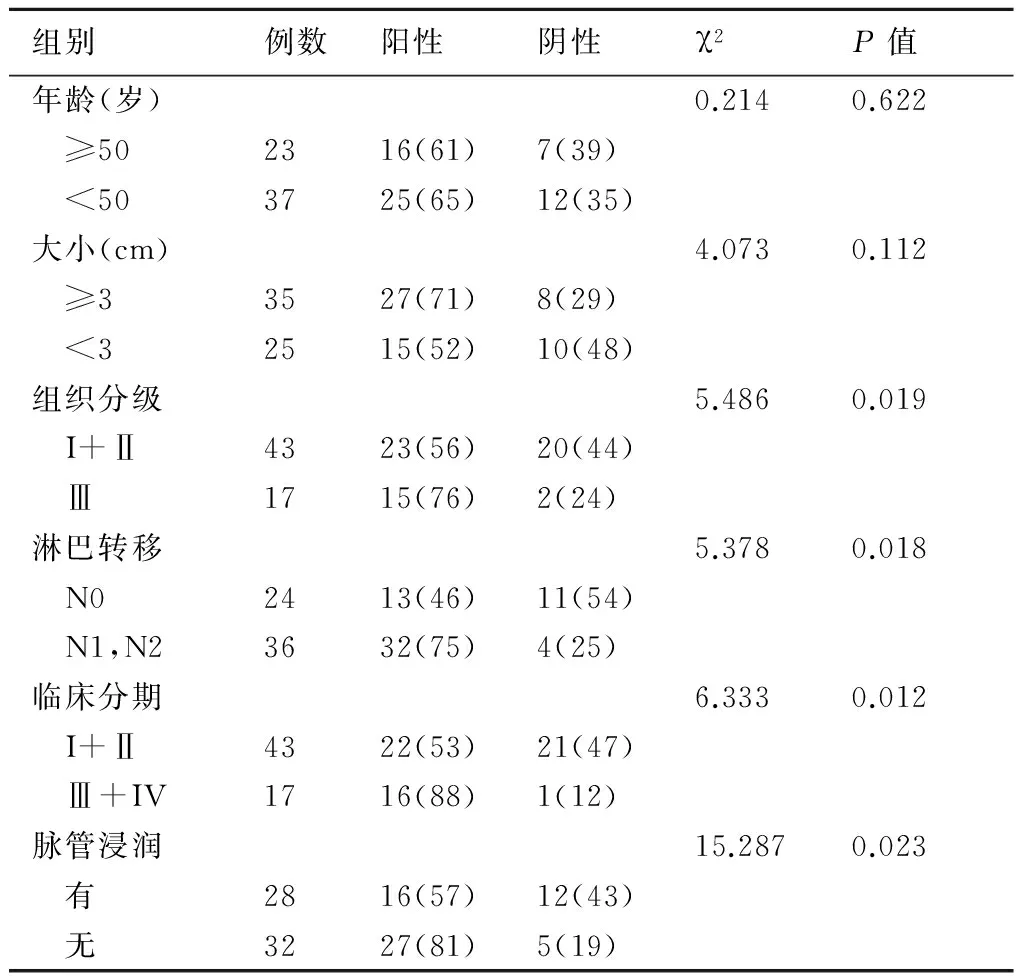
表3 不同临床病理特征的乳腺浸润性导管癌(非特殊型)患者中p-STAT3蛋白阳性表达率的比较(例,%)
3 讨 论
信号传导及转录活化子信号通路异常活化与肿瘤发生发展密切相关。STAT3 是信号传导与转录激活因子家族的重要成员之一。STAT3的活化受其上游的Janus 激酶(JAK)的调控,活化的JAK 可以通过募集胞浆中的单体STAT3 分子,促进STAT3 的酪氨酸磷酸化,从而使STAT3 形成同源或异源性的二聚体,进而制其从受体上脱离,进入胞核与相应靶基因的STAT3位点结合,调节靶基因转录[7]。STAT3 信号活化能通过诱导肿瘤血管生成及细胞外基质降解参与肿瘤的侵袭转移[8]。本课题组发现p-STAT3 在乳腺浸润性导管癌(非特殊类型)中表达明显高于癌旁组织。且进一步分析其与临床病理特征的关系,发现p-STAT3的表达率在发生淋巴结及脉管转移、临床分期Ⅲ及Ⅳ期、组织学分级Ⅲ级的浸润性导管癌患者中明显升高(P<0.05),提示STAT3的活化可能参与调控乳腺浸润性导管癌(非特殊类型)的进展。

表4 不同临床病理特征的乳腺浸润性导管癌(非特殊型)患者中Twist蛋白阳性表达率的比较(例,%)
Twist作为肿瘤调控的重要靶标,能通过干预P53 肿瘤抑制基因通路,诱导上皮—间质转变抑制细胞分化等调节肿瘤的侵袭和转移[9-10]。国外的研究显示,Twist可作用于P53 依赖性和非依赖性通路以及NF-κB 通路调控细胞凋亡,促进肿瘤的形成,并且调控E-box 启动子的表达,诱导上皮间质转化的发生,抑制E-cadherin的转录,降低肿瘤细胞的黏附性,促进上皮来源肿瘤(如前列腺癌、乳腺癌和消化道肿瘤等)的发生及转移[11-14]。此外,Twist的上调可增强血管内皮生长因子的表达,促进血管生成,加快肿瘤侵袭及转移[15]。而Yang 等[16]在裸鼠的乳腺癌模型中研究提示,在Twist 蛋白表达越高的乳腺癌细胞越容易发生转移。本研究中Twist 阳性表达率在乳腺浸润性导管癌与癌旁组织间的阳性表达存在有显著差异,提示Twist 可能在乳腺癌的进展中发挥了重要的作用。为进一步探讨Twist 表达与乳腺癌进展的关系,分析了Twist 表达与不同临床病理特征的关系,结果发现,乳腺浸润性导管癌(非特殊类型)的组织中Twist 的阳性表达率在发生脉管浸润、分化程度较差及晚期的患者中表达率明显升高,这些结果与蔡凤林[17]和王伟[18]等课题组的研究相一致,表明Twist参与乳腺浸润性癌的侵袭及转移。
在Twist的基因中存在STAT3结合的位点,提示活化的STAT3可能通过调节Twist的表达影响肿瘤细胞发生EMT,促进肿瘤的侵袭及转移[19]。因此,本课题组对两者在乳腺浸润性导管癌(非特殊类型)中的相关性进行分析。结果显示,在乳腺浸润性导管癌(非特殊类型)中,p-STAT3的表达与Twist表达成正相关,提示STAT3的活化可能通过调控Twist表达,影响乳腺浸润性导管癌(非特殊类型)的侵袭及转移。最新的研究发现,在卵巢癌组织中表皮生长因子(EGF)或白介素-6(IL-6)可以激活JAK-STAT3 通路诱导卵巢癌细胞EMT促进癌细胞侵袭转移, 而这种作用能被JAK-STAT3 通路抑制剂AG490 所逆转[20]。而相同的结果在结肠癌的研究中也被证实[21]。然而STAT3 在乳腺浸润性导管癌上皮间质转化的作用,尚未见研究报道。此外,Twist作为调节EMT的转录因子,其是否受到活化的STAT3的调控,需要进一步深入研究。
综上所述,p-STAT3 与Twist蛋白的表达在乳腺浸润性导管癌中具有明显的相关性,且两者的阳性率在淋巴及脉管转移、分化较差及晚期的患者中明显升高。据此,课题组推测活化的STAT3 可能通过上调Twist蛋白介导EMT 促进乳腺浸润性导管癌(非特殊类型)的侵袭转移,STAT3/Twist/EMT可能形成信号轴在乳腺浸润性导管癌(非特殊类型)的进展和转移中起重要作用,而这需要在将来的研究中进一步证明。
[1] 蔡凤林,周士福,马兆生,等.HIF-1α和MMP-2 在乳腺浸润性导管癌中的表达及其相关性[J].四川医学,2007,28(8):880-881.
[2] Zhao C,Li H,Lin HJ,et al.Feedback activation of STAT3 as a cancer drug-resistance mechanism [J].Trends Pharmacol Sci,2016,37(1):47-61.
[3] Khan MA,Chen HC,Zhang D,et al.Twist:a molecular target in cancer therapeutics[J].Tumour Biol,2013,34(5):2497-2506.
[4] 郑杰,沈丹华,薛卫成.外科病理学[M].10版.北京大学出版社,2014:1696-1698.
[5] 张建国,赵晶,李远航,辛彦.STAT3、p-STAT3 与 Survivin 在胃癌及其癌前病变组织中的表达及意义[J].中国医科大学学报,2009,38(12):907-912.
[6] 叶入裴,肖秀丽,龙汉安,等.Twist 蛋白在乳腺癌中的表达及临床意义[J].现代医学,2016,44(4):458-461.
[7] Zhao C,Li H,Lin HJ,et al.Feedback activation of STAT3 as a cancer drug-resistance mechanism[J].Trends Pharmacol Sci,2016,37(1):47-61.
[8] Tan FH,Putoczki TL,Stylli SS,et al.The role of STAT3 signaling in mediating tumor resistance to cancer therapy[J].Curr Drug Targets,2014,15(14):1341-1353.
[9] Shiota M,Izumi H,Onitsuka T,et al.Twist and p53 reciprocally regulate target genes via direct interaction[J].Oncogene,2008,27(42):5543-5553.
[10] Wushou A,Hou J,Zhao YJ,et al.Twist-1 up-regulation in carcinoma correlates to poor survival[J].Int J Mol Sci,2014,15(12):21621-21630.
[11] Khan MA,Chen HC,Zhang D,et al.Twist:a molecular target in cancer therapeutics[J].Tumour Biol,2013,34(5):2497-2506.
[12] Puisieux A,Valsesia-Wittmann S.A twist for survival and cancer progression[J].Br J Cancer,2006,94(1):13-17.
[13] Mironchik Y,Winnard PT Jr,Vesuna F,et al.Twist overexpression in duces in vivo angiogenesis and correlates with chromosomal instability in breast cancer [J].Cancer Res,2005,65 (23):10801-10809.
[14] Chengxiao Z,Ze Y.Biological function and molecular mechanism of Twist2 [J].Yi Chuan,2015,37(1):17-24.
[15] Wallerand H,Robert G,Pasticier G,et al.The epithelial-mesenchymal transition-inducing factor TWIST is an attractive target in advanced and/or metastatic bladder and prostate cancers [J].Urol Oncol,2010,28(5):473-479.
[16] Yang J,Mani SA,Donaher JL,et al.Twist,a master regulator of morphogenesis,plays an essential role in tumor metastasis [J].Cell,2004,117 (7):927 -939.
[17] 蔡凤林,章佳新,符德元,等.Twist 和 Snail 在乳腺癌中的表达及其与血管生成的关系[J].现代肿瘤医学,2013,21(2):298-301.
[18] 王伟,刘建波,李会荣,等.TWIST和雌激素受体α在乳腺癌组织中的表达及对预后的影响[J].中国现代医学杂志,2015,25(21):11-16.
[19] Kim MS,Lee WS,Jeong J,et al.Induction of metastatic potential by TrkB via activation of IL6/JAK2/STAT3 and PI3K/AKT signaling in breast cancer [J].Oncotarget,2015,6(37):40158-40171.
[20] Zou M,Zhang X,Xu C.IL6-induced metastasis modulators p-STAT3,MMP-2 and MMP-9 are targets of 3,3′-diindolylmethane in ovarian cancer cells[J].Cell Oncol (Dordr),2016,39(1):47-57.
[21] Wang ZY,Zhang JA,Wu XJ,et al.IL-6 Inhibition Reduces STAT3 Activation and Enhances the Antitumor Effect of Carboplatin[J].Mediators Inflamm,2016,16(5):1-12.
Theexpressionsandcorrelationofp-STAT3andtwistinnospecialtypeofinvasiveductalcarcinomaofbreast
TAN Qiufen,HU Huijun,FAN Xiaojuan,et al
(DepartmentofPathology,AffliatedHuizhouHospital,theThirdPeople’sHospitalofHuizhou,GuangzhouMedicalUniversity,Huizhou516002,Guangdong,China)
ObjectiveTo study the expressions of p-STAT3 and Twist in the no special type of invasive ductal carcinoma (IDC) of breast and to analyze its clinical significance.MethodsImmunohistochemical method was used to detect the expressions of p-STAT3 and Twist in 60 cases of IDC of breast and corresponding tumor-adjacent normal breast tissues.Statistical analysis was carried out to analyze the relationship between p-STAT3 and Twist expression,and the relationship of these expressions to clinicopathologic characteristics.ResultsThe positive rates of p-STAT3 and Twist protein expressions in the IDC of breast tissues were significantly higher than those in the corresponding tumor-adjacent normal breast tissue.The positive rates of p-STAT3 and Twist protein were significantly higher in lymph node metastasis,histological grade (Ⅲ) and vascular invasion.P-STAT3 and Twist protein had no change in different age and tumordiameter.The positive rate of p-STAT3 expression was positively correlated with the positive rate of Twist expression.ConclusionsThe expression of p-STAT3 and Twist protein was significantly correlated with invasive ductal carcinoma of breast,and the positive rate of p-STAT3 and Twist was significantly higher in lymphatic and vascular metastasis,poorly differentiated and advanced stage.These results indicate that p-STAT3 may play an important role in induced invasion and metastasis in no special type of IDC via regulation of the expression of Twist.
phosphorylation of signal transducer and activator of transcription 3; Twist; invasive ductal carcinoma of breast; immunohistochemistry
10.15972/j.cnki.43-1509/r.2017.02.002
2016-11-09;
2017-02-02
国家自然基金(编号81600342);广东省医学科研基金(编号A2015620).
*通讯作者,E-mail:xiaolong880101@126.com.
R737.9
A
蒋湘莲)
