环境应激蛋白PprM研究进展
2017-12-25,,,*
, ,,*
(1.南华大学公共卫生学院放射医学教研室,湖南 衡阳 421001;2.南华大学生物化学与分子生物学教研室)
·小专论·
环境应激蛋白PprM研究进展
潘宝平1,马云2,何淑雅1,2*
(1.南华大学公共卫生学院放射医学教研室,湖南 衡阳 421001;2.南华大学生物化学与分子生物学教研室)
耐辐射奇球菌(DR)是迄今为止地球上发现的辐射抗性最强的生命形式之一,具有快速高效的DNA损伤修复能力。PprM是DR菌特有的抗辐射响应蛋白,同时具有热休克蛋白(Hsp)和冷休克蛋白(Csp)特性,而且对电离辐射、氧化、干燥等压力胁迫都表现出极强的抗性。本文从PprM结构功能分析与预测、应激特性、分子伴侣活性与结合特性对目前PprM研究的最新进展做一综述,以期推动PprM进一步研究。
PprM; 热休克蛋白; 冷休克蛋白; 抗辐射; 抗氧化
耐辐射奇球菌(Deinococcusradiodurans,DR)最出名于它对γ辐射的极端抗性,但是它也被证明对紫外辐射,干燥,高压真空,重离子袭击和过氧化氢等都具有极强的抗性。DR菌对这些压力抗性的分子基础正在被广泛研究当中,特别受关注的是它的DNA修复系统。该细菌具有强大的DNA修复能力,一个5 kGy辐射能导致DR菌基因组200个双链断裂(double-strand breaks,DSBs),但是这种细菌却能在数小时内精确地从DNA碎片中重新装配到基因组中,主要原因是它能够调动机体约1/3的基因来抵抗致命的辐射损伤而存活。而对于其他几乎所有生物而言, 少数几个DNA双链断裂都是致死性的。但目前这种高效快速的DNA修复机制尚不清楚。
已经证实DR菌中很多基因(如pprI、pprA和recA等)在DNA损伤修复中发挥重要作用。2009年Ohba H[1]在比较野生菌株与pprI基因缺陷突变株时发现一种新型的调节蛋白,经鉴定为一种冷休克蛋白(Cold-shock protein,Csp)同源物并命名为PprM,并证实PprM参与了在DR菌中PprI介导的辐射响应,而pprI是DR菌DNA损伤修复的总开关基因,在DR的极端抗性机制中起到非常重要的作用[2],PprI充当一个总开关在辐射之后能够调节许多不同通路的蛋白质的表达,至少约210个基因的转录水平上调了,包括21个DNA修复和复制相关的基因,而这种潜在的机制并不清楚。细菌Csps主要在温度快速下降后被诱导以调节机体对冷应激的适应性,但也存在于正常条件下来调控其他生物学功能[3]。
1 PprM结构功能分析与预测
运用多种在线工具(包括CCD、SSDB和SMART等)对PprM蛋白的结构域进行分析(图1),发现PprM编码蛋白是一种含有S1-like RNA结合域及ssDNA结合结构域的RNA结合蛋白, S1-like RNA结构域是RNA结合蛋白结合结构域,ssDNA结构域是抗转录终止因子结合结构域。进一步的pprM基因结构分析发现pprM是一种冷休克蛋白基因。PprM蛋白与来自D.geothermalis和Thermusthermophilus的冷休克蛋白一样属于同一个亚基家族的不同的进化分支。纯化的PprM蛋白在生理条件下以二聚体的形式存在,类似于大肠杆菌的冷休克蛋白D[1]。S1-like superfamily即核糖体蛋白S1-like RNA结合域,在各种RNA结合蛋白中均有发现。最初被定义为S1核糖体蛋白,这个超家族还包含与S1结构域同源的冷休克域(CSD)。抗转录终止因子结合域的抗终止作用主要见于某些噬菌体的时序控制。早期基因与其后基因之间以终止子相隔开,抗终止因子可以使RNA聚合酶得以越过终止子继续转录,同时打开其后基因的表达,此过程称为通读。
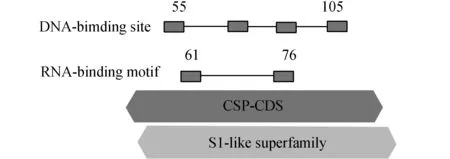
图1 PprM蛋白结构域分析
2 PprM应激特性
所有生物必须具备能力去适应环境变化包括营养素和一般物理参数,如渗透压和温度的变化。关于冷休克,有学者定义了特定的实际条件,例如对于嗜温细菌,将冷休克定义为温度在几分钟内从37 ℃降到15 ℃,即从最佳生长温度到接近最低极限的温度下生长。在已知的耐热性和低温耐受性的基础上,已经确认了DR菌最佳的热休克和冷休克温度,在52 ℃的致死温度下42 ℃的热休克和在反复冻融下20 ℃的冷休克能够出现最大化存活,并证实DR菌在热休克和冷休克处理下分别有67种蛋白和42种蛋白的表达量增加。Csps一般在较低温度下的表达量会大量增加,以保证菌体在较低温度下的生存,但除低温外,紫外线照射、H2O2和缺氧等应激也可激发其表达,PprM就是在42 ℃的热应激下被诱导的大量蛋白之一,为热休克诱导蛋白。但同时pprM又具有冷休克蛋白结构域,具有冷休克蛋白特性,所以被大量学者将其归属于冷休克蛋白的同源物。
PprM蛋白在辐射诱导下能高表达,其pprM缺失突变株对于 γ 辐射的敏感性显著增加,同时pprM与pprA双缺失突变株比pprM与pprA基因单缺失突变株具有更高的辐射敏感度[1, 4],可见PprM对DR菌的辐射抗性起到重要作用。同时PprM在氧化应激下也发挥重要作用,pprM突变菌种显示出过氧化氢酶活性降低,同时在相同环境下相比野生型DR菌对H2O2的抗性下降,主要原因是pprM的敲除降低了KatE1的mRNA和蛋白的水平,它是DR菌中主要的过氧化氢酶,表明PprM蛋白在氧化应激中也发挥重要作用[5]。同时将pprM基因转入大肠杆菌能提高它的抗盐碱、耐干旱能力[6]。这些研究表明pprM基因是非常重要的抗逆基因,未来可能在农业、辐射防护和环境治理等方面有极好的应用前。
3 PprM分子伴侣活性与结合特性
许多研究表明细菌中的Csps可以作为分子伴侣,能够结合RNA 和DNA,促进一系列的细胞过程,比如转录和翻译等。说明Csps很可能为一全局性的转录性的调节分子,能够调节正常生长,冷适应和各种应激反应和渗透胁迫反应。当某些环境改变后,细胞生理上会发生一些重要的变化,例如膜流动性和核酸的二级结构的稳定性下降,最终会导致RNA转录,翻译和降解的效率降低[7]。而冷休克反应使细胞来抵消这些不利的变化,主要是通过选择性产生一组特定的蛋白质,即Csps。大多数Csps都参与了RNA代谢,例如RNA解旋酶DeaD和核酸外切酶RNase R和PNPase,其中RNase R是大肠杆菌中唯一的3~5′核酸外切酶,能有效降解双链RNA。冷休克蛋白主要功能之一作为RNA分子伴侣(RNA chaperone)与mRNA结合,参与RNA新陈代谢,防止二级结构形成或促进结构化RNA的降解,RNA 伴侣分子可以帮助 RNA正确折叠或抑制 RNA 错误折叠 ,可以使错误折叠的RNA构象解链并形成正确的空间折叠[8-10]。这表明调节RNA代谢是适应的关键过程。PprM蛋白能结合RNA,是一种RNA分子伴侣蛋白。李伟等[11]利用RNA pull down等技术初步筛选到了与PprM蛋白相结合的4个mRNA,其中包括DR_A0355,它是双组分调控系统(two-component system,TCS)重要成分之一,编码产物为组氨酸蛋白激酶(histidinekinase,HK)CheA相关蛋白,该系统有助于细菌感知环境变化,并作出相应的应激反应,对生物体适应不断变化甚至极端的环境起到非常重要的调节作用[12]。已经证明DR菌中存在23个组氨酸蛋白激酶和29个反应调节蛋白(response regulator,RR)[13],它们共同组成了DR的双组分调控系统,对于DR菌感知和响应温度、氧化、干燥等压力胁迫起着至关重要的作用。
PprM蛋白也能结合DNA,Lu等[14]对pprI进行染色质免疫沉淀技术分析,发现PprI蛋白能特异性结合pprA和recA等DNA修复基因的启动子,它们已被证明在DNA损伤修复中发挥重要作用[15-18],而且在电离辐射诱导下,结合活性加强。已经证实PprM是一种PprI依赖性DNA损伤应答的一个调节器,但是PprM以何种方式参与了PprI介导的辐射损伤响应并不清楚,有学者认为它可能像大多数DNA损伤修复基因一样也受到PprI的表达调控,但是结果发现PprI蛋白并不结合pprM的启动子[19]。然而最近有人发现PprM蛋白可能能够结合一些参与DNA修复的基因的启动子,比如recA和pprA[20]。那么PprM是不是对pprI也有结合作用,促进或抑制PprI的表达?PprM的结合特性,尤其对DNA的结合,可能在整个PprM作用机制中起到关键作用。虽然目前对PprM蛋白的分子伴侣活性和结合特性研究数据甚少,但是该蛋白所拥有的极端抗性可能与它的分子伴侣活性和结合特性是密不可分的。
纵观PprM蛋白的辐射应激响应,该蛋白含RNA特异性或者非特异性结合域及抗转录终止子结合域,可使RNA聚合酶越过终止子通读,其前后基因同时快速转录生成mRNA表达蛋白质,符合辐射应激时细胞RNA需庇护及需大量快速生成的要求,故有理由认为PprM可能就是被进化成能非特异性结合众RNA或特异性结合抗辐射相关蛋白的靶mRNA及ssDNA,呈现RNA的保护、稳定与大量生成效应的RNA辐射应激开关。
终上所述,根据PprM结构功能分析与预测及目前取得的研究成果进行总结,见图2。

图2 预测耐辐射奇球菌PprM调控网络
4 展 望
本文回顾了近年来对PprM功能研究领域取得的成果,主要从结构分析与预测、应激特性、分子伴侣活性与结合特性阐明了PprM在DR菌中的重要作用。总而言之,因PprM蛋白在热休克下被大量诱导而称为热休克蛋白(Heat-shock protein,Hsp),或因其具有冷休克特性而命名为Csp,或因其含有抗转录终止因子具有抗终止作用,辐射应急时保护RNA,而称之为辐射应激蛋白,这些都只体现了PprM蛋白某个方面的特点,基于以上数据可以看出PprM蛋白不仅可以响应高低温压力胁迫,而且对电离辐射、氧化、干燥等都发挥着重要的抵抗性,故将PprM命名为环境应激蛋白,它可能充当一个全方位的救火员,响应各种极端环境变化。
目前,PprM在DR菌中具体的作用机制并不完全清楚,但是它在DNA损伤修复中的角色是无可代替的。众所周知,DR菌极强的抗性主要在于它具有强大的修复系统,而这个系统是由千千万万的基因构成的错综复杂的调控网络,每个基因都不可能单独发挥作用。PprM既结合RNA又结合DNA,同时还有抗转录终止因子等特性,它可能构成一个庞大的信号通路运用到DR的多个修复途径中。PprM作为环境应激蛋白,也正在被一步步转入到真核细胞甚至动物体内,观察其对环境的适应能力。随着生物技术的不断发展,相信在不久的将来,环境应激蛋白PprM的作用机制乃至DR菌强大的极端抗性网络必将被人们所熟知,并能为人类抵抗潜在的辐射危险提供重要的新思路。
[1] Ohba H, Satoh K, Sghaier H, et al. Identification of PprM:a modulator of the PprI-dependent DNA damage response in Deinococcusradiodurans[J]. Extremophiles, 2009,13(3):471-479.
[2] Hua Y, Narumi IG, Tian B, et al. PprI:a general switch responsible for extreme radioresistance of Deinococcusradiodurans[J]. BiochemBiophys Res Commun, 2003,306(2):354-360.
[3] Horn G, Hofweber R, Kremer W, et al. Structure and function of bacterial cold shock proteins[J]. Cell Mol Life Sci, 2007,64(12):1457-1470.
[4] 杨杰. pprM及其DNA结合域基因敲除对耐辐射奇球菌辐射抗性影响[D]. 南华大学, 2014.
[5] Jeong SW, Seo HS, Kim MK, et al. PprM is necessary for up-regulation of katE1 , encoding the major catalase of Deinococcusradiodurans , under unstressed culture conditions[J]. J Microbiol, 2016,54(6):426-431.
[6] 王玮, 宋素琴, 张志东, 等. 耐辐射异球菌pprM基因克隆及功能预测[J]. 新疆农业科学, 2012,49(8):1449-1455.
[7] Phadtare S. Recent developments in bacterial cold-shock response.[J]. Curr Issues MolBiol, 2004,6(2):125-136.
[8] Matos RG, Barbas A, Arraiano CM. RNase R mutants elucidate the catalysis of structured RNA:RNA-binding domains select the RNAs targeted for degradation[J]. Biochem J, 2009,423(2):291-301.
[9] Phadtare S. Unwinding activity of cold shock proteins and RNA metabolism[J]. RNA.Biol, 2010,8(3):394-397.
[10] Barria C, Malecki M, Arraiano C M. Bacterial Adaptation to Cold.[J]. Microbiology, 2013,159(12):2437-2443.
[11] 李伟. 耐辐射奇球菌PprM蛋白相互作用 RNA的筛选及鉴定[D]. 南华大学, 2015.
[12] Francez-Charlot A, Kaczmarczyk A, Fischer HM, et al. The general stress response in Alphaproteobacteria[J]. Trends Microbiol, 2015,23(3):164-171.
[13] Makarova KS, Aravind L, Wolf YI, et al. Genome of the extremely radiation-resistant bacterium deinococcusradiodurans viewed from the Perspective of comparative genomics[J]. Microbiol Mol Biol Rev, 2001,65(1):44-79.
[14] Lu H, Chen H, Xu G, et al. DNA binding is essential for PprI function in response to radiation damage in Deinococcusradiodurans[J]. DNA Repair (Amst), 2011,11(2):139-145.
[15] Warfel JD, Licata VJ. Enhanced DNA binding affinity of recA protein from deinococcusradiodurans[J]. DNA Repair (Amst), 2015,31:91-96.
[16] Repar J, Cvjetan S, Slade D, et al. RecA protein assures fidelity of DNA repair and genome stability in Deinococcus radiodurans[J]. DNA. Repair (Amst), 2010,9(11):1151-1161.
[17] Narumi I, Satoh K S, Funayama T, et al. PprA:a novel protein from Deinococcus radiodurans that stimulates DNA ligation[J]. MolMicrobiol, 2004,54(1):278-285.
[18] Kota S, Rajpurohit YS, Charaka VK, et al. DNA Gyrase of Deinococcus radiodurans is characterized as Type II bacterial topoisomerase and its activity is differentially regulated by PprA in vitro[J]. Extremophiles, 2016:1-11.
[19] 王秋岩. 耐辐射奇球菌pprM启动子鉴定及其与PprⅠ蛋白的相互关系研究[D]. 南华大学, 2015.
[20] 付亮. 耐辐射奇球菌PprM蛋白靶DNA的筛选与鉴定[D]. 南华大学, 2016.
10.15972/j.cnki.43-1509/r.2017.01.026
2016-10-24;
2016-12-30
国家自然科学基金(编号81272993)、南华大学研究生科研创新项目(标号2016XCX39).
*通讯作者,E-mail:heshuya8502@163.com.
R811
A
蒋湘莲)
