人源神经干细胞来源外泌体的提取鉴定及内吞作用
2017-12-23张桂龙陈陆馗李炳乾蔡云朗
张桂龙,陈陆馗,李炳乾,蔡云朗
(1.东南大学附属中大医院,神经外科,江苏 南京 210009; 2.东南大学医学院,江苏 南京 210009; 3.东南大学附属中大医院,妇产科,江苏 南京 210009)
人源神经干细胞来源外泌体的提取鉴定及内吞作用
张桂龙1,2,陈陆馗1,2,李炳乾1,2,蔡云朗2,3
(1.东南大学附属中大医院,神经外科,江苏 南京 210009; 2.东南大学医学院,江苏 南京 210009; 3.东南大学附属中大医院,妇产科,江苏 南京 210009)
目的细胞外囊泡外泌体内含有蛋白、脂质和遗传物质,在细胞间的交流中发挥着非常重要的作用。本研究首次探讨人源神经干细胞来源外泌体的的生物学特性和潜在功能。方法经东南大学附属中大医院临床研究伦理委员会的审查和批准,我们利用成功分离出的人胎儿海马来源的原代神经干细胞进行体外培养、外泌体获取以及功能评价。通过免疫荧光、western blotting和琼脂糖凝胶电泳对人源神经干细胞进行鉴定;利用超高速离心和总外泌体提取试剂盒提取培养细胞上清中的外泌体,并通过透射电镜、纳米颗粒追踪分析和western blotting进行鉴定;最后用PKH67标记外泌体后评价其潜在功能。结果人胎儿的海马中原代神经干细胞成功分化为神经元、星形胶质和少突胶质细胞;随后在干细胞的培养上清中成功分离出了干细胞分泌的外泌体,符合外泌体的基本特征结构;最后发现外泌体可以被干细胞摄取和内吞,明显聚集于胞质内,且部分入核。结论本研究初步探索了人源神经干细胞来源外泌体的基本特征和内吞作用,为其后续在神经系统领域的深入研究奠定了基础。
神经干细胞; 外泌体; 标记; 内吞作用
因此,外泌体作为介导细胞间功能的重要介质,本课题将通过人源神经干细胞分析其来源外泌体的分泌表达情况,为将来研究外泌体如何参与治疗神经系统疾病打下前期基础。
1 材料和方法
1.1 人源神经干细胞的获取培养
1.2 人源神经干细胞的增殖、分化及免疫荧光鉴定
1.3 外泌体的提取
收集神经干细胞培养过程中的细胞上清,用超高速离心方法和总外泌体提取试剂盒根据操作说明进行提取。细胞上清先经2 000 rpm, 10 min去细胞及碎片,再用0.22 μm滤器过滤残余碎片或杂质。超高速离心方法,120 000×g(Beckman)4 ℃离心2 hours,用1 ml预冷PBS重悬清洗后再120 000×g 4 ℃离心2 hours,最后用100 μl PBS收集外泌体;总外泌体提取方法(Invitrogen),细胞上清和试剂按2∶1混匀后4 ℃过夜孵育,离心10 000×g 4 ℃ 1 hour,弃上清后用100 μl PBS收集外泌体。
1.4 PKH67标记外泌体及细胞内吞实验

人神经干细胞常规培养、铺板,24孔板培养3 d后换新鲜培养基,并加入PKH67标记过的外泌体共孵育24 h,PBS洗细胞2~3次,4%多聚甲醛固定15~30 min,PBS洗3次,DAPI染核5 min,PBS再洗3次,荧光观察并拍照。
1.5 透射电镜检查(TEM)和纳米颗粒追踪分析检测(NTA)
透射电镜,取新鲜提取的外泌体10 μl悬滴于铜网上(中镜科仪)5~10 min,滤纸擦干,再悬滴10 μl 2%磷钨酸负染液(索莱宝)3~5 min,然后用去离子水清洗1~2次,滤纸吸干多余水分,晾干后透射电镜下观察拍照。
纳米颗粒分析,用Zetaview(Particle Metrix)仪器根据操作说明进行外泌体浓度粒径检测,方法是利用一个光散射检测系统和纳米颗粒的布朗运动,可为特定和一般大小的纳米粒子表征提供检测。
1.6 琼脂糖凝胶电泳
根据总RNA提取试剂盒(Omega)操作说明提取神经干细胞的总RNA,用Oligodt引物进行逆转录,随后用特异性引物(Nestin、Sox2、Musashi1)进行普通PCR扩增。普通PCR扩增产物用琼脂糖凝胶进行电泳检测,电泳液为0.5% TBE,琼脂糖浓度为1.5%,电泳结束后紫外下观察并拍照。引物:Nestin,正向GGAGGTAGACAAGGAAAGTCAAAC,反向CTTCTCCACCGTATCTTCCCAC;SOX2正向CCCCCTGTGGTTACCTCTTCC,反向CCCTCCCATTTCCCTCGTTTT;MUSASHI1正向GAACCATCCCGTCCTGTATCA,反向ATTCCTGTCCAGCAGTGTCGC。
1.7 Western blotting实验
1.8 统计学处理
2 结 果
2.1 人源神经干细胞的生物学特性
海马区的原代神经干细胞是悬浮生长且呈典型的神经球样表现(图1A)。免疫荧光、western blotting及琼脂糖凝胶电泳均证实了神经干细胞特异性标志物(markers)的表达(图1B)。免疫荧光可见巢蛋白Nestin明显表达于细胞的骨架(绿),Sox2明显表达于细胞核(红),Musashi1则明显表达于细胞质和核(红);Western blotting从蛋白水平在不同分子量kDa上证实了各个markers的表达;琼脂糖凝胶电泳从RNA水平也证实了这三种markers的表达。
当干细胞分化培养7~10 d后,可以成功分化三种细胞,分别明显表达Tuj1(神经元marker)、GFAP(神经胶质细胞marker)和MOG(少突胶质细胞marker)(图1C)。
2.2 人源神经干细胞来源的外泌体的特征
随后我们收集了人源神经干细胞培养过程中的细胞上清,利用超高速离心和总外泌体提取试剂盒提取后对其(外泌体)进行了鉴定,透射电镜TEM(图2A)可见其大小在100 nm上下,具有典型的双层膜结构,且呈圆盘或杯口状;纳米颗粒大小追踪分析NTA(图2B)进一步证实了外泌体的大小均数为(127.8±7.7) nm,且主要分布于40~250 nm,呈相对的正态分布特征;Western blotting则验证了外泌体内的特异性标志蛋白markers的表达,可见此外泌体内明显表达Hsp70、CD63和Tsg101蛋白(图2C)。
2.3 人源神经干细胞外泌体的内吞现象
为了进一步探讨人源神经干细胞外泌体的特性和潜在功能,我们随后利用PKH67对其进行了标记,并试图检测其潜在的内吞情况。本实验中我们依然使用人源神经干细胞作为潜在被干预对象,当与提取的其他人源神经干细胞来源的外泌体进行共孵育后,发现外泌体可以成功被摄入内吞进入细胞内。图3A和3B示PKH67标记后的外泌体在细胞内的表达,发现其主要是在胞质内进行聚集,并可见(红色箭头处)有少部分外泌体还能进入细胞核内,间接说明了外泌体有可能参与调控细胞的转录表达及生物学功能。
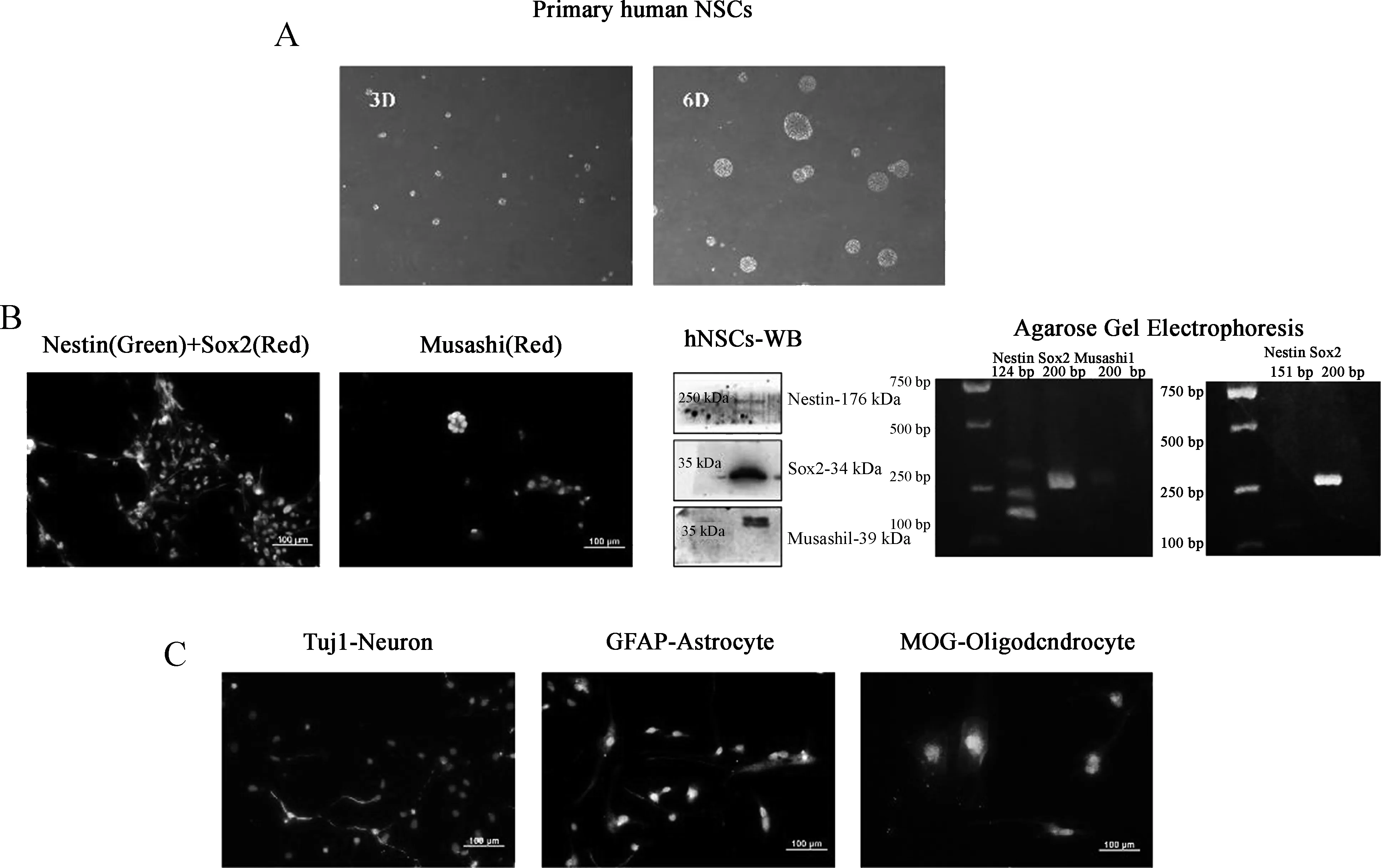
A.原代人源神经干细胞培养第3天和第6天的形态 (×40);B.原代人源神经干细胞的免疫荧光(左)、western blotting(中)和琼脂糖凝胶电泳实验(右);C.原代人源神经干细胞分化后的免疫荧光,分化为神经元(Tuj1,左)、神经胶质(GFAP,中)和少突胶质细胞(MOG,右)
图1原代人源神经干细胞的鉴定
A. The morphology of primary hNSCs on 3rdand 6thday; B. Immunofluorescence (Left), western blotting (Middle), and agarose gel electrophoresis (Right) methods confirmed primary hNSCs; C. Primary hNSCs differentiated into neurons (Tuj1, Left), astrocytes (GFAP, Middle), and oligodendrocytes (MOG, Right)
Fig1Identificationofprimaryhumanneuralstemcells
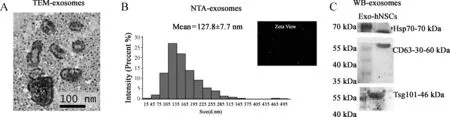
A.透射电镜TEM检测外泌体的形态和大小;B.纳米颗粒大小追踪分析NTA检测所有外泌体的大小,ZetaView为检测的视频颗粒图;C.Western blotting检测外泌体特异性标记物Hsp70、CD63和Tsg101的表达情况
图2人源神经干细胞分泌外泌体的鉴定
A. The morphology and size of exosomes detected by TEM; B. The size distribution of exosomes examined by NTA. ZetaView was the video snapshot; C. Western blotting showed the exosomal special markers Hsp70, CD63 and Tsg101
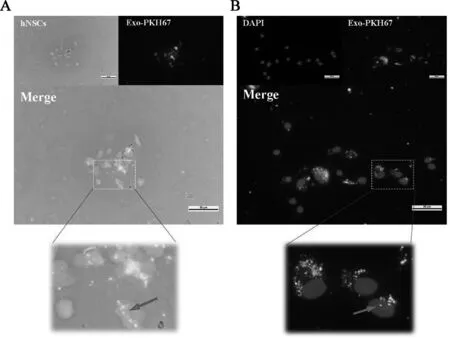
A.白光观察细胞+荧光观察PKH67标记后的外泌体,下图为局部放大效果;B.DAPI染核后同时荧光观察PKH67标记后的外泌体,下图为局部放大效果
图3PKH67标记后的人源神经干细胞来源外泌体的内吞作用

3 讨 论
本研究重点探讨了人源神经干细胞的培养及其分泌外泌体的基本特征,试图揭示神经干细胞外泌体的潜在功能。虽然目前已有研究证实了鼠源相关神经干细胞来源外泌体的分泌特点,但临床前研究的目标最终还是为了未来的临床转化服务。因此,在此基础上,我们利用被终止妊娠的胎儿的脑组织,直接从人体的细胞水平去进行研究,希望可以更精准地分析人源神经干细胞的各种特征。首先我们成功分离出了人胎儿海马来源的原代神经干细胞,并通过免疫荧光、western blotting和琼脂糖凝胶电泳从蛋白表达和RNA表达水平多重路径进行了鉴定;随后在其培养的细胞上清中提取其可能分泌的外泌体,并通过透射电镜、纳米颗粒大小追踪分析和western blotting验证了外泌体的形态、大小和其特异性标志物markers;最后在人源神经干细胞自身身上探索外泌体基本的潜在特征,发现外泌体可以成功被摄取内吞进入细胞并在细胞内进行聚集,且部分外泌体还能入核。
综上所述,神经干细胞作为神经损伤修复过程中至关重要的种子细胞,外泌体作为一种新兴的重要的细胞间调控分子,在神经系统疾病的治疗过程中神经干细胞来源的外泌体将具有非常重要的作用,也许将成为未来神经系统疾病一种新的治疗方式。因此,本研究在人源神经干细胞来源外泌体的基本特征和潜在作用方面进行了初步探索,为后续的外泌体在神经系统领域深入的功能研究奠定了基础。










[13] COSSETTI C,SMITH J A,IRACI N,et al.Extracellular membrane vesicles and immune regulation in the brain[J].Front Physiol,2012,3:117.






Characterizationofhumanneuralstemcellsderivedexosomesandtheirsendocytosis

(1.SchoolofMedicine,SoutheastUniversity,Nanjing210009,China; 2.DepartmentofNeurosurgery,
ZhongdaHospital,SoutheastUniversity,Nanjing210009,China; 3.DepartmentofObstetricsandGynaecology,ZhongdaHospital,SoutheastUniversity,Nanjing210009,China)
human neural stem cells; exosomes; labeled; endocytosis


国家自然科学基金面上项目(81471780,81671819)


R741.05
A


孙茂民)
