鼠李糖脂防治植物真菌病害研究进展
2017-12-22毛玉玲许汉亮林明江李继虎胡玉伟管楚雄
王 蕾,毛玉玲,许汉亮,林明江,李继虎,胡玉伟,管楚雄
(广东省生物工程研究所(广州甘蔗糖业研究所),广东 广州 510316)
鼠李糖脂防治植物真菌病害研究进展
王 蕾,毛玉玲,许汉亮,林明江,李继虎,胡玉伟,管楚雄
(广东省生物工程研究所(广州甘蔗糖业研究所),广东 广州 510316)
鼠李糖脂是一种环境友好型生物表面活性剂,在环境保护、食品、医药以及病虫害防治等方面具有广阔的应用前景。综述了鼠李糖脂在植物真菌病害防控上的应用及研究进展;从水解真菌孢子、改变真菌细胞膜通透性、诱导植株产生防御反应等3个方面探讨了鼠李糖脂对植物真菌病害的防治途径;指出了目前在农业上应用鼠李糖脂所遇到的问题和困难,并对鼠李糖脂作为生物农药在防治植物真菌病害的应用进行了展望。
鼠李糖脂;植物真菌病害;生物防治
植物病害严重威胁农作物生产的安全和稳定,在植物病害中,大部分病害是病原真菌侵染所引致,植物真菌病害对作物产量和品质造成了严重的威胁。虽然化学农药对多种植物真菌有一定的防治效果,但长期使用化学农药不仅造成环境污染、农产品农药残留等问题,也使病原菌产生了严重的抗药性。利用生物表面活性剂对植物病害进行生物防控,以减轻过量使用化学农药带来的种种不利影响,引起了各国科学家的广泛关注[1-4]。鼠李糖脂是一种由铜绿假单胞菌(Pseudomonas Aeruginosa)发酵产生的一种阴离子生物表面活性剂,鼠李糖脂溶于甲醇、氯仿和乙醚,在碱性溶液中也表现出良好的溶解性,具有乳化、破乳、消泡、洗涤、分散、絮凝和抗静电等多种功能。在环境、食品、医药和农业等多个领域具有广泛的应用价值。近年来,在农业方面,鼠李糖脂不仅能用于防控绿色桃蚜(Myzus persicae)、斜纹夜蛾(Spodoptera litura)等农业害虫,还能有效防治大豆根腐病(Phytophthora sojae)、甘蔗赤腐病(Colletotrichum falcatum)、玉米穗腐病(Fusarium verticillioides)等植物病害[4-7]。
本文通过综述鼠李糖脂防治真菌病害的研究进展,分析其防病机理及存在问题,并提出鼠李糖脂在农业上的发展前景,以期为鼠李糖脂用于植物真菌病害的生物防控研究及应用提供参考建议。
1 鼠李糖脂概述
鼠李糖脂在1949年已见报道,铜绿假单胞菌在液体培养基中主要产生单鼠李糖脂和双鼠李糖脂,铜绿假单胞菌可利用植物油、废油、烃类等疏水性碳源和葡萄糖、甘油、乙醇等亲水性碳源发酵产生鼠李糖脂[8-9]。目前,在我国鼠李糖脂的研究主要集中在环境保护、食品和医药等方面,在环境保护方面,鼠李糖脂能帮助修复土壤中的铅、镉、镍等重金属,也可用于修复多环芳烃的污染[10-11];在食品方面,鼠李糖脂可做乳化剂改善面粉的流变学特性、乳化脂肪组织增强食品的口感,也可用于果蔬的保藏[12-13];在医药方面,鼠李糖脂能抗真菌和细菌感染,可以用作治疗皮肤病、病毒性感染及抑制癌细胞扩散等疾病[14-15]。鼠李糖脂无毒无害、生物可降解,在农业上主要作农业助剂来使用,鼠李糖脂对植物真菌病害有较好的预防作用,未来也可用于开发真菌抑菌剂类的生物农药制剂。
2 鼠李糖脂防治真菌病害的机制
鼠李糖脂作为一种绿色表面活性剂,现已有多项研究表明鼠李糖脂能用于防治植物真菌性病害。综合有关研究,鼠李糖脂对植物真菌病害的防治作用机理主要体现见表1。
2.1 水解真菌孢子
鼠李糖脂可破坏真菌的细胞膜,使孢子丧失移动性并快速水解,进而抑制真菌孢子萌发和菌丝生长,如图1所示。Stanghellini等[25]研究发现浓度为30 μg/mL鼠李糖脂能使辣椒疫霉病和黄瓜腐霉病孢子在1 min内全部完全水解。鼠李糖脂瓦解真菌孢子细胞壁,促使植物病菌死亡,在葡萄灰霉病、大豆疫霉菌、辣椒炭疽病上也同样发现鼠李糖脂有溶解真菌细胞壁的作用[6,19,24]。真菌细胞壁主要由几丁质和 β-1,3-葡聚糖组成,几丁质在细胞壁内部,葡聚糖在细胞壁内外部均有。鼠李糖脂处理被真菌病害侵染的植物之后,植物体内几丁质酶和β-1,3-葡聚糖酶增加,病原菌细胞壁被水解酶破坏,菌丝细胞壁变薄,破碎,最终死亡[19,25]。
此外,鼠李糖脂能阻止病菌孢子的移动,降低病菌对植株的侵染率[6,24,26]。鼠李糖脂在土壤中有很好的溶解性和分散性,高浓度的鼠李糖脂在土壤中能有效阻止孢子移动,降低其对植物的侵染,从而达到预防植物病害的目的。
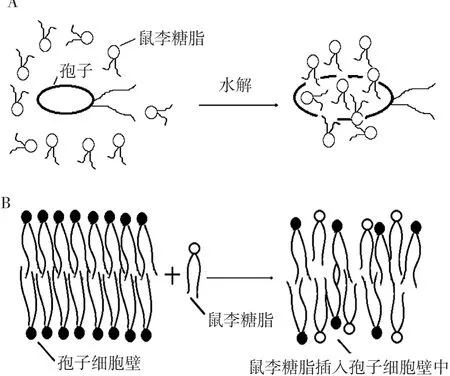
图1 鼠李糖脂水解真菌孢子示意图[25]
2.2 改变真菌细胞膜通透性
Yan等[27]研究发现,与对照相比,鼠李糖脂处理后的互隔交链孢菌(Alternaria alternate)悬浮液中核酸浓度增加,菌丝DNA和蛋白质浓度降低,说明互隔交链孢菌通透性增加,电解质渗出率增大。鼠李糖脂通过改变真菌细胞膜通透性来抑制真菌孢子萌发和菌丝生长的机制总结起来有3种:第一种是离子表面活性剂对真菌细胞膜具有破坏作用,能使胞内电解质大量渗出,导致菌体细胞膜通透性增加;且生物表面活性剂能插入病原菌的细胞膜形成孔洞,造成细胞跨膜通道的H+、Ca2+、K+浓度发生变化,导致质膜的pH梯度崩溃,造成细胞死亡[13,28]。第二种是生物表面活性剂具有两亲性(既亲水又亲油),可与病原菌细胞膜发生作用,使细胞表面发生变化,细胞膜通透性增加,促使表面活性剂和有毒化合物更易通过细胞内膜进入细胞内,进而导致细胞内部结构发生变化,从而导致细胞死亡[29-31]。第三种是离子表面活性剂其分子在水中带电荷,可以吸附于带相反电荷的细菌菌体表面,形成紧密排列的界面分子膜,阻碍了菌体的呼吸或切断了营养物质的来源,并逐步渗入细胞类脂层,改变细胞膜通透性,使细胞内含物外渗,导致菌体死亡[32-33]。研究发现,鼠李糖脂能增加吩嗪的溶解性,能在霉菌菌丝表面形成膜,使抗生素更加靠近菌丝体,并使菌丝细胞壁变通透,帮助抗生素通过霉菌细胞壁和细胞膜[34]。
2.3 诱导抗性
植物与病原体协同进化过程中,逐渐形成了一系列的高效保护机制来抵御病原物的侵害。植物免疫系统分两个层次,第一个层次是由病原相关分子模式(PAMPs)触发的免疫反应(PTI);第二个层次是触发性免疫(ETI);PTI和ETI都属于免疫信号,但PTI比ETI更加强烈和持久[35-37]。
茉莉酸、水杨酸和乙烯在植物PTI和ETI信息网络中起着关键的作用。鼠李糖脂可促使拟南芥防御基因PR-1(水杨酸标记基因),PDF1.2(茉莉酸/乙烯标记基因)和 PR-4(乙烯标记基因)表达,触发拟南芥的防御反应[21]。在西瓜、葡萄、小麦和烟草中,鼠李糖脂诱导植物免疫反应也有报道[16,19,38]。鼠李糖脂能激活PTI,预防葡萄灰霉病的发生,用0.025 mg/mL鼠李糖脂处理灰霉病感染的葡萄叶片,与对照相比几丁质酶基因表达高达320倍[19]。几丁质酶和β-1,3-葡聚糖酶属于水解酶类的病程相关蛋白(PRS)也属于防御产物,与植物系统诱导性抗性(ISR)密切相关。鼠李糖脂能在室温条件下通过诱导植物抗性反应来预防西瓜枯萎病,与对照相比,喷施1.0 g/L的鼠李糖脂,可使西瓜叶片几丁质酶和β-1,3-葡聚糖酶分别升高49.95 %和63.04 %[20]。在酶水解真菌细胞壁过程中,细胞壁可释放出寡糖,可作为植物多种抗病反应的激发因子,诱导植物抗病反应[39]。鼠李糖脂能促使植物抗性基因表达,激活植物自身免疫系统,诱导植物对病原菌产生抗性,从而使植物免受病菌的侵害。
3 鼠李糖脂在植物真菌病害防治上的应用前景及存在问题
农业病害的生物防控已成为目前研究的一大热点。国内外研究表明鼠李糖脂防治植物真菌病害效果显著,2004年美国环保署已通过鼠李糖脂作为生物农药的备案,鼠李糖脂作为一种生物表面活性剂,不仅能单独做生物农药使用,也可做助溶剂、表面活性剂、乳化剂等与抗生素一起使用。虽然鼠李糖脂对植物真菌病害有很好的防治效果,但到目前为止,农业上进行商业化应用的鼠李糖脂却很少见。鼠李糖脂的防病机理、生产成本以及安全性等方面存在的一些问题可能限制了目前鼠李糖脂在农业上的大规模使用。
3.1 防治机理研究不够深入
尽管国外对鼠李糖脂防治植物真菌病害做了很多研究,但关于鼠李糖脂对真菌孢子的抑制机制仍然不十分清楚,对于鼠李糖脂是如何水解真菌孢子、抑制孢子萌发和生长仍有待进一步研究。植物自身防御反应的机制复杂,关于鼠李糖脂是如何触发植物自身防御反应,也有待研究。未来可从鼠李糖脂对真菌病菌细胞壁、细胞膜、蛋白合成系统和能量代谢系统等方面着手研究;也可从生物化学、分子生物学等角度,利用分子、蛋白、基因芯片等手段进行进一步研究,揭示鼠李糖脂防治植物真菌病害的机制;另外,可从植物根系和土壤方面研究鼠李糖脂对植物真菌病害的防治机制。
3.2 生产成本过高
鼠李糖脂作为一种环境友好型生物表面活性剂,一直以来都是人们关注的热点,但鼠李糖脂生产成本过高,目前在我国农业上尚未实现大规模应用。鼠李糖脂培养基成本占到了整个生产成本的50%,碳源更是鼠李糖脂生产中的限制因素,因此,寻找廉价可持续利用的碳源,已成为降低鼠李糖脂生产成本的关键因素。目前,为了降低鼠李糖脂的生产成本,越来越多的采用废弃食用油、皂角、糖蜜、酒精废液等工农业废弃物作为生产原料[40]。
3.3 安全性问题
鼠李糖脂的生产菌铜绿假单胞菌是一种人类条件致病菌,不适合大规模应用于工业生产中。选育鼠李糖脂高产菌株及非致病的宿主菌已成为目前的当务之急,目前已有利用基因工程等手段对鼠李糖脂生产菌株进行改性,有望未来生产更安全的鼠李糖脂[41]。
4 展望
尽管前人对鼠李糖脂防治真菌病害的机制进行了许多有益的探索,但相关机制目前尚未完全清楚,有待进一步研究。鼠李糖脂作为一种生物表面活性剂既可单独作为生物农药又可辅助其他抗生素使用,未来可用来防控蔬菜、果树、茶树等经济作物的真菌病害,提升作物的经济价值;此外,鼠李糖脂还可用在肥料生产中,作为种肥杀菌剂、渗透剂、铺展剂等使用,其应用前景广阔。目前,在我国农业上,鼠李糖脂已用在部分功能性肥料上,并取得显著效果。随着鼠李糖脂生产技术的改进,廉价安全的鼠李糖脂作为一种真菌杀菌剂在农业上的应用将越来越广泛。
[1] Sha R,Jiang L,Meng Q,et al. Producing cellfree culture broth of rhamnolipids as a costeffective fungicide against plant pathogens[J].Journal of Basic Microbiology,2012,52(4):458-466.
[2] Miao S,Dashtbozorg S S,Callow N V,et al. Rhamnolipids as platform molecules for production of potential anti-zoospore agrochemicals[J]. Journal of Agricultural &Food Chemistry,2015,63(13):3367-3376.
[3] Lahkar J,Borah S N,Deka S,et al. Biosurfactant of Pseudomonas aeruginosa JS29 against Alternaria solani:the causal organism of early blight of tomato[J]. BioControl,2015,60(3):401-411.
[4] Borah S N,Goswami D,Sarma H K,et al.Rhamnolipid Biosurfactant against Fusarium verticillioides to Control Stalk and Ear Rot Disease of Maize[J]. Frontiers in Microbiology,2016,7:1501.
[5] Kim B S,Lee J Y,Hwang B K. In vivo control and in vitro antifungal activity of rhamnolipid B,a glycolipid antibiotic,against Phytophthora capsici and Colletotrichum orbiculare[J].Pest Management Science,2000,56(12):1029-1035.
[6] Soltani Dashtbozorg S,Miao S,Ju L.Rhamnolipids as environmentally friendly biopesticide against plant pathogen Phytophthora sojae[J]. Environmental Progress & Sustainable Energy,2016,35(1):169-173.
[7] Goswami D,Borah S N,Lahkar J,et al.Antifungal properties of rhamnolipid produced by Pseudomonas aeruginosa DS9 against Colletotrichum falcatum[J]. Journal of Basic Microbiology,2015,55(11):1265-1274.
[8] Edwards J R,Hayashi J A. Structure of a rhamnolipid from Pseudomonas aeruginosa[J].Archives of Biochemistry and Biophysics,1965,111(2):415-421.
[9] 范强,刘余,徐熠鎏,等. 餐厨废油资源化产鼠李糖脂的研究进展[J]. 化学与生物工程,2015(3):6-10.
[10] 孟蝶,万金忠,张胜田,等. 鼠李糖脂对林丹—— 重金属复合污染土壤的同步淋洗效果研究[J]. 环境科学学报,2014,34(1):229-237.
[11] 郑学昊,孙丽娜,王晓旭,等. 植物—— 微生物联合修复PAHs污染土壤的调控措施对比研究[J]. 生态环境学报,2017,26(2):323-327.
[12] 侯占群,高彦祥. 生物表面活性剂及其在食品工业中的应用进展[J]. 食品研究与开发,2010,31(4):170-174.
[13] Yan F,Xu S,Chen Y,et al. Effect of rhamnolipids on Rhodotorula glutinis biocontrol of Alternaria alternata infection in cherry tomato fruit[J]. Postharvest Biology & Technology,2014,97(3):32-35.
[14] Stipcevic T,Piljac A,Piljac G. Enhanced healing of full-thickness burn wounds using di-rhamnolipid[J]. Burns:journal of the International Society for Burn Injuries,2006,32(1):24-34.
[15] Jiang L,Shen C,Long X,et al. Rhamnolipids elicit the same cytotoxic sensitivity between cancer cell and normal cell by reducing surface tension of culture medium[J]. Applied Microbiology & Biotechnology,2014,98(24):10187-10196.
[16] Stanghellini M E,Miller R M. Biosurfactants:Their identity and potential efficacy in the biological control of zoosporic plant pathogens[J]. Plant disease,1997,81(1):4-12.
[17] De Jonghe K,De Dobbelaere I,Sarrazyn R,et al. Control of Phytophthora cryptogea in the hydroponic forcing of witloof chicory with the rhamnolipid based-biosurfactant formulation PRO1[J]. Plant Pathology,2005,54(2):219-226.
[18] Perneel M,D’Hondt L,Maeyer K D,et al.Phenazines and biosurfactants interact in the biological control of soil-borne diseases caused by Pythium spp.[J]. Environmental Microbiology,2008,10(3):778-788.
[19] Varnier A L,Sanchez L,Vatsa P,et al. Bacterial rhamnolipids are novel MAMPs conferring resistance to Botrytis cinerea in grapevine[J].Plant,Cell & Environment,2009,32(2):178-193.
[20] 刘菊. 鼠李糖脂对西瓜枯萎病防治作用的研究[D]. 杭州:浙江大学,2012.
[21] Sanchez L,Courteaux B,Hubert J,et al.Rhamnolipids Elicit Defense Responses and Induce Disease Resistance against Biotrophic,Hemibiotrophic,and Necrotrophic Pathogens That Require Different Signaling Pathways in Arabidopsis and Highlight a Central Role for Salicylic Acid[J] . Plant Physiology,2012,160(3) :1630-1641.
[22] Goswami D,Handique P J,Deka S. Rhamnolipid biosurfactant against Fusarium sacchari the causal organism of pokkah boeng disease of sugarcane[J]. Journal of Basic Microbiology,2014,54(6):548-557.
[23] Borah S N,Goswami D,Lahkar J,et al.Rhamnolipid produced by Pseudomonas aeruginosa SS14 causes complete suppression of wilt by Fusarium oxysporum f. sp. pisi in Pisum sativum[J]. BioControl,2015,60(3):375-385.
[24] Lahkar J,Goswami D,Deka S,et al. Novel approaches for application of biosurfactant produced by Pseudomonas aeruginosa,for biocontrol of Colletotrichum capsici,responsible for anthracnose disease in chilli[J]. European Journal of Plant Pathology,2017:1-15.
[25] Stanghellini M E,Kim D H,Rasmussen S L,et al. Control of root rot of peppers caused by Phytophthora capsici with a nonionic surfactant[J]. Plant disease,1996,80(10):1113-1116.
[26] Araujo L V D,Guimarães C R,Marquita R L D S,et al. Rhamnolipid and surfactin:Antiadhesion/antibiofilm and antimicrobial effects[J]. Food Control,2016,63:171-178.
[27] Yan F,Xu S,Guo J,et al. Biocontrol of postharvest Alternaria alternata decay of cherry tomatoes with rhamnolipids and possible mechanisms of action.[J]. Journal of the Science of Food & Agriculture,2015,95(7):1469-1474.
[28] Bender C L,Scholz-Schroeder B K. New insights into the biosynthesis,mode of action,and regulation of syringomycin,syringopeptin,and coronatine[M]. Virulence and Gene Regulation.Springer US,2004:125-158.
[29] Al-Tahhan R A,Sandrin T R,Bodour A A,et al. Rhamnolipid-induced removal of lipopolysaccharide from Pseudomonas aeruginosa:effect on cell surface properties and interaction with hydrophobic substrates[J].Applied and Environmental Microbiology,2000,66(8):3262-3268.
[30] D’aes J,De Maeyer K,Pauwelyn E,et al.Biosurfactants in plant Pseudomonas interactions and their importance to biocontrol[J].Environmental Microbiology Reports,2010,2(3):359-372.
[31] Vasileva-Tonkova E,Sotirova A,Galabova D. The Effect of Rhamnolipid Biosurfactant Produced by Pseudomonas fluorescens on Model Bacterial Strains and Isolates from Industrial Wastewater[J] . Current Microbiology,2011 ,62(2):427-433.
[32] 薛文青,薛广波. 季铵盐类阳离子表面活性消毒剂研究进展[J]. 中华医院感染学杂志,2002,12(8):634-636.
[33] Sotirova A,Avramova T,Stoitsova S,et al. The Importance of Rhamnolipid-Biosurfactant-Induced Changes in Bacterial Membrane Lipids of Bacillus subtilis for the Antimicrobial Activity of Thiosulfonates[J] . Current microbiology,2012 ,65(5):534-541.
[34] Rahman K S M,Banat I M,Thahira J,et al.Bioremediation of gasoline contaminated soil by a bacterial consortium amended with poultry litter,coir pith and rhamnolipid biosurfactant[J].Bioresource Technology,2002,81(1):25-32.
[35] Boller T,Felix G. A renaissance of elicitors:perception of microbe-associated molecular patterns and danger signals by patternrecognition receptors[J]. Annual Review of Plant Biology,2009,60:379-406.
[36] Dodds P N,Rathjen J P. Plant immunity:towards an integrated view of plant-pathogen interactions[J]. Nature Reviews Genetics,2010,11(8):539-548.
[37] Katagiri F,Tsuda K. Understanding the plant immune system[J]. Molecular Plant-microbe Interactions,2010,23(12):1531-1536.
[38] Vatsa P,Sanchez L,Clement C,et al.Rhamnolipid Biosurfactants as New Players in Animal and Plant Defense against Microbes[J].International Journal of Molecular Sciences,2010,11(12):5095-5108.
[39] Klarzynski O,Plesse B,Joubert J M,et al.Linear β-1,3 Glucans Are Elicitors of Defense Responses in Tobacco[J]. Plant Physiology,2000,124(3):1027-1037.
[40] 吴虹,汪薇,韩双艳. 鼠李糖脂生物表面活性剂的研究进展[J]. 微生物学通报,2007,34(1):0148-0152.
[41] 孙瑾. 鼠李糖脂高产菌株的诱变筛选及遗传改造[D]. 济南:山东大学,2015.
Research progress on rhamnolipid in the control of plant fungal disease
WANG Lei,MAO Yu-ling,XU Han-liang,LIN Ming-jiang,LI Ji-hu,HU Yu-wei,GUAN Chu-xiong
(Guangzhou Provincial Bioengineering Institute(Guangzhou Sugarcane Industry Research Institute),Guangzhou 510316,China)
Rhamnolipid is an environment-friendly biosurfactant,has widely applied prospect in environmental protection,food,medicine,disease and pest control of plant. The article summarized the application and research progress of rhamnolipid in controlling plant fungicidal disease;And discussed the disease control method of rhamnolipid from hydrolyzing fungal spores,changing cell membrane penetrability,activating plant defense response. The problem and difficulty of rhamnolipid application were also exposed in agriculture. The prospect of rhamnolipid in control of plant fungal disease at last.
rhamnolipid ;plant fungal disease;biological control
S482.2+8
A
1004-874X(2017)08-
王蕾,毛玉玲,许汉亮,等. 鼠李糖脂防治植物真菌病害研究进展[J].广东农业科学,2017,44(8):90-95.
2017-06-14
广东省科技发展专项(2016A020209001, 2017B020202004, 2016A020210015, 2016A020210013);广州市科技创新人才专项(201710010036)
王蕾(1988-),女,硕士,助理研究员,E-mail:kishi218@163.com
管楚雄(1961-),男,研究员,E-mail:cxguan@126.com
(责任编辑 杨贤智)
