紫外照射对灵芝菌丝体多糖的影响
2017-12-22黄嘉玲林怡丽
张 帅,黄嘉玲,林怡丽,程 昊
(1.肇庆学院化学化工学院,广东 肇庆 526061;2. 广西科技大学生物与化学工程学院,广西 柳州 545006;3. 广西蔗糖产业协同创新中心,广西 南宁 530004)
紫外照射对灵芝菌丝体多糖的影响
张 帅1,黄嘉玲1,林怡丽1,程 昊2,3
(1.肇庆学院化学化工学院,广东 肇庆 526061;2. 广西科技大学生物与化学工程学院,广西 柳州 545006;3. 广西蔗糖产业协同创新中心,广西 南宁 530004)
采用紫外照射诱导菌种的方法可使灵芝菌丝体多糖含量增加。首先考察了不同紫外照射时间和功率对灵芝菌丝体形态、生长速度及多糖含量的影响,发现小功率、短时间的照射有利于菌丝体的生长,并可提高菌丝体多糖的含量,而大功率、长时间的照射则会对灵芝菌丝体产生相反的影响。然后通过正交试验,确定了紫外照射提高灵芝菌丝体多糖含量的最优条件,即用20 W的紫外灯照射灵芝菌种10 min,灵芝菌丝体多糖含量可达9.57%,比未经紫外照射的灵芝菌丝体多糖含量提高了3.45%。另外,将未紫外照射和在最优条件下紫外照射的灵芝的菌丝体多糖进行抗氧化能力比较,发现二者清除·OH和O2-·自由基能力无明显差异。
紫外照射;灵芝;菌丝体;多糖;抗氧化
灵芝(Ganoderma lucidum)是担子菌纲多孔菌科灵芝属真菌,是一种含有多种氨基酸、生物碱、多糖及三萜类化合物等生物活性成分的珍贵食用菌[1],尤其是灵芝中的β-(1→3)葡聚糖具有较强的抗肿瘤和提高免疫力功能,是灵芝研究和利用最广泛的活性因子[2-4]。然而,无论是灵芝菌丝体还是子实体,其多糖含量并不高[5],导致目前市场上灵芝多糖保健产品的生理活性不甚理想且生产成本较高,因而提高灵芝多糖含量,可使灵芝这一宝贵“药食两用”资源得到更加高效的利用,使灵芝产品的市场前景更加广阔。
目前提高食用菌多糖含量的方法主要是优化发酵条件及基因工程技术。如肖雷等[6]和杨孝丽等[7]通过优化液体深层发酵条件分别提高了灵芝多糖和灰树花多糖的含量,而张帆等[8]则通过过量表达尿苷二磷酸葡萄糖焦磷酸化酶基因OsUgp2提高了紫芝多糖含量。采用基因工程技术,食用菌胞内多糖和胞外多糖均可得到有效提高,但基因工程技术复杂,对设备和人员技术要求较高;而通过优化发酵条件通常只能提高食用菌胞外多糖含量。
紫外线是一种非电离照射,低剂量时通常不会杀死菌种,只能导致DNA突变,从而引起菌种生理特征和生物性状的变化。相比X-射线、γ-射线等电离辐射,紫外线易获得,且对人体健康危害较小,因此紫外照射在菌种诱变方面得到了广泛应用[9]。通过菌种诱变来提高微生物胞外多糖含量已有较多研究[10-12],但对其胞内多糖含量的影响却鲜见报道。通过紫外线诱变灵芝菌种,使细胞DNA突变,有可能引起灵芝生长过程中多糖等活性成分的变化。本研究首先用紫外线诱变灵芝菌种,然后对诱变的灵芝菌种进行培养,观察灵芝菌丝体的形态及测定菌丝体中的胞内多糖含量,并考察胞内多糖含量的变化趋势,从而确定紫外照射对灵芝胞内多糖(简称灵芝多糖)含量的影响关系,并获得提高灵芝多糖含量的最优紫外照射条件。本研究为提高灵芝多糖含量提供了一种简单有效的方法,可为其他食用菌活性成分的提高提供方法借鉴,这对我国食用菌行业的发展以及食用菌产品的深加工具有重要意义。
1 材料与方法
1.1 试验材料
赤灵芝菌种,肇庆学院微生物实验室试管保藏。
马铃薯葡萄糖琼脂(PDA)培养基(广东环凯微生物科技有限公司),依说明书配好后分装试管和平面皿,灭菌后做成PDA斜面和PDA平板若干,冷藏备用。
灵芝液体培养基:250 mL锥形瓶中加入体积比40%的水,20 g/L的葡萄糖,8 g/L的胰蛋白胨,4 g/L的 KH2PO4,3 g/L的 MgSO4·7H2O,加热搅拌充分溶解,灭菌后冷却。
苯酚、硫酸、葡萄糖、胰蛋白胨、KH2PO4、MgSO4·7H2O、氯仿、正丁醇、邻苯三酚、水杨酸、FeSO4、H2O2、三羟甲基氨基甲烷(Tris)等试剂均为国产分析纯。
1.2 试验方法
1.2.1 菌种活化 无菌条件下,将灵芝菌种接于PDA斜面若干,置于生化培养箱25℃培养至菌丝长满试管。
1.2.2 紫外诱导 参考Fu等[13]的方法并作改进。无菌条件下,从活化好的的灵芝PDA斜面中取5 mm2大小的菌块接至PDA平板,置于生化培养箱25℃倒置培养72 h,然后将PDA平板分别置于不同功率紫外灯下45 cm处开盖照射不同时间,每个照射处理3次重复,照射完成后用锡纸包裹(防止光复活),置25℃生化培养箱中培养。
1.2.3 菌种筛选 选取各照射处理中菌丝体形态(色泽、边缘整齐度)及长势良好的菌体接至PDA斜面培养,每个照射处理接3管。25℃培养14 d,每个照射处理选出1支菌丝体形态和长势最好的菌种转至液体培养。
1.2.4 菌丝体生长速度的测定 参考何明霞等[14]的方法并作改进。无菌条件下,将直径5 mm的菌块接种于PDA平板上,置于生化培养箱25℃倒置培养14 d,用十字交叉法测量菌落直径,计算菌丝体生长速度(mm/d)。每株3个重复。
1.2.5 液体培养 无菌条件下,将筛选出的菌种接至液体培养基,25℃培养7 d,滤出灵芝菌丝体并洗涤3次,再用85%乙醇处理,以除去湿菌体中的脂类物质,同时使糖苷酶失活,防止多糖降解。将菌丝体60℃干燥48 h后研成粉末。
1.2.6 多糖提取 参考Li等[15]的方法并作改进。分别称取各照射处理菌丝体粉末0.3 g,加15 mL水70 ℃提取3 h,冷却,4,000 r/min离心15 min,取上清液。用Sevag法[16]除蛋白,加入0.2倍溶液体积的氯仿和0.04倍溶液体积的正丁醇剧烈振荡30 min,除去蛋白乳化层,取上清液,同法重复3次,上清液补水至15 mL,摇匀,再移取1~100 mL容量瓶,定容、摇匀,得灵芝多糖样液。
1.2.7 多糖测定 采用改进的苯酚-硫酸法[17-18]测定多糖含量。配制0.1 mg/mL葡萄糖标准溶液,分别吸取 0.2、0.4、0.6、0.8、1.0、1.2、1.4 mL于试管中,各补水至2 mL,并加入6%苯酚溶液1.6 mL振荡。再加入7.5 mL浓硫酸,迅速振荡摇匀,室温静置。另取2 mL水作空白对照。490 nm处测定各溶液吸光度,以葡萄搪浓度为横坐标,吸光度为纵坐标,绘制标准曲线,得回归方程y = 10.95x + 0.017,R2= 0.9988,说明糖浓度在规定范围内线性良好。将各照射组灵芝多糖样液按上述方法处理,由标准曲线求出多糖浓度(以葡萄糖计),计算多糖含量:
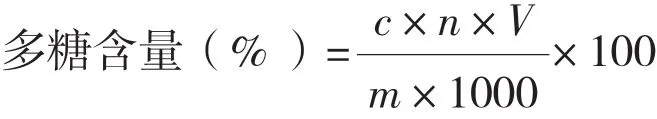
式中,c为样液多糖浓度(mg/mL),n为稀释倍数,V为样液体积(mL),m为样品质量(g)。
1.2.8 多糖抗氧化活性测定 分别对灵芝多糖清除羟基自由基(·OH)和超氧阴离子自由基(O2-·)的能力进行测定,用以表征灵芝多糖的抗氧化活性[19]。清除·OH和 O2-·能力测定均参考候学敏等[20]的方法并作改进。
(1) 清除·OH能力测定:将灵芝多糖样液用双蒸水稀释成一系列浓度的溶液。取10 mL试管若干,分别依次加入9 mmol/L FeSO4溶液2 mL、9 mmol/L水杨酸-乙醇溶液2 mL以及不同浓度多糖溶液2 mL(空白对照以双蒸水代替多糖样液),最后加入8.8 mol/L H2O2溶液2 mL,混匀并于37℃水浴30 min,离心(3 000 r/min,10 min)后取上清于波长510 nm处测定吸光度,参比溶液以双蒸水代替H2O2。计算·OH清除率(I2):
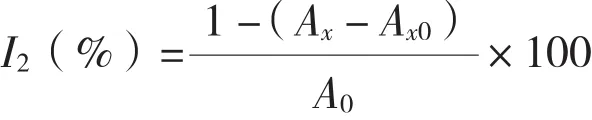
式中,A0为空白对照吸光度,Ax为加入样品溶液后的吸光度,Ax0为参比溶液吸光度。
(2)清除O2-·能力测定:取10 mL试管若干,分别加入pH 8.2的Tris-盐酸缓冲液4.5 mL,25℃水浴20 min,各试管再加入不同浓度的多糖溶液0.2 mL及30℃预热过的3 mmol/L邻苯三酚溶液0.3 mL(以10 mmol/L盐酸溶液配制),混匀后25℃水浴4 min,立即加4滴8 mol/L盐酸终止反应。以蒸馏水作空白对照,于波长325 nm处测定吸光度。计算O2-·清除率(I3):

式中,A0为空白对照吸光度,An为加入样品溶液后的吸光度。
2 结果与分析
2.1 紫外照射时间对灵芝菌丝体生长速度的影响
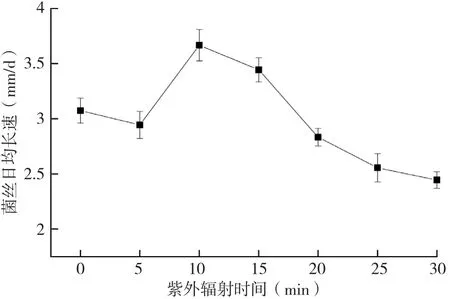
图1 紫外照射时间对灵芝菌丝体生长速度的影响
灵芝菌种经20 W紫外灯不同时间的紫外照射后,菌丝体生长速度对比见图1。由图1可知,灵芝菌种经紫外照射10 min和15 min后,菌丝体生长速度明显高于其他照射时间灵芝菌种的菌丝体生长速度,其中照射10 min的灵芝菌种,菌丝体生长最快。另外,未经紫外照射的菌种,其菌丝体生长速度高于照射5、20、25、30 min的菌种,表明灵芝菌种经紫外照射后,既可能导致菌丝体生长加快,也可能减慢菌丝体生长速度,较短和较长时间的紫外照射均不利于菌丝体的生长。
2.2 紫外照射时间对灵芝菌丝体形态的影响
灵芝菌种经20 W紫外灯不同时间的紫外照射后,菌丝体形态对比见表1。从表1可以看出,紫外照射10 min内的灵芝菌种,长出的菌丝洁白且边缘整齐,显示出良好的生长状况。随着紫外照射时间的延长,菌丝色泽加深变暗,且菌丝边缘不再整齐。因此,短时间的紫外照射,更有利于灵芝菌丝体的生长。

表1 紫外照射时间对灵芝菌丝形状的影响
2.3 紫外照射时间对灵芝菌丝体多糖含量的影响
灵芝菌种经20 W紫外灯不同时间的紫外照射后,菌丝体多糖含量对比见图2。从图2可以看出,灵芝菌种经紫外照射5、10、15 min后,相比未照射的菌种,菌丝体多糖含量均有所提高。其中,菌种照射10 min后,其菌丝体多糖含量比紫外照射前的结果提高3.1%。其他照射处理的菌种,其菌丝体多糖含量均大大下降,且照射时间越长,多糖含量下降幅度越大,其中菌种照射30 min后,其菌丝体多糖含量比紫外照射前的结果下降21.6%。可见,紫外照射对灵芝菌丝体中的多糖含量影响较大,短时间照射有利于菌丝体多糖含量的提高,但提高量并不显著,而长时间照射则会显著降低菌丝体中的多糖含量。
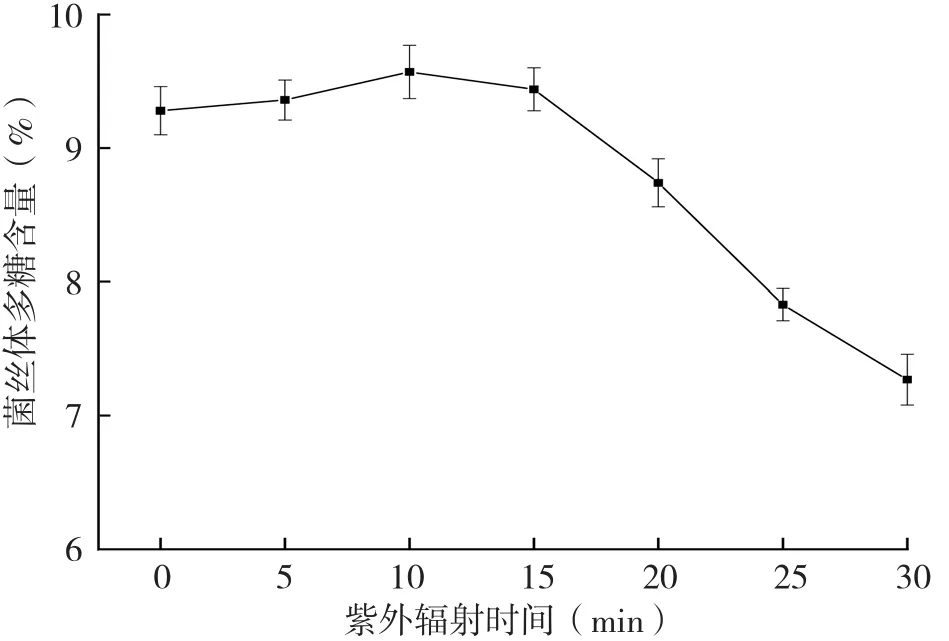
图2 紫外照射时间对灵芝菌丝体多糖含量的影响
2.4 紫外照射功率对灵芝菌丝体生长速度的影响
灵芝菌种经不同功率紫外灯紫外照射10 min后,菌丝体生长速度对比见图3。从图3可以看出,分别经10、20、30 W紫外灯照射10 min后的灵芝菌种,相比未照射的菌种,菌丝体生长速度明显提高,其中,经20 W紫外灯照射的菌种,其菌丝体生长速度最快,略高于30 W和10 W紫外灯照射的菌种的菌丝长速。而40 W紫外灯照射菌种的菌丝体长速明显低于未照射菌种。结果表明不同功率的紫外线照射对灵芝菌丝体生长速度的影响不同,功率为10~30 W的紫外照射有利于灵芝菌丝体的生长,但功率较高的紫外照射,会对菌丝体生长产生抑制。

图3 紫外照射功率对灵芝菌丝体生长速度的影响
2.5 紫外照射功率对灵芝菌丝体形态的影响
灵芝菌种经不同功率紫外灯照射10 min后,菌丝体形态对比见表2。由表2可知,随紫外照射功率的增大,灵芝菌丝密度呈下降趋势,菌丝色泽逐渐变暗,菌落边缘整齐度逐渐下降。其中10 W和20 W紫外灯照射10 min后的菌种,其菌丝体形态良好,与未照射菌种的菌丝体形态一致。表明功率较低时的紫外照射对菌丝体形态未产生明显影响,而功率较大时的紫外照射则对菌丝体形态产生不良影响。

表2 紫外照射功率对灵芝菌丝形状的影响
2.6 紫外照射功率对灵芝菌丝体多糖含量的影响
灵芝菌种经不同功率紫外灯照射10 min后,菌丝体多糖含量对比见图4。从图4可以看出,灵芝菌种经10、20、30 W紫外灯照射10 min后,相比未照射的菌种,菌丝体多糖含量均有所提高。其中,20 W紫外灯照射10 min后的菌种,其菌丝体多糖含量比紫外照射前的结果提高2.9%。而40 W紫外灯照射10 min的菌种,其菌丝体多糖含量相比紫外照射前的结果却大大下降。可见,紫外照射功率对灵芝菌丝体中的多糖含量影响较大,10~30 W的照射有利于菌丝体多糖含量的提高,而大功率的紫外照射则会显著降低菌丝体中的多糖含量。

图4 紫外照射功率对灵芝菌丝体多糖含量的影响
2.7 正交试验优化紫外照射条件
根据紫外照射时间和功率对灵芝菌丝体多糖含量的影响结果,设计三因子二水平L4(23)正交试验,优化紫外照射提高灵芝菌丝体多糖含量的条件。正交试验设计及结果见表3。由表3可知,紫外照射功率对菌丝体多糖含量的影响要大于紫外照射时间,最优照射条件为用20 W紫外灯照射灵芝菌种10 min,即试验2的条件,此时菌丝体多糖含量为9.57%,相比未经紫外照射的灵芝菌丝体多糖含量9.24%,提高3.45%。

表3 正交试验设计及结果
2.8 紫外照射前后灵芝菌丝体多糖抗氧化性比较
灵芝菌种经紫外照射后,其菌丝体多糖分子组成可能有所改变,因此需对灵芝菌种照射前后菌丝体多糖的生物活性进行比较。未照射菌种和经20 W紫外灯照射10 min后的菌种,其多糖抗氧化能力的比较结果见图5。由图5可知,灵芝菌种紫外照射前后,其菌丝体多糖清除·OH和O2-·能力无明显差异,且均随多糖浓度的增加而提高,二者抗氧化性一致。可见,灵芝菌种经20 W紫外灯照射10 min后,其菌丝体多糖可能仅含量有明显增加,而多糖分子组成可能无明显改变。
3 结论与讨论
紫外照射是一种应用广泛的菌种诱变方法。灵芝菌种经适当的紫外照射后,培养的菌丝体形态及生长速度均会发生变化,表明紫外照射可引起灵芝菌种某些生物性状发生改变,而这一改变表明菌丝体所含的某些活性物质如多糖含量也会发生变化。紫外照射时间和功率不同,对灵芝菌丝体中多糖含量的影响也不同,通过单因素和正交试验,优化了紫外照射提高灵芝菌丝体多糖含量的条件,即用20 W的紫外灯照射灵芝菌种10 min,灵芝菌丝体多糖含量可达9.57%,比未经紫外照射的灵芝菌丝体多糖含量提高3.45%。另外,将未紫外照射和在最优条件下紫外照射的灵芝菌丝体多糖抗氧化能力进行比较,发现二者清除·OH和O2-·的能力无明显差异。本试验首次考察了紫外线诱变灵芝菌种对灵芝菌丝体多糖含量的影响,并获得了通过紫外照射灵芝菌种来提高灵芝菌丝体多糖含量的条件。采用菌种紫外诱变来提高灵芝多糖的方法,简单易行且实用性强,因而有较好的应用前景。另外,因本研究仅对灵芝菌种紫外照射后对灵芝菌丝体多糖含量的影响进行考察,因而对灵芝子实体多糖以及灵芝培养过程中胞外多糖的含量及生物活性的影响有待进一步研究。

图5 紫外照射前后灵芝菌丝体多糖抗氧化性比较
[1] 林志彬. 灵芝的现代研究[M]. 第3版. 北京:北京大学医学出版社,2007.
[2] 张冬雪,熊婷,王晓玲,等. 灵芝菌丝体中β-葡聚糖的提取[J]. 菌物学报,2016,35(9): 1139-1150.
[3] Mohan K,Padmanaban A M,Uthayakumar V,et al. Effect of dietary Ganoderma lucidum polysaccharides on biological and physiological responses of the giant freshwater prawn Macrobrachium rosenbergii[J]. Aquaculture,2016,464:42-49.
[4] Liu G Z,Li Q,Shang N,et al. Functional and structural analyses of a 1,4-beta-endoglucanase from Ganoderma lucidum[J]. Enzyme and Microbial Technology,2016,86,67-74.
[5] 于华峥,刘艳芳,周帅,等. 灵芝子实体、菌丝体及孢子粉中多糖成分差异比较研究[J]. 菌物学报,2016,35(2):170-177.
[6] 肖雷,姚菁华,吕兆启. 优化发酵条件提高灵芝多糖产率的研究[J]. 食品科技,2007,32(8):126-129.
[7] 杨孝丽,刘美月,吴晓蕾,等. 深层发酵液优化提高灰树花中多糖产量的研究[J]. 食品研究与开发,2015,36(24):51-55.
[8] 张帆,钟威,穆虹,等. 过量表达OsUgp2基因提高紫芝多糖含量[J]. 菌物学报,2011,30(3):442-452.
[9] Megaw L,Clemens T,Dibben C,et al. Pregnancy outcome and ultraviolet radiation:A systematic review[J]. Environmental Research,2017,155:335-343.
[10] 张义平,刘玫,黄磊,等. 提高微生物胞外多糖产量的研究进展[J]. 食品工业,2014,35(6):231-234.
[11] Peng R,Fu Y,Zou J,et al. Improvement of polysaccharide and triterpenoid production of Ganoderma lucidum through mutagenesis of protoplasts[J]. Biotechnology & Biotechnological Equipment,2016,30(2):381-387.
[12] Liu B,Sun Z,Ma X,et al. Mutation Breeding of Extracellular Polysaccharide-Producing Microalga Crypthecodinium cohnii by a Novel Mutagenesis with Atmospheric and Room Temperature Plasma[J]. International Journal Of Molecular Sciences,2015,16(4):8201-8212.
[13] Fu G,Li R,Li K,et al. Optimization of liquidstate fermentation conditions for the glyphosate degradation enzyme production of strain Aspergillus oryzae by ultraviolet mutagenesis[J].Preparative Biochemistry & Biotechnology,2016,46(8):780-787.
[14] 何明霞,许欣景,高锋,等. 暗褐网柄牛肝菌优良菌株的筛选[J]. 食用菌学报,2017,24(1):33-38.
[15] Li H,Zhang D,Yue T,et al. Improved polysaccharide production in a submerged culture of Ganoderma lucidum by the heterologous expression of Vitreoscilla hemoglobin gene[J].Journal of Biotechnology,2016,217:132-137.
[16] Liu X C,Zhu Z Y,Tang Y L,et al. Structural properties of polysaccharides from cultivated fruit bodies and mycelium of Cordyceps militaris[J].Carbohydrate Polymers,2016,142:63-72.
[17] Qian Z G. Cellulase-assisted extraction of polysaccharides from Cucurbita moschata and their antibacterial activity [J]. Carbohydrate Polymers,2014,101:432-434.
[18] Junter G A,T hebault P,L ebr un L.Polysaccharide-based antibiofilm surfaces[J].Acta Biomaterialia,2016,30:13-25.
[19] Zhang J,Meng G,Zhai G,et al. Extraction,characterization and antioxidant activity of polysaccharides of spent mushroom compost of Ganoderma lucidum[J]. International Journal of Biological Macromolecules,2016,82:432-439.
[20] 侯学敏,李林霞,张直峰,等. 响应面法优化薄荷叶总黄酮提取工艺及抗氧化活性[J]. 食品科学,2013,34(6):124-128.
Effect of ultraviolet radiation on polysaccharides of Ganoderma lucidum mycelia
ZHANG Shuai1,HUANG Jia-ling1,LIN Yi-li1,CHENG Hao2,3
(1. College of Chemistry and Chemical Engineering,Zhaoqing University,Zhaoqing 526061,China;2. College of Biological & Chemical Engineering,Guangxi University of Science and Technology,Liuzhou 545006,China;3. Collaborative Innovation Center of Sugarcane Industry of Guangxi, Nanning 530004,China)
The content of polysaccharides from Ganoderma lucidum mycelia can be increased using the method of ultraviolet (UV) radiation introduction. The effects of different time and power of UV radiation on morphology,growth rate,and polysaccharides content of mycelia were firstly investigated. The results showed that UV radiation with low power and short time was conductive to mycelia growth and increasing polysaccharides content,and the opposite effects on those occurred under the condition of UV radiation with high power and long time. Then,the optimum UV radiation condition of increasing polysaccharides content was obtained by orthogonal test,that was,G. lucidum strains was radiated for 10 min using a UV lamp with 20 W,and the mycelia polysaccharides content can reach 9.57%,which was 3.45% higher than that of without UV radiation. In addition,the antioxidant ability of mycelia polysaccharides from G. lucidum radiated by UV under the optimum conditions was compared with that without UV radiation. The results indicated that ·OH and O2-· scavenging capacities of the two polysaccharides were not significantly different.
ultraviolet radiation ;Ganoderma lucidum ;mycelia;polysaccharides;antioxidation
S646.9
A
1004-874X(2017)08-0026-07
张 帅,黄嘉玲,林怡丽,等. 紫外照射对灵芝菌丝体多糖的影响[J].广东农业科学,2017,44(8):26-32.
2017-05-10
广东省大学生创新创业训练计划项目(201610580050);广西高等学校高水平创新团队及卓越学者计划项目(2016TZYKF01)
张帅(1978-),男,博士,副教授,E-mail:Shuaizhang78525@hotmail.com
程昊(1980-),男,硕士,副教授,E-mail:iamchenghao@163.com
(责任编辑 杨贤智)
