Ni掺杂对Ni/MgO体系中电荷分配影响
2017-12-21郭云鹏李文英
郭云鹏 冯 杰 李文英
Ni掺杂对Ni/MgO体系中电荷分配影响
郭云鹏 冯 杰 李文英*
(太原理工大学,山西省煤科学与技术省部共建国家重点实验培育基地,太原 030024)
采用密度泛函理论(DFT)计算方法,研究了载体Ni掺杂对Ni/MgO催化剂的电子结构及其对CH4/CO2重整反应的影响。结果显示,随着载体Ni : Mg比的增加,CH4解离吸附和CH氧化过程的反应能垒均会随之升高,CH也更容易产生热解C,从而导致催化剂的活性和稳定性的下降。通过分析重整过程的Hirshfeld电荷分配,发现金属载体之间电子转移的方向会随着载体中Ni含量的上升由载体向Ni金属转移变为由Ni金属向载体转移。当Ni金属富电子时,反应物活化时电子的转移主要发生在表层Ni原子与吸附物种之间,参与氧化的CH物种为CH2;当Ni金属缺电子时,反应物活化时Ni簇的电子结构基本保持稳定,电子主要在载体表层的Ni原子与反应物之间转移,CH是主要参与氧化的CH物种。
CH4/CO2重整;Ni/MgO;Ni掺杂;电荷分配;DFT
1 引言
Ni基催化剂对CH4/CO2重整反应具有良好的催化活性和选择性,但易因积碳而失活1–4。以MgO为载体制备的Ni/MgO催化剂在CH4/CO2重整反应体现了良好的反应活性和稳定性,具有良好的工业应用前景5–7。
对于CH4/CO2重整反应,研究者普遍认为,碱性载体有助于提高催化剂的稳定性8–11。对于Ni/MgO体系,MgO可以从以下几方面影响催化剂的抗积碳性能:1) 减小Ni颗粒尺寸。高温焙烧形成的NiO与MgO固溶体可以提高NiO的还原温度,从而易于获得具有小Ni颗粒的尺寸和高分散性的催化剂5,12–14。2) 强化CO2吸附。Guo等15在Ni/Al2O3体系中引入MgO后发现CH4/CO2重整反应10 h后催化剂的积碳量明显减少,他们将其归结于MgO增强了CO2的吸附;Garcia等16在Ni/ZrO2体系中引入MgO也得到了类似的结论。3) 金属载体相互作用。一方面,Ni与MgO之间较强的金属载体相互作用有助于维持Ni颗粒的尺寸并抑制Ni的烧结17,18;另一方面,载体会影响金属的电子结构从而影响了催化剂的活性和选择性19–22。史克英等23发现CeO2和MgO作为助剂可以有效减少Ni/Al2O3上的积碳,通过X射线光电子能谱(XPS)分析表明这两种助剂可以提高Ni的电子密度。在之前的DFT研究中,我们发现MgO载体可以为Ni金属簇提供电子,通过改变Ni簇的电子结构来影响CH4/CO2重整过程24。在Ni/MgO催化剂实际制备中,由于NiO-MgO固溶体的特性,即使Ni负载量不同,也可以通过对焙烧和还原条件的调变获得具有相同Ni金属颗粒尺寸的催化剂。当Ni/MgO催化剂的载体为NiO-MgO固溶体时,由于NiO的碱性弱于MgO,载体的供电子能力将弱于纯MgO,Ni簇的结构以及CH4/CO2重整过程也会发生相应的改变。在Ni颗粒尺寸相同的情况下,载体中Ni的掺杂势必会对Ni/MgO催化剂的活性和稳定性产生影响。
为了考察Ni掺杂对Ni/MgO催化剂的电子结构以及对CH4/CO2重整反应过程的影响,本文构建了含有不同Ni : Mg比载体的Ni8/NiMgO(100)模型,并对此模型上的重整反应进行了模拟,通过对催化剂电子结构和反应路径的分析,希望获得载体Ni掺杂对CH4/CO2重整反应的影响及其本质,为实际的催化剂制备提供理论指导。
2 实验部分
所有的计算均在Materials Studio 6.0程序包中运用CASTEP模块进行25,26。电子的交换相关采用了广义密度近似(GGA)的PBE方法27,28。电子-离子间相互作用选择超软赝势来描述29,Kohn-Sham单电子态用平面波基组展开30–33,截断能为400 eV。Brillouin区采用Monkhorst-Pack方法点取样34,取样密度为2 × 2 × 1。对中间体结构的优化采用BFGS法,其中能量、原子间相互力和原子最大位移的收敛标准分别是2 × 10−5eV,0.5 eV·nm−1和2 × 10−4nm。所有计算均允许自旋极化。利用该计算参数和收敛标准计算的MgO晶格常数=== 0.431 nm,与实验值0.424 nm基本一致35。采用完全线性同步和二次同步变换Complete LST/QST方法进行了过渡态搜索36。定义吸附能ads=(IM/surface) –(IM) –(surface),其中(IM/surface)为中间体吸附在催化剂模型上时的总能,(IM)为自由态中间体的总能,(surface)为催化剂模型的总能。因此ads为负值时表示其吸附过程是放热的,该值越小中间体在催化剂表面吸附越稳定。
对于Ni/MgO采用了之前研究中使用的Ni8/MgO(100)模型,其中载体为3 × 3的三层MgO(100)构型,一个周期性结构中包含27个Mg原子与27个O原子,超胞真空层厚度为2 nm37。出于对称性的考虑,分别构建了表层中心的1个Mg原子被Ni取代的Ni1Mg26O27(100)载体模型,以及半数Mg原子被Ni取代的Ni13Mg14O27(100)和Ni14Mg13O27(100)载体模型。这些NiO-MgO固溶体模型仅固定了载体底层的原子,上两层原子可以自由移动。Sao-Joao等38将Ni原子沉积在MgO(100)平板上,高分辨透射电镜(HRTEM)的结果表明Ni颗粒主要暴露的是(100)面,因此本研究采用了顶视图与Ni(100)面相似的对称性为4d的Ni8簇来模拟Ni/MgO催化剂中的Ni颗粒。将Ni8簇放置在NiO-MgO固溶体模型表层的中央进行弛豫,即得到具有不同Ni : Mg比载体的Ni8/NiMgO27(100)模型(+= 27)。
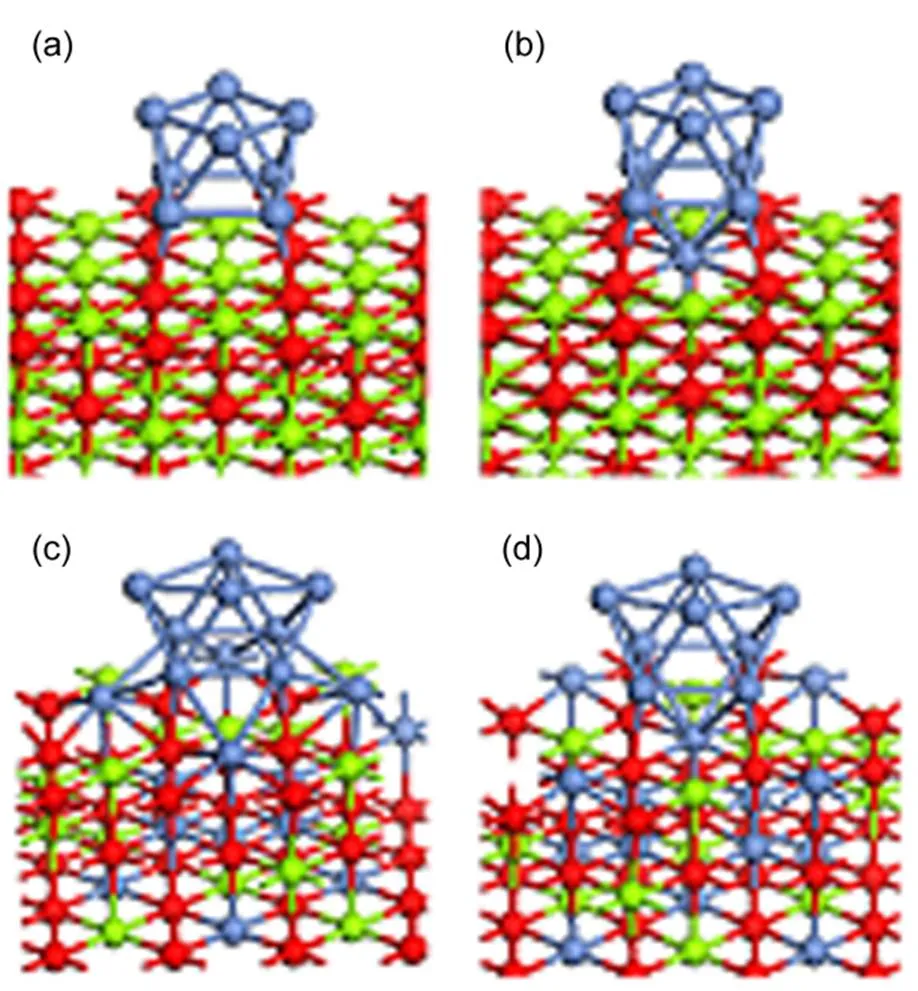
图1 Ni8/NixMgyO27(100)模型(x + y = 27)
(a) Ni8/MgO(100) (Cat-0); (b) Ni8/Ni1Mg26O27(100) (Cat-1); (c) Ni8/Ni13Mg14O27(100) (Cat-13); (d) Ni8/Ni14Mg13O27(100) (Cat-14).
3 结果与讨论
3.1 Ni8/NixMgyO27(100)模型
经过结构优化后得到的Ni8/NiMgO27(100) 催化剂模型的几何结构如图1所示。根据载体含有Ni原子的数目的不同,将Ni8/MgO(100)、Ni8/Ni1Mg26O27(100)、Ni8/Ni13Mg14O27(100)、Ni8/Ni14Mg13O27(100)依次命名为Cat-0、Cat-1、Cat-13、Cat-14。对于Cat-0和Cat-1,结构优化后的Ni8簇依然分为两层,每层包含4个以正方形排布的Ni原子。而在50% Ni掺杂的Cat-13和Cat-14上,结构优化后底层的四个Ni原子依然在一个平面呈正方形排布,而表层的4个Ni原子会由正方形变成菱形。由此可见载体中Ni的掺杂会改变吸附在NiO-MgO固溶体上的Ni金属簇的几何结构。
为了进一步探究载体掺杂Ni对催化剂结构的影响,对四种模型进行了Hirshfeld电荷分析。结果显示,Cat-0、Cat-1、Cat-13和Cat-14中Ni8簇所带的净电荷分别为−0.26、−0.08、0.08和0.15。随着载体Ni含量的上升,电子转移的方向由纯MgO载体时的“载体 → 金属”变为50% Ni掺杂时的“金属 → 载体”。周建略等39将Rh基催化剂的金属载体相互作用分为两类,当载体为可还原性氧化物时(如TiO2),Rh与金属阳离子成键,此时电子由Rh向载体转移;当载体为非还原性氧化物时(如MgO),Rh与O2−成键,此时电子由载体向Rh转移。在Ni/MgO体系中,当载体为纯MgO时,Ni8簇底层的Ni原子只与相邻的O原子成键,此时电子由载体转移到金属;当载体中Ni含量为50%时,Ni8簇底层的Ni原子除了与载体的O原子成键外、与相邻的载体表层的Ni原子之间也会成键,此时电子将由金属向载体表面转移。
3.2 CH4裂解
通常情况下,CH4/CO2重整反应可以分为三个阶段:1) CH4分步裂解产生CH和H;2) CO2解离产生CO和O;3) CH被O氧化产生CHxO,CHO随后脱氢产生CO和H。在我们的研究中,CHOH路径 (即CO2加氢解离产生CO和OH、CH被OH氧化生成CHOH随后裂解生成CO和H)与CHO路径相比在热力学和动力学上均不占优,因此在本文中不予讨论。表S1为不同的Ni8/NiMgO27(100)上CH4/CO2重整过程涉及的中间体的吸附能,相关的基元反应的反应能垒和反应能列于表S2 (表S1、S2见Supporting Information)。
图S1 (见Supporting Information)为Ni8/NiMgO27(100)上CH4裂解过程中间体和过渡态的几何构型。有文献研究认为CH4的解离吸附是CH4/CO2重整过程的控速步骤40,41。由表S2所示,无论在何种Ni8/NiMgO27(100)上,CH4的解离均为其分步裂解过程中能垒最高的基元反应。随着载体中Ni含量的上升,CH4解离吸附过程的反应能垒由2.24 eV上升为2.87 eV,催化剂的活性会受到抑制。
在Cat-0和Cat-1上CH3与CH2均吸附在Ni簇表层的桥位上,CH3的解离过程只涉及C―H键的断裂,反应能垒分别为1.54和1.33 eV;而在Cat-13和Cat-14上CH3吸附在5配位的Ni原子的顶位,CH2吸附在两个5配位Ni原子形成的Ni―Ni桥位上,CH3的解离过程同时包含了C―H的断裂以及C―Ni键的再构,此时反应能垒分别为2.68和2.63 eV,明显高于Cat-0和Cat-1上CH3的解离。CH2在四个模型上的解离过程均包括C由Ni―Ni桥位向谷位的转移,因此反应能垒的差别相对较小(1.58–2.21 eV)。
在CH4/CO2重整反应中,CH的裂解产生的热解C是积碳的前驱体,所以该过程直接影响催化剂的抗积碳性能。计算结果表明,CH的裂解在四种模型上均为吸热反应,该过程正反应的能垒是高于逆反应能垒的,这可以在一定程度上抑制热解C的生成。随着载体中Ni含量的增加,CH裂解的反应能垒由1.13 eV升高到2.21 eV,与CH4解离吸附过程的趋势类似。
综上,Ni8/NiMgO27(100)上CH4裂解过程的反应路径如图2所示。CH4解离吸附作为CH4分步裂解的控速步骤,其反应能垒随着载体中Ni含量的上升逐渐增加,因此Ni-Mg固溶体结构的出现会降低Ni/MgO催化剂的活性。对于直接决定积碳生成的CH → C + H过程,Cat-0、Cat-1、Cat-13和Cat-14上其正反应的能垒依次为1.13、1.68、1.99和2.21 eV,逆反应的能垒依次为0.24、0.81、1.39和1.37 eV,二者的比值B(f)/B(b)依次为4.71、2.07、1.43和1.61,这表明CH4分步裂解产生的CH在载体Ni含量较高时更容易脱氢生成热解C。

图2 CH4在Ni8/NixMgyO27(100)上分步裂解的势能
3.3 CO2的吸附和解离
图S2 (见Supporting Information)为Ni8/NiMgO27(100)上CO2吸附和解离过程中间体和过渡态的几何构型。当CO2以线式垂直于催化剂模型表面时吸附能均高于−0.10 eV,且距离Ni簇较远,为物理吸附;当CO2中的一个C=O平行于表层的Ni―Ni桥键时,线型CO2分子发生了扭曲,此时吸附能为−0.19 – −0.57 eV,为化学吸附。随着载体Ni含量的增加,CO2的在Ni簇上化学吸附的吸附能逐渐降低,可知载体碱性的减弱不利于CO2的吸附。CO2的化学吸附的过程不是自发进行的,其反应能垒介于0.09–0.65 eV之间,动力学阻碍不大。CO2在Ni簇上解离的反应能垒为1.15–1.75 eV,是CO2吸附解离过程的控速步骤。
图3为在Ni8/NiMgO27(100)上CO2吸附解离过程的反应路径。CO2解离的反应能垒明显低于CH4的裂解,而且生成的O在Ni簇上吸附能为−2.75 – −3.39 eV,吸附能较大。这表明在Ni8/NiMgO27(100)上O物种比起CH物种更容易生成,而且其吸附构型比较稳定,所以CH4/CO2重整过程中O物种的数量不会成为反应的瓶颈。
3.4 CHx的氧化与CHxO的脱氢
CH物种能否顺利的被O物种氧化是CH4/CO2重整反应顺利进行的关键,Ni8/NiMgO27(100)上CH的氧化与CHO的脱氢过程的中间体和过渡态的几何构型如图S3(见Supporting Information)所示。计算结果表明,在Cat-0和Cat-1上最易被氧化的CH物种为CH2,反应能垒分别为2.40和2.20 eV;在Cat-13和Cat-14上最易被氧化的CH物种为CH,反应能垒分别为2.48和2.58 eV。无论在何种表面,CH的氧化的反应能垒均高于CHO的脱氢,是该阶段的控速步骤。
图4为在Ni8/NiMgO27(100)上CH氧化与CHO脱氢过程的反应路径,其中图4(a)为在Cat-0和Cat-1上的CH2氧化及CH2O脱氢机理,图4(b)为在Cat-13和Cat-14上的CH氧化CHO脱氢机理。通过对比可知,一方面Cat-0和Cat-1上CH2与O形成共吸附的CH2+ O为放热反应,Cat-13和Cat-14上CH与O形成CH + O的过程基本没有吸放热,前者在热力学上更容易进行;另一方面Cat-0和Cat-1上CH2氧化过程的反应能垒也低于Cat-13和Cat-14上CH的氧化过程。这表明随着载体Ni含量的增加,CH的氧化过程更难进行。
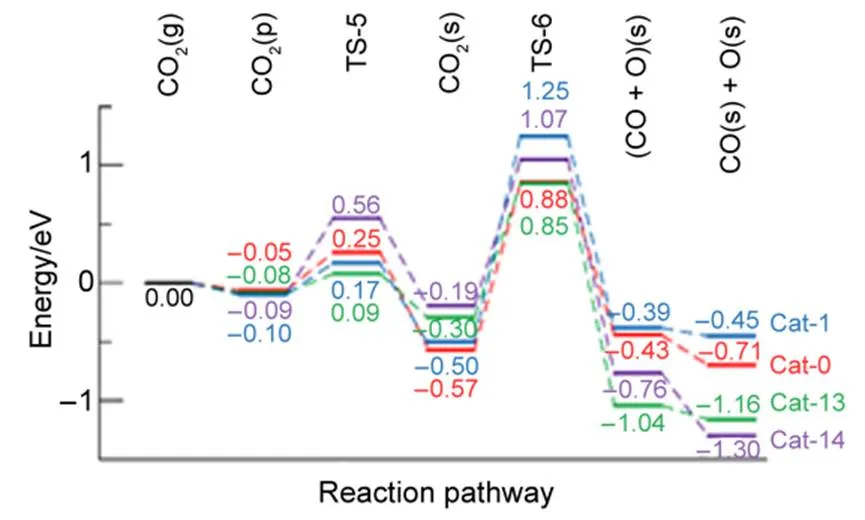
图3 CO2在Ni8/NixMgyO27(100)上吸附解离的势能

图4 CHxO在Ni8/NixMgyO27(100)上生成与解离的势能
(a) CH2O formation and dehydrogenation on Cat-0 and Cat-1; (b) CHO formation and dehydrogenation on Cat-13 and Cat-14.
另一方面,催化剂的抗积碳性能主要取决于积碳反应与消碳反应之间的匹配,若消碳反应速率大于积碳生成速率则催化剂上将不会有净积碳的产生。对于Cat-0、Cat-1、Cat-13和Cat-14,其相应的B(CH4→ CH3+ H)/B(CH+ O → CHO)比值依次为0.93、1.06、1.09和1.11。虽然CH4的裂解和 CH氧化的能垒均随着催化剂载体Ni含量的上升而提高,但前者上升的幅度相对更高,这表明载体高Ni含量的Cat-13和Cat-14在牺牲了催化活性的同时其抗积碳性能会有一定的提高。
3.5 重整反应关键步骤的电荷分配
由上述计算的结果可知,在Ni8/NiMgO27(100)上,CH4/CO2重整反应的活性、积碳产生以及积碳消除分别与CH4的解离吸附、CH的裂解和CH的氧化密切相关,因此这三个基元反应可以看作重整反应的关键步骤。为了进一步阐明催化剂的电子结构对重整反应关键步骤的影响,对上述三个反应的反应物和过渡态进行了Hirshfeld电荷分析,结果如表1所示。
由表1可知,对于CH4的解离吸附过程需要电子从催化剂向CH4分子转移。该过程无论在何种Ni8/NiMgO27(100)表面,CH4的过渡态结构得到的电子均由Ni8簇表层的Ni原子提供。CH的裂解同样需要从催化剂上得到电子,在载体Ni含量较低的Cat-0和Cat-1上,这些电子主要来源于Ni簇;而在高掺杂量的Cat-13和Cat-14上,CH的活化过程中Ni簇的电子结构基本没有发生变化,所需的电子是由NiO-MgO载体表层的Ni原子提供的。由于在不同Ni8/NiMgO27(100)上参与氧化的CH物种不同,因此CH氧化过程的电子转移状况也有所不同:在Cat-0和Cat-1上,参与氧化的CH物种为CH2,在其氧化时CH2失去的电子会转移到O和Ni簇上;而Cat-13和Cat-14上CH氧化时失去的电子会全部转移到Ni簇以及载体表面的Ni原子上。
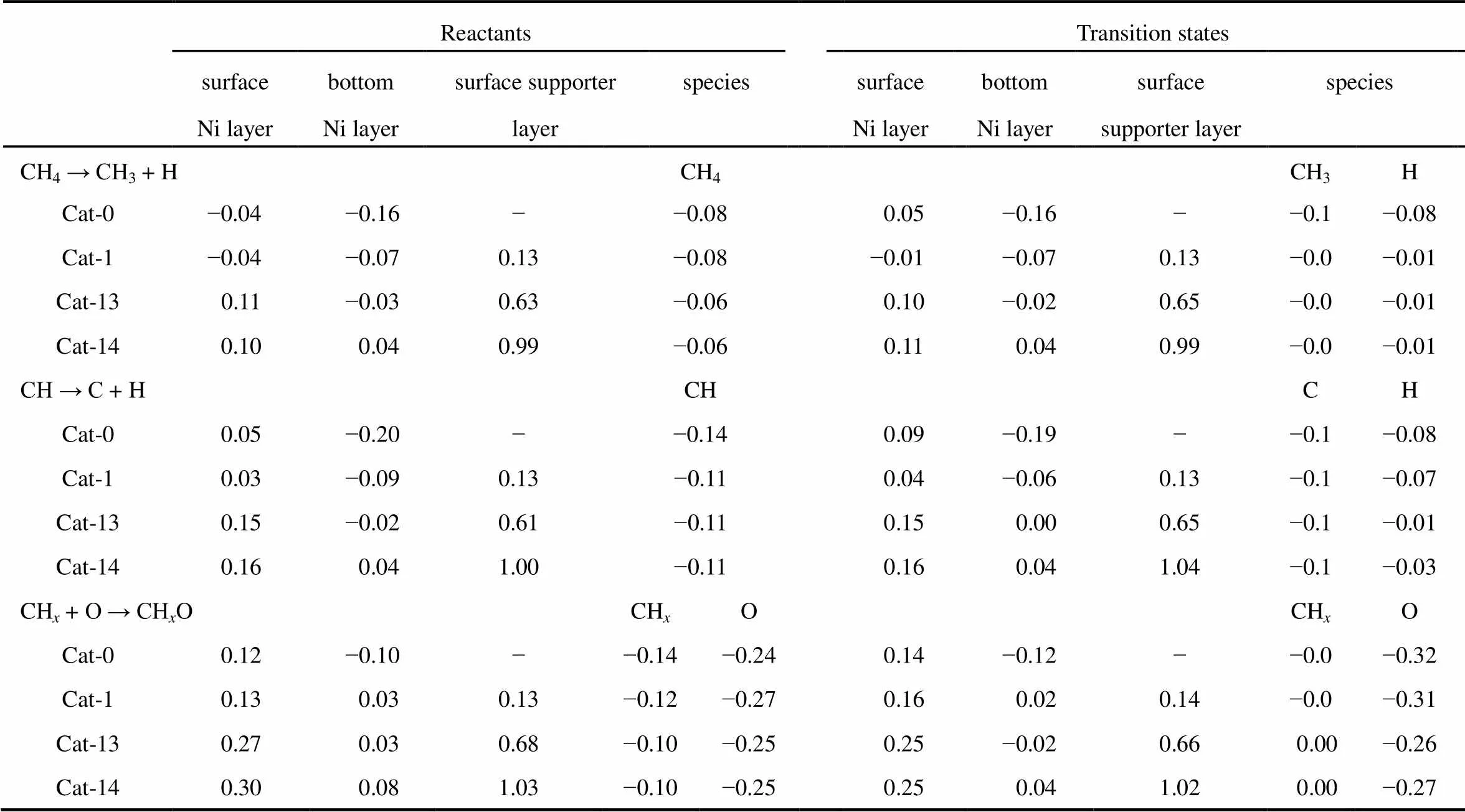
表1 Ni8/NixMgyO27(100)上CH4裂解、CH裂解和CHx氧化过程反应物和过渡态的Hirshfeld电荷结构(e)
因此,在Ni/MgO体系中,载体低Ni含量(Cat-0和Cat-1)和高Ni含量(Cat-13和Cat-14)时CH4的解离吸附、CH的裂解和CH的氧化这三个过程中电子的转移情况有所不同:当载体Ni含量很低时,载体具有较强的供电子能力,Ni簇是富电子的,那么当反应物在其表面活化时Ni簇本身就可以提供足够多的电子,因此电子流动的总体趋势是载体 → 金属 → 反应物;而当载体Ni含量较大时,由于Ni簇与载体中的Ni2+成键,此时电子由金属簇流向载体,Ni簇处于缺电子状态,当反应物活化时若需要较多的电子则只能从载体表面的Ni上获得。
4 结 论
采用密度泛函理论DFT/PBE计算方法,获得了载体Ni含量不同的Ni8/NiMgO27(100)上的CH4/CO2重整反应机理。结果表明,随着载体Ni含量的上升,电子转移的方向会由纯MgO时的载体向Ni金属转移变为Ni金属向载体转移。如果Ni簇缺电子,反应物需要得电子活化时就必须从载体中转移电子,反应难度随之增加。总体来说,NiO-MgO固溶体中Ni的存在对Ni/MgO催化剂的活性和稳定性是不利的。在实际制备催化剂时,采取低Ni负载量和相对温和的焙烧条件有助于降低还原后催化剂载体的Ni含量,可以在Ni颗粒尺寸相同的情况下获得更好地催化性能。
Supporting Information:Geometries of adsorption configurations and transition structures, adsorption energies of species, and the energy barriers and reaction energy of most favored elementary steps in CH4/CO2reforming on Ni8/NiMgO27have been included. This information is available free of chargethe internet at http://www. whxb.pku.edu.cn.
(1) Ashcroft, A. T.; Cheetham, A. K.; Green, M. L. H.; Vernon, P. D. F.1991,, 225. doi: 10.1038/352225a0
(2) Chen, J. X.; Wang, R. J.; Zhang, J. Y.; He, F.; Han, S.2005,, 302. doi: 10.1016/j.molcata.2005.04.023
(3) Inui, T.; Spivey, J. J., Reforming of CH4by CO2, O2, and/or H2O In, Spivey, J. J. Ed.; The Royal Society of Chemistry: Cambridge, 2002; pp 133−154.
(4) Kim, G. J.; Cho, D. S.; Kim, K. H.; Kim, J. H.1994,, 41. doi: 10.1007/BF00812468
(5) Hu, Y. H.; Ruckenstein, E.1997,, 71. doi: 10.1023/A:1018982304573
(6) Song, C.; Pan, W.2004,, 463. doi: 10.1016/j.cattod.2004.09.054
(7) Tomishige, K.; Himeno, Y.; Matsuo, Y.; Yoshinaga, Y.; Fujimoto, K.2000,, 1891. doi: 10.1021/ie990884z
(8) Özdemir, H.; Faruk Öksüzömer, M. A.; Ali Gürkaynak, M.2010,, 12147. doi: 10.1016/j.ijhydene.2010.08.091
(9) Ruckenstein, E.; Hu, Y. H.1996,, 230. doi: 10.1006/jcat.1996.0280
(10) Wang, S. B.; Lu, G. Q. M.2000,, 589. doi: 10.1002/1097-4660(200007)75:7< 589::AID-JCTB241>3.0.CO;2-7
(11) Guo, F.; Chu, W.; Huang, L. Q.; Xie, Z. K.2008,, 495. [郭 芳, 储 伟, 黄丽琼, 谢在库. 合成化学,2008,, 495.] doi: 10.3969/j.issn.1005-1511.2008.05.001
(12) Hu, Y. H.; Ruckenstein, E.1996,, 145. doi: 10.1007/bf00807611
(13) Hu, Y. H.; Ruckenstein, E.1999,, 298. doi: 10.1006/jcat.1999.2449
(14) Hu, Y. H.; Ruckenstein, E.2002,, 423. doi: 10.1081/CR-120005742
(15) Guo, J. J.; Lou, H.; Zhao, H.; Chai, D. F.; Zheng, X. M.2004,, 75. doi: 10.1016/j.apcata.2004.06.014
(16) García, V.; Fernández, J. J.; Ruíz, W.; Mondragón, F.; Moreno, A.2009,, 240. doi: 10.1016/j.catcom.2009.10.003
(17) Naeem, M. A.; Al-Fatesh, A. S.; Abasaeed, A. E.; Fakeeha, A. H.2014,, 141. doi: 10.1016/j.fuproc.2014.01.035
(18) Wang, S. B.; Lu, G. Q. M.1998,, 269. doi: 10.1016/S0926-3373(97)00083-0
(19) Wei, H. S.; Liu, X. Y.; Wang, A. Q.; Zhang, L. L.; Qiao, B. T.; Yang, X. F.; Huang, Y. Q.; Miao, S.; Liu, J. Y.; Zhang, T.2014,, 1. doi: 10.1038/ncomms6634
(20) Yang, X. F.; Wang, A. Q.; Qiao, B. T.; Li, J.; Liu, J. Y.; Zhang, T.2013,, 1740. doi: 10.1021/ar300361m
(21) Valden, M.; Lai, X.; Goodman, D. W.1998,, 1647. doi: 10.1126/science.281.5383.1647
(22) Cargnello, M.; Doan-Nguyen, V. V. T.; Gordon, T. R.; Diaz, R. E.; Stach, E. A.; Gorte, R. J.; Fornasiero, P.; Murray, C. B.2013,, 771. doi: 10.1126/science.1240148
(23) Shi, K. Y.; Xu, H. Y.; Zhang, G. L.; Wang, Y. Z.; Lin, X. G.; Wei, Y. D.2002,, 15. [史克英, 徐恒泳, 张桂玲, 王玉忠, 徐国林, 韦永德. 催化学报,2002,, 15.] doi: 10.3321/j.issn:0253-9837.2002.01.004
(24) Guo, Y. P.; Feng, J.; Li, W. Y.2017, doi: 10.1016/j.cjche.2017.03.024
(25) Milman, V.; Winkler, B.; White, J. A.; Pickard, C. J.; Payne, M. C.; Akhmatskaya, E. V.; Nobes, R. H.2000,, 895. doi: 10.1002/(SICI)1097-461X(2000) 77:5<895::AID-QUA10>3.0.CO;2-C
(26) Payne, M. C.; Teter, M. P.; Allan, D. C.; Arias, T. A.; Joannopoulos, J. D.1992,, 1045. doi: 10.1103/RevModPhys.64.1045
(27) Perdew, J. P.; Chevary, J. A.; Vosko, S. H.; Jackson, K. A.; Pederson, M. R.; Singh, D. J.; Fiolhais, C.1992,, 6671. doi: 10.1103/PhysRevB.46.6671
(28) Perdew, J. P.; Zunger, A.1981,, 5048. doi: 10.1103/PhysRevB.23.5048
(29) Vanderbilt, D.1990,, 7892. doi: doi.org/10.1103/PhysRevB.41.7892
(30) Kresse, G.; Furthmüller, J.1996,, 15. doi: 10.1016/0927-0256(96)00008-0
(31) Kresse, G.; Furthmüller, J.1996,, 11169. doi: 10.1103/PhysRevB.54.11169
(32) Kresse, G.; Hafner, J.1993,, 558. doi: 10.1103/PhysRevB.47.558
(33) Kresse, G.; Hafner, J.1994,, 14251. doi: 10.1103/PhysRevB.49.14251
(34) Monkhorst, H. J.; Pack, J. D.1976,, 5188. doi: 10.1103/PhysRevB.13.5188
(35) Speziale, S.; Zha, C. S.; Duffy, T. S.; Hemley, R. J.; Mao, H. K.2001,, 515. doi: 10.1029/2000JB900318
(36) Halgrena, T. A.; Lipscomb, W. N.1977,, 225. doi: 10.1016/0009-2614(77)80574-5
(37) Guo, Y. P.; Li, W. Y.; Feng,2017,, 22. doi: 10.1016/j.susc.2017.02.010
(38) Sao-Joao, S.; Giorgio, S.; Mottet, C.; Goniakowski, J.; Henry, C. R.2006,, L86. doi: 10.1016/j.susc.2006.01.045
(39) Zhou, J. L.; Xin, M.; Chen, Y.1993,(6), 411. [周建略, 辛 梅, 陈 豫. 分子催化,1993,(6), 411.]
(40) Bradford, M. C. J.; Vannice, M. A.1996,, 97. doi: 10.1016/0926-860X(96)00066-X
(41) Wei, J. M.; Iglesia, E.2004,, 370. doi: 10.1016/j.jcat.2004.02.03
Effect of Ni Doping on Electron Transfer in Ni/MgO Catalysts
GUO Yun-Peng FENG Jie LI Wen-Ying*
()
First-principles calculations based on density functional theory (DFT) have been used to investigate how Ni doping in the supporter impacts CH4/CO2reforming over Ni/MgO catalysts. Ni8 clusters supported on different NiMgO27(100) slabs (+= 27) have been selected to model Ni/MgO catalysts with different Ni : Mg ratio. The CH4/CO2reforming mechanisms on different Ni8/NiMgO27(100) slabs indicate that the energy barriers of CH4dissociated adsorption and CHoxidation both increase with an increase in the Ni : Mg ratio of the supporter. CH would be easily generated from the pyrolytic carbon. The electron structure analysis shows that the direction of electron transfer changes to “between metal and supporter” with increasing Ni : Mg ratio of the supporter, but not to “from supporter to metal” on pure Ni/MgO. When the Ni cluster is negative, electron transfer occurs between adsorbed species and Ni atoms in the surface layer of the Ni cluster, and CH2is the main species for CHoxidation. When the Ni cluster is positive, its Hirshfeld is stable, electron transfer occurs between adsorbed species and Ni atoms in the surface layer of the NiO-MgO solid solution, and CH is the main oxidative species. The electron deficiency of the Ni cluster is the reason for the poor catalytic performance of Ni/MgO with a high Ni doping ratio.
CH4/CO2reforming; Ni/MgO; Ni : Mg ratio; Electron transfer; DFT
April 3, 2017;
April 20, 2017;
May 8, 2017.
. Email: ying@tyut.edu.cn; Tel: +86-351-6018453.
10.3866/PKU.WHXB201705081
O641
The project was supported by the National Natural Science Foundation of China (U1361202) and the National Key Research and Development Program of China.
国家自然科学基金重点支持项目(U1361202)和国家重点研发计划重点专项(2016YFB0600305)资助
