乳管镜定位下行乳腺导管内乳头状瘤切除术
2017-12-21章骏梁哲通张舟
章骏 梁哲通 张舟
(上海市杨浦区市东医院乳腺外科,上海 200433)
乳管镜定位下行乳腺导管内乳头状瘤切除术
章骏 梁哲通 张舟
(上海市杨浦区市东医院乳腺外科,上海 200433)
目的:分析乳管镜定位下行乳腺导管内乳头状瘤切除术的效果,总结应用体会。方法:150例以乳头溢液为主要临床表现且符合乳腺导管内乳头状瘤诊断标准患者分为观察组、对照组,各75例,分别给予乳管镜定位下乳腺导管内乳头状瘤切除术、常规乳头状瘤病变区段切除术,比较两组患者手术情况、治疗费用、病理检出率、术后并发症发生情况及随访结果。结果:观察组手术时间高于对照组,其切口长度、标本直径及标本重量均低于对照组,差异有统计学意义(P<0.05)。两组患者住院费用、药物费用比较,差异无统计学意义(P>0.05)。观察组病理检出阳性率为74.44%(67/90),高于对照组的57.14%(40/70),差异有统计学意义(P<0.05)。两组患者均获得有效随访,平均随访时间(8.40±2.71)个月,观察组随访期间未见乳头凹陷、乳头溢液发生,对照组随访期间发生乳头凹陷2例(2.86%);两组患者术后切口均Ⅰ期愈合,未见肿瘤复发。结论:乳腺导管定位下行乳腺导管内乳头状瘤切除术能够保证病变定位的准确性、降低病变乳管的暴露和切除难度,且拥有病理检出率高、创伤小等优势。
乳管镜;乳腺导管内乳头状瘤切除术;乳腺外科微创手术;病理检出率
乳头状瘤好发于Ⅰ~Ⅲ级大乳管,是乳头溢液最常见的病因之一[1]。由于乳头溢液对乳管内病变观察的影响,脱落细胞学检查、乳腺导管造影、MRI、钼靶和B超等手段均无法获得较为准确的诊断结果,多数患者需接受病变区段切除手术,但手术所致乳房变形、缩小以及明显瘢痕对患者生理及心理均造成了巨大影响[2]。自20世纪80年代末乳管镜首次应用于临床以来,随着乳管镜技术的迅速发展,乳管内病变的诊断准确率及治疗手段均得到了大幅提高[3]。现将乳管镜应用于乳头状瘤切除术治疗过程与结果进行分享。
1 资料与方法
1.1 一般资料
150例以乳头溢液为主要临床表现且符合乳腺导管内乳头状瘤诊断标准[4]患者,排除多孔溢液者、溢液侧合并乳房肿块者、合并凝血功能异常者,以及病变侧有乳房手术史者。征得我院医学伦理委员会批准,患者知情同意后使用随机数表法将患者分为观察组、对照组,各75例,观察组Ⅰ级42例、Ⅱ级23例、 Ⅲ级5例,对照组Ⅰ级40例、Ⅱ级28例、Ⅲ级2例,两组患者年龄、病程、病变导管分级等一般临床资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2 治疗方案
对照组患者接受常规乳头状瘤病变区段切除术,即向溢液孔内注射美兰、龙胆紫等染料,根据乳房组织染色情况选择切除区段[5]。观察组使用FVY-780纤维乳管镜(北京博莱德光电技术开发有限公司)及配套扩张针,由细至粗(0.5 mm~0.8 mm)缓慢扩张溢液乳管至合适直径;向扩张完毕的乳管内注入4 mL 2%利多卡因+100 mL生理盐水冲洗液,维持乳管扩张状态;使用乳管镜寻找乳管内病灶,沿乳管病变走行纵向切开皮肤及皮下组织,将皮瓣向四周分离,于乳管镜定位下行乳管分离,先沿乳头方向将乳管分离至乳头下,而后向腺体方向分离乳管,使用电刀沿导管方向仔细、谨慎分离占位病灶并完整切除,送病理检查[6-7]。病理检出率以病理标本阳性(明确乳头瘤状诊断)计算[8],采用电话随访及门诊随诊形式,对患者进行不低于6个月的随访。末次随访时记录两组患者术后并发症发生情况、乳头溢液及乳头状瘤复发情况,并观察其切口外观、瘢痕变化。
1.3 统计学分析
对本临床研究的所有数据采用SPSS16.0进行分析,病理检出率、并发症发生率等计数资料以(n/%)表示,并采用χ2检验,手术情况、治疗费用等计量资料以()表示,并采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 手术指标及费用
观察组手术时间高于对照组,其切口长度、标本直径及标本重量均低于对照组,差异有统计学意义(P<0.05)。两组患者住院费用、药物费用比较,差异无统计学意义(P>0.05)。见表1。
表1 两组患者手术指标比较()
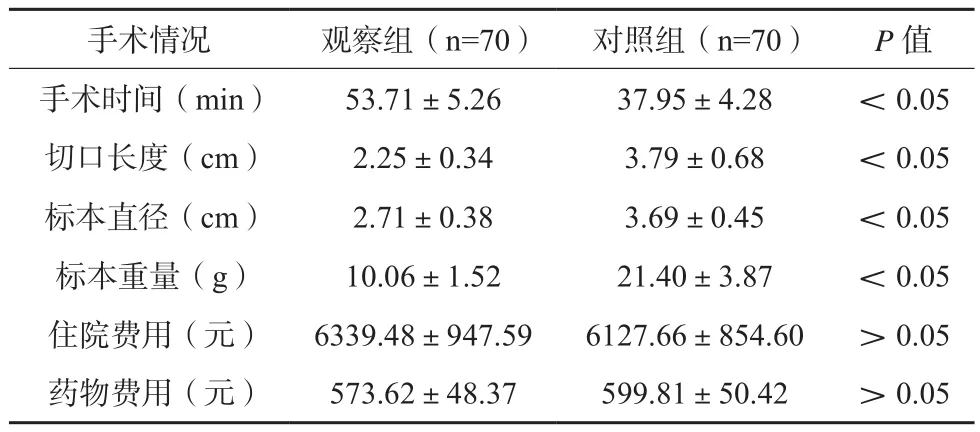
表1 两组患者手术指标比较()
注:与术前比较,*P<0.05;与观察组比较,#P<0.05
手术情况 观察组(n=70) 对照组(n=70) P值手术时间(min) 53.71±5.26 37.95±4.28 <0.05切口长度(cm) 2.25±0.34 3.79±0.68 <0.05标本直径(cm) 2.71±0.38 3.69±0.45 <0.05标本重量(g) 10.06±1.52 21.40±3.87 <0.05住院费用(元) 6339.48±947.59 6127.66±854.60 >0.05药物费用(元) 573.62±48.37 599.81±50.42 >0.05
2.2 病理检出率与并发症
观察组病理检出阳性率为74.44%(67/90),高于对照组的57.14%(40/70),差异有统计学意义(P<0.05)。
患者均获得有效随访,平均随访时间(8.40±2.71)个月,观察组随访期间未见乳头凹陷、乳头溢液发生,对照组随访期间发生乳头凹陷2例(2.86%);两组患者术后切口均Ⅰ期愈合,未见肿瘤复发。
3 讨论
根据病灶数量,乳头状瘤可分为单发性、多发性两种类型,前者主要发生于大乳管近乳头壶腹部,恶变潜能较低,后者病灶集中于中、小乳管,且有着较高的恶变风险[9-10]。当前临床治疗乳头状瘤的方法以手术为主,常用术式包括乳管镜定位及引导下肿瘤切除术,以及常规部分腺体切除术。
1988年,法国学者首次报道使用硬性乳管镜直接观察乳管内病变的情况,为乳腺导管的内窥镜检查开辟了新的思路[11]。此后,大量学者就乳管镜的技术革新及适用范围进行了研究,截止当前,纤维乳管镜在乳腺疾病的早诊断、早治疗、准确定位等环节发挥的重要作用已得到广泛认可[12]。本研究就乳管镜定位下乳腺导管内乳头状瘤切除术与常规术式的效果及安全性进行比较的结果表明,乳管镜的应用使切口长度明显缩短、标本直径大幅减少、标本重量显著下降,体现出乳管镜在微创方面的巨大优势。更短的切口长度意味着更小的皮肤损伤,患者术区局部美观度恢复往往更为理想。常规术式标本直径及重量较大的原因与术中染色的所有乳管及其周围乳房腺体均需切除有关[13]。此次研究对照组随访期间发生2例乳头凹陷,是由于常规术式乳腺组织切除较多,患者术后极易出现乳头下陷或乳房变形,除美观度、心理状态受到一定影响外,未哺乳患者的哺乳能力也可能受到明显限制[14]。相比之下,乳管镜的定位引导作用能够在降低乳腺组织切除量的基础上,保证病变组织的准确切除,从而提高手术的目的性及针对性,确保治疗效果与安全性[15]。
部分乳腺导管内乳头状瘤仍存在一定恶变可能,故保证术后病理检查的准确率、明确病灶癌变状态,对于指导术后综合治疗也有着积极意义,本研究观察组病理标本阳性检出率高达74.44%,高出对照组约17%,意味着这一术式能够更早地向临床提供恶性疾病的信息,为乳腺癌或癌前病变的早期诊断与干预提供参考[16]。
需要注意的是,乳管镜定位下乳腺导管内乳头状瘤切除术也存在一定弊端,如本研究结果示,观察组手术时间较长,与术中器械调试耗时有关,此外,对于病灶较深、导管较细所致乳管镜插入困难者而言,盲目选用乳管镜不仅会增加操作难度,还会增加乳管镜损伤甚至组织损伤风险,影响手术安全性[17]。另外,乳管镜的适应证范围较常规术式更为狭窄,为避免多个病变乳管相互影响或乳管内前一病变对后续乳管造成的影响[18],我们将多孔溢液者、溢液侧合并乳房肿块者均予以排除,也使得部分患者的微创治疗诉求无法得到满足。
综上所述,乳管镜定位下行乳腺导管内乳头状瘤切除术不仅具有微创、美观度佳的优势,其治疗效果与安全性亦优于常规部分腺体切除术,但该术式也存在手术时间较长、适应范围有限等弊端,在临床推广及实践过程中予以进一步优化。
[1] KAMALI S, BENDER O, KAMALI G H, et al. Diagnostic and therapeutic value of ductoscopy in nipple discharge and intraductal proliferations compared with standard methods[J].Breast Cancer, 2014, 21(2): 154-161.
[2] VALDES E K, BOOLBOL S K, COHEN J M, et al. Clinical experience with mammary ductoscopy[J]. Ann Surg Oncol,2016, 23(5): 9015-9019.
[3] 聂明辉. 乳腺导管内乳头状瘤100例诊治分析[J]. 中国实用外科杂志, 2015, 35(3): 326-326.
[4] LIU M, GUO G, XIE F, et al. Mammary ductoscopy and followup avoid unnecessary duct excision in patients with pathologic nipple discharge[J]. J Surg Oncol, 2015, 112(2): 139-143.
[5] DOOLEY W C. Biopsy Techniques in Non-palpable or Palpable Breast Lesions[M]//Breast Disease. Springer International Publishing, 2016: 3-11.
[6] ZIELINSKI J, JAWORSKI R, IRGA-JAWORSKA N, et al. The significance of ductoscopy of mammary ducts in the diagnostics of breast neoplasms[J]. Wideochir Inne Tech Maloinwazyjne,2015, 10(1): 79.
[7] YANG X, LI H, GOU J, et al. The role of breast ductoscopy in evaluation of nipple discharge: a Chinese experience of 419 patients[J]. Breast J, 2014, 20(4): 388-393.
[8] 黄建棋. 乳腺导管内乳头状瘤高危型人乳头瘤病毒DNA检测的临床研究[D]. 山东大学, 2010.
[9] LIAN Z Q, WANG Q, ZHANG A Q, et al. A nomogram based on mammary ductoscopic indicators for evaluating the risk of breast cancer in intraductal neoplasms with nipple discharge[J].Breast Cancer Res Treat, 2015, 150(2): 373-380.
[10] WAAIJER L, VAN DIEST P J, VERKOOIJEN H M, et al.Interventional ductoscopy in patients with pathological nipple discharge[J]. Br J Surg, 2015, 102(13): 1639-1648.
[11] HAN Y, LI J, HAN S, et al. Diagnostic value of endoscopic appearance during ductoscopy in patients with pathological nipple discharge[J]. BMC Cancer, 2017, 17(1): 300.
[12] KOTHARI A, BEECHEY-NEWMAN N, KULKARNI D.
Breast duct micro-endoscopy: a study of technique and a morphological classification of endo-luminal lesions.[J]. Breast,2006, 15(3):363.
[13] WAAIJER L, SIMONS J M, BOREL RINKES I H M, et al. Systematic review and meta-analysis of the diagnostic accuracy of ductoscopy in patients with pathological nipple discharge[J]. Br J Surg, 2016, 103(6): 632-643.
[14] OHLINGER R, STOMPS A, PAEPKE S, et al. Ductoscopic detection of intraductal lesions in cases of pathologic nipple discharge in comparison with standard diagnostics: the German multicenter study[J]. Oncol Res Treat, 2014, 37(11): 628-632.
[15] EDWARD R. SAUTER M.D. PH.D. †, HORMOZ E M D,ANDRES J P K M D, et al. Fiberoptic ductoscopy findings in women with and without spontaneous nipple discharge[J].Cancer, 2010, 103(5):914-921.
[16] MAKITA M, AKIYAMA F, GOMI N, et al. Mammary ductoscopy and watchful follow-up substitute microdochectomy in patients with bloody nipple discharge[J]. Breast Cancer, 2016,23(2): 242-251.
[17] MA X P, WANG W, KONG Y, et al. A Novel Light-Emitting Wire Enhances the Marking and Visualization of Pathologic Mammary Ducts During Selective Microdochectomy[J]. Ann Surg Oncol, 2016, 23(3): 796-800.
[18] INGLE S B, MURDESHWAR H G, SIDDIQUI S. Papillary carcinoma of breast: Minireview[J]. World J Clin Cases, 2016,4(1): 20.
R655.8
A
2095-5200(2017)06-104-03
10.11876/mimt201706042
章骏,本科,副主任医师,研究方向:乳腺、甲状腺疾病外科治疗临床,Email:846416826@qq.com。
张舟,学士,主治医师,研究方向:乳腺、甲状腺专业。
