血清人附睾蛋白4与慢性肾脏病疾病严重程度之间关系
2017-12-21童天夫李美陈橙
童天夫 李美 陈橙
(东南大学附属中大医院江北院区/南京市大厂医院 检验科,南京 210044)
血清人附睾蛋白4与慢性肾脏病疾病严重程度之间关系
童天夫 李美 陈橙
(东南大学附属中大医院江北院区/南京市大厂医院 检验科,南京 210044)
目的:分析血清人附睾蛋白4(human epididymis protein 4,HE4)与慢性肾脏病(Chronic kidney disease,CKD)疾病严重程度之间关系,探讨HE4的临床参考价值。方法:192例患者符合入组标准的CKD患者为患者组,80名健康体检者为对照组。比较两组受试者血清HE4浓度,并比较不同分期CKD患者HE4、肌酐(SCr)、胱抑素C(CysC)、肾小球滤过率(eGFR)的差异,计算HE4与SCr、CysC、eGFR的相关性。结果:患者组血清HE4浓度为(82.39±24.27)pmol/L,高于对照组的(29.36±6.81)pmol/L,差异有统计学意义(P<0.05)。随着患者CKD分期的上升,其eGFR逐渐下降,HE4、SCr、CysC逐渐上升,各分期间相互比较,差异有统计学意义(P<0.05)。相关性分析示,血清HE4浓度与SCr(r=0.713)、CysC(r=0.659)均呈正相关,与eGFR(r=-0.705)呈负相关(P<0.05)。结论:随着CKD疾病严重程度的进展,患者血清HE4浓度逐渐上升,进一步明确肾功能受损不同阶段的HE4诊断界值,有望为CKD进展及预后预测提供新的血清生物学标记物。
人附睾蛋白4;慢性肾脏病;疾病严重程度;相关性
慢性肾脏病(Chronic kidney disease,CKD)是由原发性或继发性肾小球肾炎、肾血管病或肾小管损伤等多种原因引发的慢性肾脏结构和功能障碍,也是危害人类健康和生存质量的常见病[1]。全球范围内CKD发病率并未下降,随着病情的恶化,患者可逐渐进展至慢性肾功能不全、肾衰竭,危及生命[2]。因此,早期评估CKD患者疾病严重程度,可指导临床诊疗。然而,作为当前临床常用的肾小球滤过率(eGFR)估算指标,肌酐(SCr)水平易受饮食、性别、年龄等多种因素影响,无法准确反映早期肾功能损伤,临床评估价值受限[3]。本研究在总结过往文献经验的基础上,选取人附睾蛋白4(human epididymis protein 4,HE4),就其与CKD严重程度的关系进行了前瞻性分析。
1 资料与方法
1.1 一般资料
选取标准:1)参照美国肾脏病基金会K/DOQI指南[4]确诊;2)入组前无透析治疗史、多巴酚丁胺使用史;3)未合并卵巢癌、急性肾衰竭、肌肉萎缩者。2015年8月—2017年2月192例患者符合上述标准(患者组)。同期80名身体状态良好者为对照组。两组受试者年龄、性别等一般临床资料比较,差异无统计学意义(P>0.05),具有可比性。本研究已征得我院医学伦理委员会批准,受试者均自愿参与并签署知情同意书。
1.2 检测指标及分析
抽取受试者入组次日空腹肘静脉血5 mL,以3500 r/min离心5 min,分离血清样本,2-8℃保存待检。在罗氏e601电化学发光免疫分析仪上对受试者血清HE4进行检测,SCr、胱抑素C(CysC)检测分别在贝克曼AU5811全自动生化分析仪上使用苦味酸法、免疫比浊法[5-7];使用CKDEPI公式计算 eGFR[8]:eGFR=a×(SCr/b)c×(0.993)年龄,其中,a、b、c取值根据性别确定:男性:a=141,b=0.9;SCr≤ 80 μmol/L者,c=-0.411,SCr> 80 μmol/L者,c=-1.209。女性:a=144,b=0.7;SCr≤80 μmol/L者,c=-0.329,SCr> 80 μmol/L 者,c=-1.209。
CKD分期标准[9]:1期:eGFR≥90 mL/min/1.73 m2;2期:60 mL/min/1.73 m2≤eGFR<90 mL/min/1.73 m2;3期:30 mL/min/1.73 m2≤eGFR<60 mL/min/1.73 m2;4期:15 mL/min/1.73 m2≤eGFR<30 mL/min/1.73 m2;5期:eGFR<15 mL/min/1.73 m2。比较不同CKD分期患者血清HE4、SCr、CysC、eGFR差异,并计算HE4与SCr、CysC、eGFR的相关性。
1.3 统计学分析
对本临床研究的所有数据采用SPSS18.0进行分析,性别以(n)表示,并采用χ2检验,血清HE4、SCr、CysC、eGFR等计量资料以()表示,并采用t检验或F检验,以P<0.05为差异有统计学意义;相关性分析采用Pearson法。
2 结果
患者组血清HE4浓度为(82.39±24.27)pmol/L,高于对照组的(29.36±6.81)pmol/L,差异有统计学意义(P< 0.05)。
随着患者CKD分期的上升,其eGFR逐渐下降,HE4、SCr、CysC逐渐上升,各分期间相互比较,差异有统计学意义(P<0.05)。见表1。
表1 不同分期CKD患者血清指标及eGFR比较()
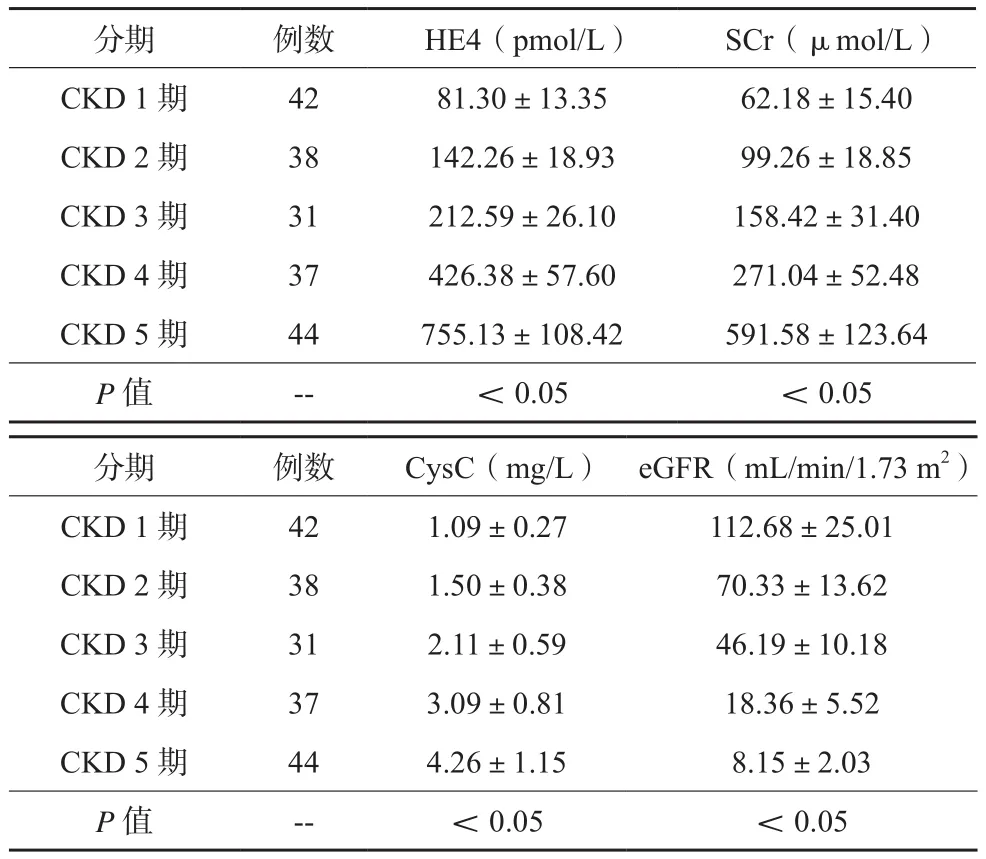
表1 不同分期CKD患者血清指标及eGFR比较()
分期 例数 HE4(pmol/L) SCr(μmol/L)CKD 1期 42 81.30±13.35 62.18±15.40 CKD 2期 38 142.26±18.93 99.26±18.85 CKD 3期 31 212.59±26.10 158.42±31.40 CKD 4期 37 426.38±57.60 271.04±52.48 CKD 5期 44 755.13±108.42 591.58±123.64 P值 -- <0.05 <0.05分期 例数 CysC(mg/L) eGFR(mL/min/1.73 m2)CKD 1期 42 1.09±0.27 112.68±25.01 CKD 2期 38 1.50±0.38 70.33±13.62 CKD 3期 31 2.11±0.59 46.19±10.18 CKD 4期 37 3.09±0.81 18.36±5.52 CKD 5期 44 4.26±1.15 8.15±2.03 P值 -- <0.05 <0.05
相关性分析示,血清HE4浓度与SCr(r=0.713)、CysC(r=0.659)均呈正相关,与eGFR(r=-0.705)呈负相关(P<0.05)。见图1~3。
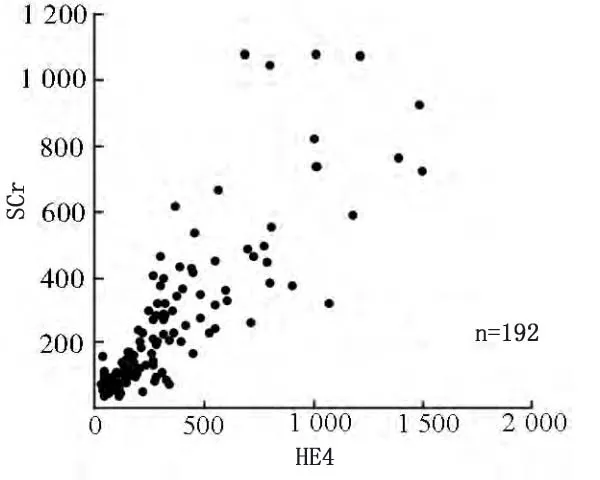
图1 血清HE4浓度与SCr浓度的相关性分析(r=0.713)

图2 血清HE4浓度与CysC浓度的相关性分析(r=0.659)
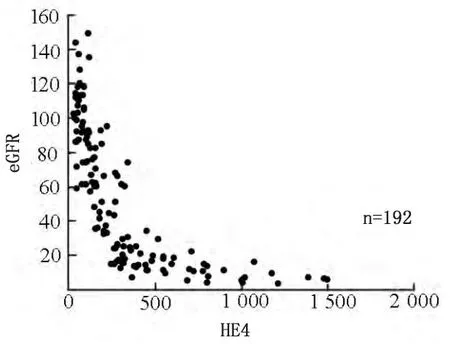
图3 血清HE4浓度与eGFR的相关性分析(r=-0.705)
3 讨论
随着病程的进展,CKD患者胶原蛋白和细胞外基质大量积聚,是引发肾脏尤其是肾间质纤维化的主要原因[10]。SCr、eGFR及蛋白尿等疾病严重程度评估指标均存在一定局限性[11-12]。HE4是具有免疫保护作用的蛋白酶抑制剂家族成员,广泛分布于正常生殖系统、上呼吸道、乳腺上皮、肾脏远曲小管、结肠粘膜上皮组织等,在卵巢恶性肿瘤中呈高表达,是卵巢癌的重要诊断标志物之一[13]。研究表明,HE4对卵巢癌的诊断特异性超过70%,灵敏度高达90%,在卵巢癌的早期诊断中具有重要意义[14]。最新研究发现,CKD患者血清HE4浓度亦呈上升趋势,且尿毒症患者血清HE4升高最为显著[15]。本研究就CKD患者、正常体检者血清HE4浓度进行了比较,结果表明,CKD患者血清HE4浓度明显升高,且随着患者疾病严重程度的进展,其血清HE4浓度进一步上升,表明血清HE4水平与肾功能具有密切关联,其机制可能与肾脏功能受损时β2微球蛋白等效分子物质含量上升一致,即肾脏功能受损后,小分子物质的滤过和重吸收均受到明显影响,而HE4相对分子质量仅为20k~25k,故在CKD患者中,肾小球滤过后HE4无法被有效清除,从而体现在血清浓度的大幅上升[16]。此外,有学者发现,HE4与肾纤维化过程密切相关,一方面,HE4能够抑制多种蛋白酶活性,发挥抑制胶原蛋白降解的作用,另一方面,HE4可促进胶原蛋白等细胞外基质大量积聚,促进肾纤维化的发生与发展[17]。
血液循环内CysC主要经肾脏代谢清除,故在反映肾小球滤过功能改变方面的敏感性高于SCr,且既往研究已证实CysC与eGFR的良好相关性,有学者将CysC用于CKD疾病严重程度的评估[18]。本研究相关性分析示,血清HE4浓度不仅与SCr、eGFR呈明显相关性,也与CysC存在高度正相关,其原因为:随着CKD的进展,肾脏正常组织结构逐渐被Ⅰ型胶原蛋白和其他细胞外基质蛋白取代,从而造成肾实质结构和功能的改变、CysC清除能力下降,并表现为血清CysC浓度上升;作为α平滑肌动蛋白的下游靶点之一,HE4是肾脏纤维化的下游信号通路,其分泌水平增加与肾间质纤维化比例呈高度正相关,因此,血清CysC水平的上升往往伴随着HE4浓度的增加。需要注意的是,由于HE4也是卵巢癌诊断和治疗效果评估的重要指标,故合并卵巢癌可能为CKD患者的HE4监测带来阳性结果,影响临床诊断和治疗的准确性,因此,这一指标暂不适用于合并卵巢癌的CKD患者的病情评估。
综上所述,HE4与CKD患者SCr、CysC均呈正相关性,随着血清HE4浓度的上升,患者疾病严重程度明显加剧,在今后的临床研究中,进一步明确肾功能受损不同阶段的HE4诊断界值,有望为CKD的诊断与治疗提供更为可靠的辅助参考。
[1] LV Y W, YANG L, ZHANG M, et al. Increased human epididymis protein 4 in benign gynecological diseases complicated with chronic renal insufficiency patients[J]. Genet Mol Res, 2015, 14(1): 2156-2161.
[2] CHAWLA L S, EGGERS P W, STAR R A, et al. Acute kidney injury and chronic kidney disease as interconnected syndromes[J]. N Engl J Med, 2014, 371(1): 58-66.
[3] HALTIA U M, HALLAMAA M, TAPPER J, et al. Roles of human epididymis protein 4, carbohydrate antigen 125, inhibin B and anti-Müllerian hormone in the differential diagnosis and follow-up of ovarian granulosa cell tumors[J]. Gynecol Oncol,2017, 144(1): 83-89.
[4] YANG Z, ZHANG Z, QIN B, et al. Human epididymis protein 4:a novel biomarker for lupus nephritis and chronic kidney disease in systemic lupus erythematosus[J]. J Clin Lab Anal, 2016,30(6): 897-904.
[5] DRAPKIN R, VON HORSTEN H H, LIN Y, et al. Human epididymis protein 4 (HE4) is a secreted glycoprotein that is overexpressed by serous and endometrioid ovarian carcinomas.[J]. Cancer Res, 2005, 65(6):2162.
[6] LOVISA S, ZEISBERG M, KALLURI R. Partial epithelial-tomesenchymal transition and other new mechanisms of kidney fibrosis[J]. Trends Endocrinol Metab, 2016, 27(10): 681-695.
[7] NAGY B, BHATTOA H P, STEIBER Z, et al. Serum human epididymis protein 4 (HE4) as a tumor marker in men with lung cancer[J]. Clin Chem Lab Med, 2014, 52(11): 1639-1648.
[8] STIEKEMA A, LOK C A R, KENTER G G, et al. A predictive model combining human epididymal protein 4 and radiologic features for the diagnosis of ovarian cancer[J]. Gynecol Oncol,2014, 132(3): 573-577.
[9] A L, K E, Y T, et al. Definition and classification of chronic kidney disease: A position statement from Kidney Disease:Improving Global Outcomes (KDIGO)[J]. Kidney Int, 2005,67(6):2089-2100.
[10] NAGY B, FILA L, CLARKE L A, et al. Human Epididymis Protein 4: A Novel Serum Inflammatory Biomarker in Cystic Fibrosis[J]. Chest, 2016, 150(3): 661-672.
[11] LOVISA S, LEBLEU V S, TAMPE B, et al. Epithelialto-mesenchymal transition induces cell cycle arrest and parenchymal damage in renal fibrosis[J]. Nat Med, 2015, 21(9):998-1009.
[12] WANG R N, GREEN J, WANG Z, et al. Bone Morphogenetic Protein (BMP) signaling in development and human diseases[J].Gene Dis, 2014, 1(1): 87-105.
[13] ESCUDERO J M, AUGE J M, FILELLA X, et al. Comparison of serum human epididymis protein 4 with cancer antigen 125 as a tumor marker in patients with malignant and nonmalignant diseases[J]. Clil Chem, 2011, 57(11):1534.
[14] HU L, DU S, GUO W, et al. Comparison of serum human epididymis protein 4 and carbohydrate antigen 125 as markers in endometrial cancer: a meta-analysis[J]. Int J Gynecol Cancer,2016, 26(2): 331-340.
[15] QIN L, MOHAN C. Non-invasive biomarkers for systemic lupus erythematosus: A lookback at 2016[J]. Int J Rheum Dis,2016, 19(12): 1209-1215.
[16] 卢美红, 杨春兰, 景蓉蓉, 等. 血清人附睾蛋白4表达与慢性肾脏病的相关性研究[J]. 现代检验医学杂志, 2017, 32(2): 75-77.
[17] 杨晓霞, 柏明, 刘丽敏, 等. 慢性肾脏病患者血清人附睾蛋白4与疾病进展的关系[J]. 肾脏病与透析肾移植杂志, 2016, 25(2):128-133.
[18] PIEK A, MEIJERS W C, SCHROTEN N F, et al. HE4 Serum Levels Are Associated with Heart Failure Severity in Patients With Chronic Heart Failure[J]. J Card Fail, 2017, 23(1): 12-19.
R446.1
A
2095-5200(2017)06-059-03
10.11876/mimt201706024
童天夫,本科,初级检验技师,研究方向:临床化学检验,Email:56489081@qq.com。
