多柔比星脂质体与表柔比星在乳腺癌化疗中的疗效对比
2017-12-21张改琴任毅厉锋李文广谢晓东杨欢
张改琴 任毅 厉锋 李文广 谢晓东 杨欢
(1.徐州市肿瘤医院肿瘤内科;2.徐州市肿瘤医院乳腺外科,江苏徐州 221000)
多柔比星脂质体与表柔比星在乳腺癌化疗中的疗效对比
张改琴1任毅2厉锋1李文广1谢晓东1杨欢1
(1.徐州市肿瘤医院肿瘤内科;2.徐州市肿瘤医院乳腺外科,江苏徐州 221000)
目的:对比多柔比星脂质体与表柔比星在乳腺癌化疗中的疗效与安全性。方法:以我院2012年3月至2014年3月收治的152例乳腺癌患者为研究对象,进行前瞻性对照分析。使用随机数表将患者分为多柔比星组、表柔比星组,各76例。多柔比星组采用紫杉醇+环磷酰胺+多柔比星脂质体方案,表柔比星组采用紫杉醇+环磷酰胺+表柔比星方案,化疗4周期后评价临床效果、毒副反应发生率,随访比较生存情况。结果:多柔比星组临床总有效率为74.66%,略高于表柔比星组的69.74%,但组间比较差异无统计学意义(P>0.05)。多柔比星组脱发、心肌损害发生率及分级均低于表柔比星组,其过敏反应发生率高于表柔比星组,差异有统计学意义(P<0.05)。多柔比星组3年无病生存时间(DFS)高于表柔比星组,差异有统计学意义(P<0.05);两组患者3年总生存时间(OS)比较,差异无统计学意义(P>0.05)。结论:两种药物的疗效相仿,而多柔比星脂质体能够降低脱发、心肌损害发生风险,延长患者DFS,但其过敏反应值得重视。
多柔比星脂质体;表柔比星;乳腺癌;新辅助化疗;疗效
当前临床治疗乳腺癌的手段包括外科手术、放疗、化疗、内分泌治疗、生物治疗等[1],其中,化疗是乳腺癌综合治疗中的重要组成部分[2]。作为转移性乳腺癌化疗的一线药物,蒽环类药物具有细胞毒性,能够介导自由基对DNA和细胞膜的损伤,结合DNA拓扑异构酶,引发细胞凋亡,但大量使用时可造成心脏毒性蓄积甚至导致充血性心力衰竭[3]。脂质体制剂将盐酸多柔比星包封于脂质体中,可降低其毒副反应。此次研究对比乳腺癌化疗中多柔比星脂质体与表柔比星疗效及安全性。
1 资料与方法
1.1 一般资料
2012年3月至2014年3月152例经病理组织学检查明确乳腺癌诊断[4]患者。使用随机数表将患者分为多柔比星组、表柔比星组,各76例。预计生存时间≥3个月。
两组患者均接受:紫杉醇80 mg/m2静滴,d1、d8、d15;环磷酰胺500 mg/m2静推,d1。多柔比星组加用多柔比星脂质体30 mg/m2静滴,d1;表柔比星组加用表柔比星75 mg/m2静滴,d1。21 d为1周期,患者治疗均持续4个周期。各周期紫杉醇静滴前,给予10 mg地塞米松静推+20 mg苯海拉明肌注;紫杉醇静滴后3~5 d均给予150 μg/d粒细胞集落刺激因子预防性注射,出现严重骨髓抑制者延缓下一治疗周期开始时间[5]。化疗期间副反应对症处理[6]。
1.2 观察指标
临床效果于化疗4周期后参照实体瘤疗效评价标准(RECIST)评价[7]:完全缓解(CR):患侧乳房未见可及肿块,同时腋窝未见可及肿大淋巴结;部分缓解(PR):肿瘤最大径之和减小≥30%但未达CR;疾病进展(PD):肿瘤最大径之和增大≥20%,或出现新病灶,或化疗前腋窝未见可及肿大淋巴结但化疗后淋巴结肿大可触及;疾病稳定(SD):肿瘤最大径之和减小<30%或增大<20%;总有效率=(CR+PR)/总例数×100%。毒副反应评价参照世界卫生组织(WHO)抗癌药物不良反应分级标准,包括0Ⅰ度、Ⅱ度、Ⅲ度、Ⅳ度,分级越高则毒副反应越严重。此外,采用电话随访、门诊复查、家庭访视等形式记录患者3年生存期,包括无病生存时间(DFS)及总生存时间(OS),DFS定义为术后1 d至局部区域复发、远处转移、对侧乳腺癌或其他新发恶性肿瘤,或任何原因导致的死亡;OS定义为入组首日至任何原因导致的死亡或末次随访[8]。
数据采用SPSS18.0分析,以P<0.05为差异有统计学意义,生存分析采用Kalpan-Meier法。
2 结果
两组患者年龄、TNM分期、病理分型等基线资料比较,差异无统计学意义(P>0.05),具有可比性。
多柔比星组临床总有效率为74.66%,略高于表柔比星组的69.74%,但组间比较差异无统计学意义(P>0.05)。多柔比星组脱发、心肌损害发生率及分级均低于表柔比星组,其过敏反应发生率高于表柔比星组,差异有统计学意义(P<0.05)。见表1。

表1 两组患者毒副反应发生率比较(n/%)
多柔比星组3年DFS高于表柔比星组,差异有统计学意义(P<0.05);两组患者3年OS比较,差异无统计学意义(P>0.05)。见图1、图2。
3 讨论
乳腺癌具有易发血行转移的生物学特征[9]。多柔比星、表柔比星均属蒽环类抗肿瘤药物,既往临床研究已证实表柔比星较多柔比星在晚期乳腺癌化疗中更为理想的效果与安全性,故近年来多柔比星的临床应用逐渐减少[10-11]。
脂质体药物制剂通过将药物包裹在脂质体内,在改变药物动力学性质和组织分布性质方面发挥了重要作用[12]。得益于脂质体的保护,药物在血浆中难以被降解失活,且药物体积的整体增大,对于降低正常内皮组织中药物浓度具有积极意义,而肿瘤组织内皮不连续且淋巴管破损明显,为病灶区域内药物大量外渗创造了良好条件,此时药物能够在肿瘤组织内维持较高浓度,达到更为理想的抗肿瘤效果[13-14]。一项Ⅲ期临床研究结果显示,与多柔比星相比,多柔比星脂质体不仅能够明显延长患者DFS,还可大幅降低毒副反应发生风险,保证治疗效果与安全性[15]。
此次研究就多柔比星脂质体与表柔比星两种药物的临床总有效率分别为74.63%、69.74%,组间比较差异无统计学意义,说明多柔比星脂质体的治疗效果与表柔比星相近,且远高于既往报道的30%~50%平均水平[16],证实脂质体在提升药物效果方面发挥的重要作用。而在生存期的对比中,可以发现,多柔比星脂质体能够更为有效地延长患者DFS,其机制可能为:在相同条件下,脂质体制剂能够躲避单核吞噬细胞(MPS)吞噬,此时肿瘤组织内有效药物浓度、滞留时间相对升高,肿瘤细胞杀伤更为全面、彻底,故患者复发、转移风险更低,DFS得以延长[17]。
在毒副反应的对比中,可以发现,多柔比星组脱发、心肌损害发生率及分级均低于表柔比星组,这与表柔比星的药理学机制有关:表柔比星主要通过自由扩散进入细胞,在抑制肿瘤细胞增长的同时,也影响着正常树突状细胞增殖,正常组织内大量分布的表柔比星,是导致药物心脏毒性与脱发风险较高的主要原因。与之相比,脂质体表面的聚乙二醇化使其缓释性更强,且较难进入处于终末成熟期细胞生长周期的树突状细胞,故多柔比星脂质体对于降低脱发、心肌损害发生率与分级有着更为明显的作用[18]。需要注意的是,多柔比星脂质体过敏反应发生率高于表柔比星,说明多柔比星脂质体的皮肤毒性仍值得重视,但其机制尚不明确,有待进一步探索。
综上所述,多柔比星脂质体与表柔比星在乳腺癌化疗中的效果相仿,而多柔比星脂质体能够在延长患者DFS的基础上,降低脱发、心肌损害发生风险,安全性更为理想,但其皮肤毒性风险与发生机制仍有待研究。
[1] YAMAGUCHI N, FUJII T, AOI S, et al. Comparison of cardiac events associated with liposomal doxorubicin, epirubicin and doxorubicin in breast cancer: a Bayesian network metaanalysis[J]. Eur J Cancer, 2015, 51(16): 2314-2320.
[2] BASELGA J, MANIKHAS A, CORTÉS J, et al. Phase III trial of nonpegylated liposomal doxorubicin in combination with trastuzumab and paclitaxel in HER2-positive metastatic breast cancer[J]. Ann Oncol, 2014, 25(3): 592-598.
[3] 骆楚君, 钟黛云, 张建萍. 多柔比星和表柔比星治疗转移性乳腺癌的系统评价[J]. 中国药学杂志, 2016, 51(4): 321-325.

图2 两组患者3年OS的Kalpan-Meier曲线
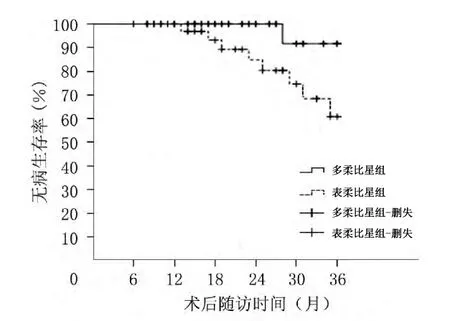
图1 两组患者3年DFS的Kalpan-Meier曲线
[4] TAHOVER E, PATIL Y P, GABIZON A A. Emerging delivery systems to reduce doxorubicin cardiotoxicity and improve therapeutic index: focus on liposomes[J]. Anticancer Drugs,2015, 26(3): 241-258.
[5] ZAGAR T M, VUJASKOVIC Z, FORMENTI S, et al. Two phase I dose-escalation/pharmacokinetics studies of low temperature liposomal doxorubicin (LTLD) and mild local hyperthermia in heavily pretreated patients with local regionally recurrent breast cancer[J]. Int J Hyperthermia, 2014, 30(5): 285-294.
[6] SMORENBURG C H, DE GROOT S M, VAN LEEUWENSTOK A E, et al. A randomized phase III study comparing pegylated liposomal doxorubicin with capecitabine as firstline chemotherapy in elderly patients with metastatic breast cancer: results of the OMEGA study of the Dutch Breast Cancer Research Group BOOG[J]. Ann Oncol, 2014, 25(3): 599-605.
[7] 涂俊, 杨娟, 刘景丽, 等. 不同制剂紫杉醇联合表柔比星治疗晚期乳腺癌的临床观察[J]. 实用肿瘤杂志, 2017, 32(2): 168-172.
[8] ESPELIN C W, LEONARD S C, GERETTI E, et al. Dual HER2 targeting with trastuzumab and liposomal-encapsulated doxorubicin (MM-302) demonstrates synergistic antitumor activity in breast and gastric cancer[J]. Cancer Res, 2016, 76(6):1517-1527.
[9] THAVENDIRANATHAN P, POULIN F, LIM K D, et al. Use of myocardial strain imaging by echocardiography for the early detection of cardiotoxicity in patients during and after cancer chemotherapy: a systematic review[J]. J Am Coll Cardiol, 2014,63(25): 2751-2768.
[10] TUXEN M K, COLD S, TANGE U B, et al. Phase II study of neoadjuvant pegylated liposomal doxorubicin and cyclophosphamide±trastuzumab followed by docetaxel in locally advanced breast cancer[J]. Acta Oncol, 2014, 53(10):1440-1445.
[11] SUN W L, CHEN J, WANG Y P, et al. Autophagy protects breast cancer cells from epirubicin-induced apoptosis and facilitates epirubicin-resistance development[J]. Autophagy,2011, 7(9):1035-1044.
[12] RAU K M, LIN Y C, CHEN Y Y, et al. Pegylated liposomal doxorubicin (Lipo-Dox®) combined with cyclophosphamide and 5-fluorouracil is effective and safe as salvage chemotherapy in taxane-treated metastatic breast cancer: an open-label, multicenter, non-comparative phase II study[J]. BMC Cancer, 2015,15(1): 423.
[13] HUANG M, CHEN Z L, FU J, et al. Pegylated or non-pegylated liposomal doxorubicin in the management of advanced breast cancer: a meta-analysis[J]. Int J Clin Exp Med, 2016, 9(2): 525-534.
[14] PALMIERI C, MISRA V, JANUSZEWSKI A, et al. Multicenter experience of nonpegylated liposomal doxorubicin use in the management of metastatic breast cancer[J]. Clin Breast Cancer,2014, 14(2): 85-93.
[15] NORTHFELT D W, DEZUBE B J, THOMMES J A, et al. Pegylated-liposomal doxorubicin versus doxorubicin,bleomycin, and vincristine in the treatment of AIDS-related Kaposi’s sarcoma: results of a randomized phase III clinical trial.[J]. J Clin Oncol, 1998, 16(7):2445.
[16] RIVANKAR S. An overview of doxorubicin formulations in cancer therapy[J]. J Cancer Res Ther, 2014, 10(4): 853.
[17] VON MINCKWITZ G, SCHNEEWEISS A, LOIBL S, et al.Neoadjuvant carboplatin in patients with triple-negative and HER2-positive early breast cancer (GeparSixto; GBG 66): a randomised phase 2 trial[J]. Lancet Oncol, 2014, 15(7): 747-756.
[18] ZHANG R X, CAI P, ZHANG T, et al. Polymer-lipid hybrid nanoparticles synchronize pharmacokinetics of co-encapsulated doxorubicin-mitomycin C and enable their spatiotemporal co-delivery and local bioavailability in breast tumor[J].Nanomedicine, 2016, 12(5): 1279-1290.
R737.9
A
2095-5200(2017)06-028-03
10.11876/mimt201706011
张改琴,硕士,主治医师,研究方向:胸部及消化道肿瘤临床,Email:gaiqing3584@163.com。
厉锋,硕士在读,副主任医师。
