6-羟基多巴模型大鼠salsolinol氮甲基转移酶活性检测
2017-12-21张镇松邓玉林
张镇松,柯 酩,邓玉林*
(1.中国科学院生态环境研究中心,北京 100085; 2.北京理工大学生命学院,北京 100081)
6-羟基多巴模型大鼠salsolinol氮甲基转移酶活性检测
张镇松1,柯 酩2,邓玉林2*
(1.中国科学院生态环境研究中心,北京 100085; 2.北京理工大学生命学院,北京 100081)
研究报告
目的应用6-羟基多巴(6-hydroxydopamine, 6-OHDA)制作帕金森病(Parkinson’ s disease,PD)大鼠模型,并对大鼠外周血淋巴细胞中salsolinol氮甲基转移酶(SNMT)的活性进行测定。方法利用单侧双点注射6-OHDA损毁大鼠纹状体,构建PD模型并对模型进行行为学评价;从模型大鼠外周血淋巴细胞中提取SNMT粗酶液,建立酶反应产物N-methyl-salsolinol(NMSal)的高效液相色谱串联三重四极杆质谱检测方法,以NMSal的生成量表征SNMT的活性。结果18只经过6-OHDA注射的大鼠共有7只经阿朴吗啡诱导后表现为恒定向未损毁侧旋转(>7 r/min),建模成功率为38.9%。建立了基于多反应监测技术的SNMT活性的高选择性、高灵敏度、高重复性的表征方法。该方法中NMSal的检出限和定量限分别达到49 pmol/L和98 pmol/L,日内和日间精密度均在6.0%以下。检测结果显示PD组大鼠外周血淋巴细胞中SNMT的活性与假手术组、正常组相比差异有显著性(P< 0.01,n=5),而正常组和假手术组之间差异无显著性(P> 0.05,n=5)。结论外周血淋巴细胞中SNMT活性可能反映出PD发病状况,有望成为诊断的指标之一。
Salsolinol氮甲基转移酶;帕金森病;6-羟基多巴;外周血淋巴细胞;高效液相色谱串联三重四极杆质谱
帕金森病(Parkinson’ s disease, PD)是一种与遗传和环境因素相关的中老年神经系统变性疾病,主要临床特征为静止性震颤、肌强直、运动和认知功能障碍等[1]。该病平均发病年龄55岁,并随年龄增加发病率呈上升趋势。PD确切的发病机制尚未完全清楚。
自从MPTP(1-甲基-4-苯基-1、2、3、6-四氢吡啶)[2]等外源性神经毒素被报道能诱发产生PD相似症状之后,探寻自身存在且结构与MPTP相似的内源性神经毒素一直是PD的研究热点。其中儿茶酚异喹啉类物质salsolinol[3](1-甲基-6,7-二羟基-1,2,3,4-四氢异喹啉,Sal)及其衍生物N-methyl-salsolinol(6,7-二羟基-1,2-二甲基-1,2,3,4-四氢异喹啉,NMSal)可作为内源性神经毒素导致神经元特异性死亡,产生PD症状[4]。NMSal通过Sal氮甲基转移酶(salsolinol N-methyltransferase,SNMT)催化Sal吡啶环的N位甲基化生成(如图1所示),这个氮甲基化的酶反应在体内和体外得到了证明。依据催化条件的不同,SNMT可分为中性SNMT和碱性SNMT,在纹状体区可以检测到中性SNMT活性[5-7],说明只有中性SNMT与PD相关。SNMT催化Sal生成的NMSal可以引起线粒体功能紊乱和细胞凋亡,并可导致Wistar大鼠出现帕金森病[8]。据此可知,SNMT是Sal代谢过程中导致神经毒性显著增加的关键致病因子,可能在PD发病过程中起到重要作用。

图1 SNMT催化Sal生成NMSal的反应方程式Fig.1 The reaction equation of N-methyl-salsolinol from salsolinol catalyzed by SNMT
目前关于SNMT的分子生物学研究并不多见,为表征PD病人外周血淋巴细胞中SNMT活性,寻找PD诊断的潜在生物标志物,本文通过6-羟基多巴(6-OHDA)双点注射单侧损毁大鼠纹状体构建PD模型,从大鼠外周血分离的淋巴细胞中提取出SNMT粗酶液。由于粗酶液中SNMT浓度极低,因此对酶活测定方法的灵敏度要求很高。为此建立以多反应监测(multiple reaction monitoring,MRM)技术为基础的高效液相色谱串联电喷雾离子化三重四极杆质谱(HPLC-ESI-QQQ)的SNMT活性测定方法。该方法通过MRM母离子-子离子双重选择,可有效排除其他不关注的干扰离子,使目标物的信噪比大幅提高,既提高定性结果的特异性,又提高定量结果的灵敏度。通过对6-OHDA诱导的PD模型大鼠外周血淋巴细胞中的SNMT活性进行检测,可为PD的诊断提供一定的实验参考。
1 材料和方法
1.1 实验动物
清洁级雄性Wistar大鼠,2~3月龄,体重(200±20 g),购于中国医学科学院实验动物研究所[SCXK(京)2005-0013],饲养于北京理工大学动物实验室[SYXK(京)2012-0035]。36只大鼠随机分成PD组18只、假手术组9只和正常组9只。饲养条件:单独隔离笼具饲养,温度控制在18~21℃,湿度大于40%,自由进食进水,每隔一天换一次木屑垫料。实验均按实验动物使用与管理规范给予人道的关怀。
1.2 主要试剂与仪器
6-OHDA、抗坏血酸、戊巴比妥钠、异丙基肾上腺素(isoproterenol,Isop)、阿朴吗啡(apomorphine, APO)、N-methyl-(R)-salsolinolhydrobromide、S-腺苷甲硫氨酸(甲基供体,SAM)、和Ro 41-0960均购于美国Sigma公司;大鼠淋巴细胞分离液购于北京索莱宝科技有限公司;甲醇等色谱纯的有机试剂购自美国Fisher公司;Sal由本实验室合成并纯化;其他分析纯化学试剂均从北京化学试剂公司订购。
日本Narishige立体定位仪、牙科钻;日本Hitachi CR21G2高速离心机;美国Agilent 1290高效液相色谱;美国Agilent 6460三重四级杆质谱。
1.3 实验方法
1.3.1 单侧双点注射6-OHDA损毁纹状体
腹腔注射质量分数为1%的戊巴比妥钠溶液深度麻醉大鼠,严格颅平位固定大鼠脑颅于立体定位仪上,剃除头顶部毛发,于头颅中部切开大鼠头皮以及筋膜,用3% 双氧水消化骨膜,以暴露出前囟。参照Paxinos等[9]大鼠脑立体定位图谱,确立右侧纹状体双点法注射坐标。注射坐标之一:前囟后0.2 mm,中线右侧2.6 mm,硬膜下6.0 mm;注射坐标之二:前囟前0.7 mm,中线右侧3.0 mm,硬膜下4.5 mm。用牙科钻小心钻透颅骨,将微量注射器缓慢进针到预定深度,PD组大鼠分别在两个坐标处向右侧纹状体注射6-OHDA 10 μg(溶于5 μL含0.2%抗坏血酸的生理盐水),假手术组大鼠分别在两个坐标处向右侧纹状体注射抗坏血酸10 μg(溶于5 μL含0.2%抗坏血酸的生理盐水),正常组不进行任何处理。注射速度1 μL/min。留针5 min后退针,用牙科胶覆盖钻孔,缝合伤口。
1.3.2 行为学评价
6-OHDA立体定位注射4周后对大鼠进行腹腔注射APO(0.5 mg/kg),10 min后放入塑料脸盆中观察并记录大鼠40 min内首尾相接旋转的圈数。若大鼠恒定向未损毁侧(左侧)旋转,且平均每分钟旋转圈数大于7圈,可视为建模成功;若大鼠没有旋转行为、旋转方向无规律、恒定转向损毁侧(右侧)或以小于7 r/min转速转向左侧,则视为建模不成功。旋转行为测试从6-OHDA注射手术后第4周开始连续测试3次,每周一次。
1.3.3 SNMT粗酶液制备制备
单侧损毁手术后第6周,对正常组、假手术组和行为学评价成功的PD组大鼠进行腹腔注射1%(质量分数)戊巴比妥钠溶液深度麻醉,然后解剖胸腔,从大鼠心脏中抽取新鲜血液缓慢铺在预先加有淋巴分离液的离心管中。2000 r/min离心30 min后,吸取中间的白色淋巴细胞层,转移到另一离心管中,用PBS缓冲液反复冲洗干净后,用液氮多次冻融破碎淋巴细胞,高速低温离心40 min后吸取少量上清液用Bradford法测蛋白浓度,其余上清液作为SNMT粗酶液。
1.3.4 酶反应条件
本文设置对照组,以扣除酶反应底物中参杂的NMSal以及大鼠脑中内源性的NMSal的干扰。对照组中SNMT粗酶液预先在95℃水中维持10 min以使SNMT失活,其余操作同酶反应组。酶反应组和对照组按表1所示条件添加反应试剂混匀,37℃恒温条件下放置30 min后,加入25 μL 2 mol/L高氯酸溶液(含0.25% Vc防止反应产物NMSal被氧化)终止酶反应,加入25 μL 30 nmol/L Isop作为内标,混匀后置于17 000 g条件下低温离心30 min,上清液用0.22 μm滤膜过滤后进行HPLC-ESI-QQQ检测。
1.3.5 色谱条件
固定相:Discovery®HS F5五氟苯基色谱柱(4.6 mm直径×100 mm, 孔径5 μm);流动相A:10 mmol/L甲酸铵溶液,pH值为4;流动相B:甲醇。B相梯度变化时间表:0~5 min: 25% B; 5~15 min:25%~90% B; 15~19 min: 90% B; 19~21 min: 90%~25% B; 21~26 min: 25% B;柱温:30℃;样品温度:4℃;流速:0.5 mL/min;进样量:15 μL。
1.3.6 质谱条件
离子源:ESI正离子模式;对NMSal和Isop的特征离子对、毛细管出口电压和碰撞能量参数设置如表2所示。

表1 酶反应组和对照组反应条件Tab.1 Conditions of the enzyme reaction group and control group
注:“√”表示添加;“*”表示预先在95℃水中维持10 min。
Note.“√”means reagents added; “*” means the supernatant was incubated in water at 95℃ for 10 min before added into the reaction system.
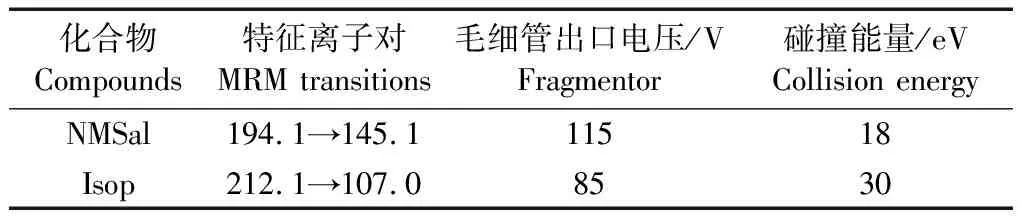
表2 NMSal和Isop的MRM参数Tab.2 MRM parameters of NMSal and Isop
1.3.7 SNMT活性定量检测
根据上述色谱、质谱条件对酶反应组和对照组中NMSal含量进行HPLC-ESI-QQQ检测,以二者差值作为酶反应产物的生成量,用每毫克蛋白每小时催化生成反应产物NMSal的量作为SNMT活性单位pmol/(h·mg),分别对PD组、假手术对照组和正常组大鼠外周血淋巴细胞中SNMT的活性进行表征。
1.4 统计学方法
2 结果
2.1 6-OHDA模型大鼠行为学评价
动物的行为学变化是评价6-OHDA模型是否成功的可靠标志。在鼠脑大脑纹状体单侧注射6-OHDA造成损害,导致两侧大脑半球机能不对称。当中枢神经系统多巴胺能神经元缺失90%以上时,突触后膜多巴胺受体出现超敏现象。APO是突触后膜D2受体激动剂,可诱导模型大鼠出现向健侧的旋转行为,其旋转次数与神经元数目成反比。因此,可利用APO诱导进行PD大鼠旋转行为测试[10]。
注射6-OHDA两周后发现PD组部分大鼠出现尾巴及四肢震颤、僵化等现象、还伴有翻滚、拱背、压尾、扒背、头部静止性震颤、躁动、肢体强直、僵直性转头动作等异常行为,偶有抽搐表现(图2)。建模手术4周后连续3周对正常组、假手术组及PD组大鼠腹腔注射APO,观察记录大鼠的旋转行为,测试结果如表3所示。18只经过6-OHDA诱导的PD组大鼠中,共有7只连续2周40 min内恒向旋转速率>7 r/min,建模成功率达到38.9%。正常组和假手术组进行平行测试,发现注射APO后40 min内无明显转圈行为发生。
2.2 背景基质中内源性NMSal、Isop考察
为了让标准曲线工作液尽可能地反映成分复杂的生物样品的真实信息,使酶反应产物NSMal的定量结果更为可靠,本研究中以正常大鼠外周血淋巴细胞SNMT粗酶液作为生物背景基质溶液,再往溶液中添加内标Isop和NMSal的标准品来配制用于NMSal定量的标准曲线工作液。Zhang等[11]直接使用纯水稀释NMSal配制标准曲线工作液,可能导致标准溶液与实际样品中NMSal的保留时间存在偏差,造成NMSal假阳性的定性结果。对生物背景基质溶液中的内源性NMSal和Isop进行考察。取正常大鼠外周血淋巴细胞SNMT粗酶液在17 000 g条件下低温离心30 min以除去沉淀,再用0.22 μm滤膜过滤后进行HPLC-ESI-QQQ检测,结果显示从大鼠外周血淋巴细胞中提取的SNMT粗酶液含有极少量NMSal(图3 A),而Isop在检出限以下(图3B)。说明生物背景基质中并无Isop干扰物的存在,可以选取Isop作为NMSal定量的内标。
用6 mol/LNaOH调节正常大鼠外周血淋巴细胞SNMT粗酶液pH值至12,并在室温中放置24 h后用甲酸调节pH值至4,于17 000 g低温条件下离心30 min,滤膜过滤后进行HPLC-ESI-QQQ检测。结果显示(图4),SNMT粗酶液中检测不到NMSal和Isop的存在,说明强碱处理法能够有效去除内源性NMSal等物质,可用此方法制备标准曲线工作液。

注:(A)尾巴僵化;(B)翻身;(C)压尾。图2 APO诱导后大鼠行为表现。Note.(A) Tail rigidity; (B) Turning over; (C) Stressing tail.Fig.2 Behavioral performance of the APO-induced rats表3 APO诱导后大鼠旋转实验结果Tab.3 Results of rotation test of the APO-induced rats

APO诱导次数TimesofinductionbyAPO旋转速率>7r/min的大鼠数量Numberofratswithrotationrateofmorethan7r/min平均旋转速率(r/min)Averagerotationrate1597±1427135±2737142±28
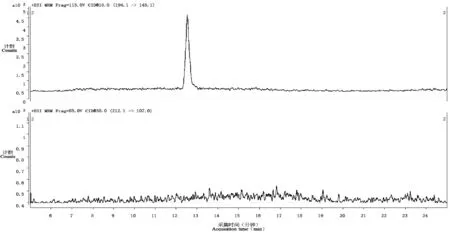
图3 SNMT粗酶液中NMSal和Isop的HPLC-ESI-QQQ提取色谱图Fig.3 HPLC-ESI-QQQ extracted chromatograms of NMSal and Isop in the supernatant containing SNMT

图4 强碱处理后NMSal及Isop的HPLC-ESI-QQQ提取色谱图Fig.4 HPLC-ESI-QQQ extracted chromatograms of NMSal and Isop after alkali treatment
2.3 NMSal标准曲线及线性范围、最低检出限和最低定量限
用生物背景基质溶液(强碱处理后,下同)配制100 nmol/L、50 nmol/L、25 nmol/L(依此等比递减至24.4 pmol/L)等13个不同浓度NMSal的标准曲线工作液,其中内标物Isop的浓度均为10 nmol/L。对标准曲线工作液进行HPLC-ESI-QQQ分析,以NMSal和Isop的浓度比为横坐标、峰面积比为纵坐标,进行线性回归,得到线性方程。其线性系数、线性范围、检出限和定量限如表4所示。

表4 NMSal线性方程、线性系数、线性范围、检出限和定量限Tab.4 The calibration curve, coefficient, range, LOD and LQD of NMSal

表5 HPLC-ESI-QQQ测定SNMT活性的精密度Tab.5 The precision of SNMT activity determined by HPLC-ESI-QQQ
2.4 精密度考察
对取自同一酶原的样品平行6次进行酶反应后,以酶反应组和对照组中NMSal含量的差值作为酶反应产物的生成量,用每毫克蛋白每小时催化Sal生成产物NMSal的量pmol/(h·mg)作为酶活性单位,对SNMT的活性进行HPLC-ESI-QQQ检测,结果表明该方法具有良好的精密度,日内和日间精密度均在6.0%范围内(见表5)。
2.5 6-OHDA诱导的PD模型大鼠SNMT活性的检测
按上述建立的方法,对正常组、假手术组和PD组大鼠外周血淋巴细胞中的SNMT进行酶活性测定。如图5所示,正常组、假手术组和PD组大鼠外周血淋巴细胞中SNMT活性分别为(2.16±5.82)、(0.58±2.32)、(43.37±9.49) pmol/(h·mg)。PD组SNMT活性分别是假手术组和正常组的74.8倍和20.0倍,差异有显著性(P< 0.01),而正常组和假手术组之间差异无显著性(P> 0.05)。

注:与正常组、假手术组比,* P<0.01。图5 正常组、假手术组和PD组大鼠外周 血液淋巴细胞中SNMT的活性(n=5)Note.Compared with the normal and sham-operated groups,* P<0.01.Fig.5 SNMT activity in peripheral lymphocytes from the normal, sham-operated and PD groups
3 讨论
6-OHDA单侧损毁大鼠模型是目前研究PD发病过程和筛选治疗药物最常用的模型之一,其过程呈慢性渐进式改变,通过逆向轴浆运输将6-OHDA运输至黑质致密部引起黑质多巴胺能神经元变性死亡,可模拟PD中、早期发病症状[12]。Zhang所用模型为大鼠脑黑质致密部(substantia nigra pars compacta, SNpc)定点注射6-OHDA,SNpc定点注射12 h后即出现约90%的多巴胺细胞丢失,称为“急性完全损毁”模型,该模型大鼠易死于不能取食和渴感缺乏等并发症[13],更适用于模拟晚期PD症状。为表征PD患者外周血淋巴细胞中SNMT活性,寻找PD早期诊断的潜在生物标志物,实验通过单侧纹状体双点注射6-OHDA制备PD大鼠模型。模型的行为学评价结果显示,18只经过6-OHDA诱导的大鼠中共有7只通过行为学评价,模型建模成功率比较低的主要原因是鼠脑纹状体体积较小,造成定位注射准确率降低。
关于SNMT活性的检测目前报道的方法主要有高效液相色谱串联电化学检测器(HPLC-ECD)[14,15]和高效液相色谱串联电喷雾离子化飞行时间质谱(HPLC-ESI-TOF)[11,16]等,实验开发了基于多反应监测模式(MRM)的SNMT活性的高选择性、高灵敏度、高重复性的检测方法。该方法通过MRM技术的子母两级离子选择,有效排除了复杂生物样品中在同一保留时间共流出的其他离子的干扰,使复杂生物样品的质谱检测背景和假阳性率显著降低,目标化合物的信噪比显著提高,能够满足HPLC-ECD或HPLC-ESI-TOF等其他检测方法难以达到的高灵敏度要求。该方法中NMSal的检出限低达49 pmol/L,灵敏度与窦凯飞等[17]建立的HPLC-ECD检测方法相比提高约2个数量级。Zhang[11]、牟晓玲[18]等建立的HPLC-ESI-TOF检测方法利用高效液相色谱的保留时间性质和飞行时间质谱的高分辨率特性对NMSal进行定性,以及高效液相色谱电喷雾离子化飞行时间质谱(HPLC-ESI-TOF)仪器的提取离子流色谱图(extracted ion chromatograms,EIC)对NMSal进行定量。因生物样品的复杂性,该方法容易造成NMSal定性结果的假阳性,而本文建立的HPLC-ESI-QQQ方法采用MRM定量模式,可通过特征离子对(MRM transitions)排除与待测物相同质荷比的子离子共流出对待测物定量造成的干扰,其高选择性的优势是HPLC-ECD和HPLC-ESI-TOF等方法无法比拟的,其灵敏度也比HPLC-ESI-TOF方法高约3个数量级。
PD主要病理特征为中脑黑质多巴胺能神经元的大量缺失以及残存的神经元中形成路易小体,典型的临床运动症状通常只在病人黑质多巴胺能神经元缺失一半、纹状体中多巴胺分泌减少80%以上时才表现出来,而早期临床症状并不典型且较隐蔽,因此容易被误诊或漏诊。目前关于PD的早期诊断主要依靠功能影像学成像技术和寻找生物标志物两方面。有研究表明血清中C3c补体及相关蛋白有望作为PD诊断的生物标志物[19];在散发PD病人CSF中Dj-1基因水平升高,是PD在基因水平上潜在的诊断标志物[20];以8-羟基-2-鸟核苷酸作为DNA氧化损伤的指标,也可能是PD的临床诊断生物标志物[21];另有研究发现PD病人血浆中α-synuclein含量降低[22],但仍处在实验初级阶段。本文对6-OHDA诱导的PD模型大鼠外周血淋巴细胞中的SNMT活性进行表征,结果发现PD模型组大鼠SNMT活性显著升高。与Zhang等测得的大鼠外周血淋巴细胞中SNMT的活性相比数值小了约3个数量级,分析其原因,除了所建的模型不同之外,可能是Zhang等在酶反应步骤并没有设置对照组以扣除酶反应底物中可能含有的NMSal以及大鼠脑中内源性的NMSal的干扰,故造成SNMT的活性检测结果偏大。实验结果提示以外周血淋巴细胞中SNMT活性为考察对象,可为利用PD大鼠模型筛选潜在的生物标志物提供初期的实验依据。
[1] Tolosa E, Gaig C, Santamaria J, et al. Diagnosis and the premotor phase of Parkinson disease [J]. Neurology, 2009, 72(7): S12-20.
[2] Langston JW, Ballard P, Tetrud JW, et al. Chronic Parkinsonism in humans due to a product of meperidine-analog synthesis [J]. Science, 1983, 219(4587): 979-980.
[3] Naoi M, Maruyama W, Nagy GM. Dopamine-derived salsolinol derivatives as endogenous monoamine oxidase inhibitors: occurrence, metabolism and function in human brains [J]. Neurotoxicology, 2004, 25(1-2): 193-204.
[4] Martinez-Alvarado P, Dagnino-Subiabre A, Paris I, et al. Possible role of salsolinolquinonemethide in the decrease of RCSN-3 cell survival [J]. Biochem Biophys Res Commun, 2001, 283(5): 1069-1076.
[5] Naoi M, Matsuura S, Takahashi T, et al. A N-methyltransferase in human brain catalyses N-methylation of l,2,3,4-tetrahydroisoquinoline into N-methyl-1,2,3,4-tetrahydroisoquinoline, a precursor of a dopaminergic neurotoxin, N-methylisoquinolinium ion [J]. Biochem Biophys Res Commun, 1989, 161(3): 1213-1219.
[6] Maruyama W, Nakahara D, Ota M, et al. N-methylation of dopamine-derived 6,7-dihydroxy-l,2,3,4-tetrahydroisoquinoline, (R)-salsolinol, in rat brains: in vivo microdialysis study [J]. J Neurochem, 1992, 59(2): 395-400.
[7] Naoi M, Maruyama W, Dostert P, et al. N-Methyl-(R)salsolinol as a dopaminergic neurotoxin: from an animal model to an early marker of Parkinson’ s disease [J]. J Neural Transm Suppl, 1997, 50: 89-105.
[8] Naoi M, Maruyama W, Dostert P, et al. Dopamine-derived endogenous 1(R),2(N)-dimethyl-6,7-dihy-droxy-1,2,3,4-tetrahydroisoquinoline, N-methyl-(R)-salsolinol, induced parkinsonism in rat: biochemical, pathological and behavioral studies [J]. Brain Res, 1996, 709(2): 285-295.
[9] Paxinos G, Watson C. The rat brain stereotaxic coordinates [M]. Academic Press Sydney, 1985, 25:87-92.
[10] Heikkila RE, Shapiro BS, Duvoisin RC. The relationship between loss of dopamine nerve terminals, striatal[3H] spiroperidol binding and rotational behavior in unilaterally 6-hydoroxydopamine-lesioned rats [J]. Brain Res, 1981, 211(2): 285-292.
[11] Zhang YQ, Wang L, Mu XL, et al. Assessment of salsolinol N-methyltransferase activity in rat peripheral lymphocytes by liquid chromatography-electrospray time-of-flight mass spectrometry [J]. Anal Bioanal Chem, 2011, 399(10): 3541-3545.
[12] 王晓晓, 付文玉, 庄文欣, 等. 改良纹状体内两点注射6-OHDA法制备大鼠帕金森病模型[J]. 神经解剖学杂志, 2015, 31(2): 187-192.
[13] 史肖锦, 屈洪党. 神经毒素诱导帕金森病动物模型的概述 [J]. 中外医疗, 2015, 21: 197-198.
[14] Naoi M, Maruyama W, Nakao N, et al. (R)salsolinol N-methyltransferase activity increases in parkinsonian lymphocytes [J]. AnnNeuro, 1998, 43(2): 212-216.
[15] Wang D, Zhu W, An YR, et al. LC with novel electrochemical detection for analysis of monoamine neurotransmitters in rat brain after administration of (R)-salsolinol and (R)-N-methylsalsolinol[J]. Chromatographia, 2008, 67(5): 369-374.
[16] 牟晓玲, 张天, 彭博, 等.Wistar大鼠脑内各区的Salsolinol氮甲基转移酶活性检测 [J]. 分析测试学报, 2007, 26(S1): 87-89.
[17] 窦凯飞, 杨威, 王冉, 等. DA、Salsolinol及N-methyl-salsolinol的HPLC-ECD检测方法研究 [J]. 现代科学仪器, 2007, (6): 57-59.
[18] 牟晓玲, 李丽莉, 朱勇, 等. 帕金森模型大鼠脑内儿茶酚胺异喹啉类化合物的形成与代谢[J]. 化学通报, 2008, 71(6): 439-442.
[19] Goldknopf IL, Sheta EA, Bryson J, et al. Complement C3c and related protein biomarkers in amyotrophic lateral sclerosis and Parkinson’ s disease [J]. Biochem Biophys Res Commun, 2006, 342(4): 1034-1039.
[20] Waragai M, Wei JS, Fujita, M, et al. Increased level of DJ-1 in the cerebrospinal fluids of sporadic Parkinson’ s disease [J]. Biochem Biophys Res Commun, 2006, 345(3): 967-972.
[21] Yasuharaa T, Haraa K, Sethi KD, et al. Increased 8-OHdG levels in the urine, serum, and substantia nigra of hemiparkinsonian rats [J]. Brain Res, 2007, 1113(1): 49-52.
[22] Li QX, Su SM, Laughton KM, et al. Plasma α-synuclein is decreased in subjects with Parkinson’ s disease [J]. Exp Neuro, 2007, 204(2): 583-588.
DeterminationofsalsolinolN-methyltransferaseactivityin6-OHDA-lesionedrats
ZHANG Zhen-song1, KE Ming2, DENG Yu-lin2*
(1.Research Center for Eco-Environmental Sciences,Chinese Academy of Sciences,Beijing 100085,China; 2.School of Life Sciences,Beijing Institute of Technology,Beijing 100081)
ObjectiveThe aim of this study was to establish a rat model of Parkinson’ s disease (PD) by using 6-hydroxydopamine (6-OHDA) and detect the salsolinol N-methyltransferase (SNMT) activity in peripheral lymphocytes of PD rats for the development of a biomarker for early diagnosis of PD.MethodsRat model of PD was established by unilateral double-pointed injection of 6-OHDA into the striatum and was verified by behavior observation. An analytical method was developed based on multiple reaction monitoring with HPLC-ESI-QQQ to determine the SNMT activity in peripheral lymphocytes.ResultsSeven of 18 rats injected with 6-OHDA showed steadily apomorphine-induced rotation (>7 r/min). The success rate was 38.9%. A sensitive and stable quantitative method with internal standard added was created, based on multiple reaction monitoring mode to analyze SNMT activity. The limit of detection (LOD) and limit of quantitation (LQD) of N-methyl-salsolinol, which is the product of Salsolinol catalyzed by SNMT, were 49 pmol/L and 98 pmol/L, respectively. The precisions of intra-day and inter-day assays both were below 6.0%. SNMT activity of peripheral lymphocytes in the 6-OHDA-lesioned rats was significantly increased [43.37±9.49 pmol/(h·mg)NMSal] in comparison with that in the normal group [2.16±5.82 pmol/(h·mg)NMSal] and the sham-operated group [0.58±2.32 pmol/(h·mg)NMSal](P< 0.01,n=5). There was no significant difference between the normal group and sham-operated group (P< 0.05,n=5).ConclusionsOur results indicate that SNMT activity may reflect the changes in the course of Parkison’ s disease and may become a potential clinical biomarker in diagnosis of this disease.
Salsolinol N-methyltransferase; Parkinson’s disease; 6-OHDA; Peripheral lymphocytes; HPLC-ESI-QQQ
张镇松(1987-),男,硕士生,助理工程师,研究方向:生物化学与分子生物学。E-mail: zszhang@rcees.ac.cn
邓玉林(1962-),男,博士生,教授,研究方向:神经生物学。E-mail: deng@bit.edu.cn
R-33
A
1671-7856(2017) 12-0084-07
10.3969.j.issn.1671-7856. 2017.12.015
2017-04-12
