酸性微环境对舌鳞癌中单核/巨噬细胞表型影响的实验研究
2017-12-21宋宇峰冯红超
周 强 宋宇峰 冯红超
1.广东省清远市人民医院口腔科,广东清远 511518;2.贵州医科大学附属医院口腔科,贵州贵阳 550004;3.贵州省贵阳市口腔医院颌面外科,贵州贵阳 550002
酸性微环境对舌鳞癌中单核/巨噬细胞表型影响的实验研究
周 强1宋宇峰2冯红超3
1.广东省清远市人民医院口腔科,广东清远 511518;2.贵州医科大学附属医院口腔科,贵州贵阳 550004;3.贵州省贵阳市口腔医院颌面外科,贵州贵阳 550002
目的以舌鳞癌为研究对象,研究探讨肿瘤组织酸性微环境对单核/巨噬细胞的表型变化和功能的影响。方法采用密度梯度离心法从健康人的外周血分离单核/巨噬细胞;从中国科学院细胞库购买人舌鳞癌细胞株(Tca-8113),将两种细胞分别在酸性微环境(pH6.5/6.8/7.0)和常规环境下(pH7.2)单独及混合培养,以常规环境下培养作为对照,4h后ELISA检测细胞培养上清液中Arg和iNOS的水平变化。结果在酸性微环境下,单核/巨噬细胞单独培养和与舌鳞癌细胞混合培养的iNOS分泌明显减少和Arg分泌明显增加,均高于常规环境下单核/巨噬细胞单独培养和与舌鳞癌细胞混合培养,两者差异有统计学意义(P<0.05);在酸性微环境及常规环境中,舌鳞癌细胞单独培养上清液中,Arg和iNOS无明显变化,两者差异无统计学意义(P>0.05)。结论舌鳞癌酸性微环境中单核/巨噬细胞的表型偏向于M2型,即单核/巨噬细胞在舌癌酸性环境中可能通过自身表型的变化,分泌细胞因子下调免疫应答,参与了肿瘤的的生长、侵袭和转移等。
单核/巨噬细胞;口腔鳞状细胞癌;酸性微环境;表型鉴定
研究表明肿瘤相关巨噬细胞(tumor-associated macrophages,TAMs)参与了肿瘤发生、生长、侵袭和转移的过程,活化的巨噬细胞在免疫应答中也发挥重要作用[1]。舌鳞癌是发生在口腔黏膜的最常见的恶性肿瘤,浸润于其中的巨噬细胞,在体内外不同的微环境影响下,表现出明显的功能差异[2-3]。本实验通过体外模拟舌鳞癌组织中的酸性微环境及正常环境,检测其中Arg和iNos的水平变化来研究肿瘤组织酸性微环境对单核/巨噬细胞的表型变化和功能的影响。
1 材料与方法
1.1 一般材料
主要试剂:人淋巴细胞分离液(天津市灏阳生物制品科技有限责任公司);2%明胶溶液;5mmol/L EDTA;人iNOS及Arg ELISA试剂盒(上海西唐生物科技有限公司产品);鼠抗人CD14单克隆抗体(上海雷浩)、PBS液(武汉博士德公司);Hanks液,台盘兰染色液、25mL培养瓶;双抗(青霉素100μg/mL,链霉素100μg/mL);重组人粒-巨噬细胞集落刺激因子rhGM-CSF(peprotech公司);胎牛血清(杭州四季青生物工程材料有限公司);DMEM培养液;胰酶等。
主要设备:苏净超净工作台、流式细胞仪(FACS)、恒温培养箱、低温台式水平离心机、Nikon倒置显微镜、酶标仪(美国通用公司)、5%CO2培养箱、PB203-N电子天平、水式恒温箱、烤箱等。细胞:人舌鳞癌细胞株Tca-8113(购自中国科学院细胞库),健康人新鲜外周抗凝血。
1.2 试验方法
1.2.1 外周血单核/巨噬细胞的提取 (1)采用梯度密度离心法,抽取人抗凝外周血50mL,用3~4倍hanks液稀释并混匀;(2)取16个15mL离心管,每管加入人淋巴细胞分离液5mL。将稀释的血液9mL轻轻加到装有人淋巴细胞分离液的离心管上,注意不要破坏两者之间的界面;(3)低温水平离心机20℃,390g,离心20min可见在血浆与淋巴细胞分离液之间有一圈环形的白膜层(如下图),此为大量的单个核细胞(PBMCs)。将各管白膜层吸出至另外一试管;(4)将吸取的白膜层,用5倍的PBS液稀释,390g,离心10min洗去多余的淋巴细胞分离液;(5)再用 PBS液稀释,800r/min,离心 10min,重复两次,尽量洗去血小板;(6)用含20%胎牛血清的DMEM培养液将细胞混悬,置六孔板中37℃、5%CO2细胞培养箱孵育贴壁3h后,用预热的细胞培养液洗去未粘附细胞,悬浮细胞可重复粘附,得到更多的贴壁细胞。(7)加入含20%胎牛血清的DMEM培养液约2mL及rhGM-CSF(终浓度为1000U/mL),隔两天半换液,培养7d得到贴壁细胞。
1.2.2 单核/巨噬细胞的鉴定 用抗CD14单克隆抗体分析悬液中的细胞,单核/巨噬细胞定义为CD14阳性细胞:(1)取上述培养的单核/巨噬细胞悬液,1000rpm离心5min。弃掉上清,加入2mmol/L EDTA(以减少分析中细胞的粘附);(2)取上述细胞悬液100μL加入5mL流式管底;(3)取10μL CD14标记抗体加入流式管底与细胞悬液混匀,室温避光孵育30min;(4)加入2mL PBS重悬细胞,以1000rpm离心5min,弃掉上清。上流式细胞仪(FACS)检测。结果CD14阳细胞占87.7%,足以满足实验需要。
1.2.3 人舌鳞癌细胞悬液的制备 将所购冻存的Tca-8113细胞复苏,加入pH为7.2的20%胎牛血清的DMEM培养液3mL在37℃、饱和湿度、5%CO2培养箱中培养并传代获得大量口腔癌细胞贴壁,弃去培养液,加入3~5滴0.25%EDTA胰酶放入37℃培养箱中1~3min,见贴壁细胞脱落,细胞由贴壁梭形变成椭圆形,以5mL 20%胎牛血清的DMEM培养液中和并混匀,1500转/离心5min,留取沉淀细胞,20%胎牛血清的DMEM培养液重悬细胞,进行细胞计数。调整细胞数为1×106个/mL。
1.2.4 实验分组并在37℃、饱和湿度、5% CO2培养箱中培养 A组:每孔加入重悬的单核/巨噬细胞1mL(细胞浓度为106个/mL)及相应PH值细胞培养液1mL,使每孔单核/巨噬细胞的细胞浓度为 0.5×106个 /mL,在 pH 值 为 6.5、6.8、7.0、7.2 下进行培养。B组:每孔加入重悬的舌鳞癌细胞1mL(细胞浓度为106个/mL)及相应pH值细胞培养液1mL,使每孔舌癌细胞的细胞浓度为0.5×106个/mL,在pH值为 6.5、6.8、7.0、7.2下进行培养。C组:每孔加入重悬单核巨噬细胞1mL(细胞浓度为106个/mL)和舌鳞癌细胞1mL(细胞浓度为1×106个/mL),使每孔单核/巨噬细胞的细胞浓度为0.5×106个/mL,在pH值为6.5、6.8、7.0、7.2下混合培养。以上样本放置37℃、5%CO2培养箱中培养4h,离心收集上清液,采用ELISA法检测iNOS和Arg的含量。
1.2.5 ELISA法测定上清液中的iNOS的水平变化 采用人iNOS的ELISA试剂盒进行,操作步骤严格按照说明书进行。具体操作步骤如下:(1)标准浓度配制:40ng/瓶标准品中,加入1mL已高压消毒过的去离子水,混匀,配成浓度40ng/mL的溶液。设标准管8管,第一管加入900μL标本稀释液,第二至第八管加入标本稀释液500μL再在第1管中加入100μL 40ng/mL的标准品溶液,混匀后用加样器吸出吸出500μL,移至第2管中,再次混匀,如此反复做对倍稀释,到第7管中吸出500μL弃去,第8管为空白对照;(2)10X标本稀释液用去离子水作1:10倍稀释;(3)洗涤液:用去离子水1:20稀释;(4)加样:每孔各加入待测样品100μL;每例检测样品设6个复孔。将反应板充分混匀后置37℃ 120min;(5)洗板:用洗涤液将反应板充分洗涤4~6次,向滤纸上印干;(6)每孔加入第一抗体工作液100μL,将反应板充分混匀后置37℃60min;(7)洗板:同前;(8)每孔加酶标抗体工作液100μL;将反应板充分混匀后置37℃30min;(9)洗板:同前;(10)每孔加入底物工作液100μL,置37℃暗处反应15min;(11)每孔加入100μL终止液混匀;(12)30min内在波长450nm处测吸光值。
1.2.6 ELISA法测定上清液中的Arg的水平变化 收集细胞培养上清标本稀释液做1∶10稀释,配制标准浓度,10X标本稀释液以及洗涤液,常规加样,洗板,每孔加入第一抗体工作液100μL,充分混匀,37℃静置1h,再次洗板,每孔加酶标抗体工作液100μL,充分混匀,37℃静置1h,再次洗板,每孔加入底物工作液100μL,37℃暗处静置15min,每孔加入100μL终止液混匀,在30min内在波长450mm处检测吸光值。
1.3 统计学处理
本研究采用SPSS13.0统计软件进行统计学分析。培养上清液中的iNOS和Arg含量以()表示,采用配对t检验,P<0.05为差异有统计学意义。
2 结果
2.1 获取的单核/巨噬细胞流式细胞
分离的单核/巨噬细胞,重复四次,经流式细胞仪鉴定CD14阳性为87.7%,满足实验需要,见图1。
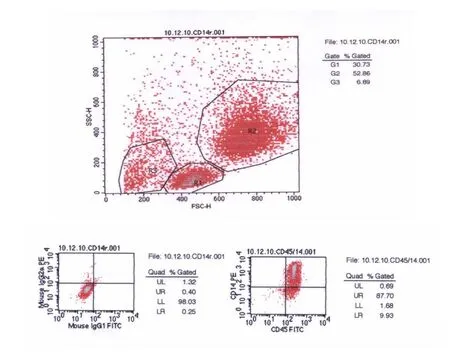
图1 流式细胞仪检测单核/巨噬细胞比例
2.2 人舌鳞癌细Tca-8113
舌癌细胞经过复苏,传代3次后置于倒置显微镜下观察,见Tca-8113细胞多角形,体积大,长满时呈铺路石状,细胞核大或双核,几乎占据整个细胞,核浆比例增大,见图2。
2.3 ELISA法检测iNOS的含量
根据酶标仪软件计算出各例标本iNOS含量均值,其中混合组各个pH值所测含量均大于单核/巨噬细胞和舌癌细胞组含量差异有统计学意义(P<0.05)。见表1、图3。
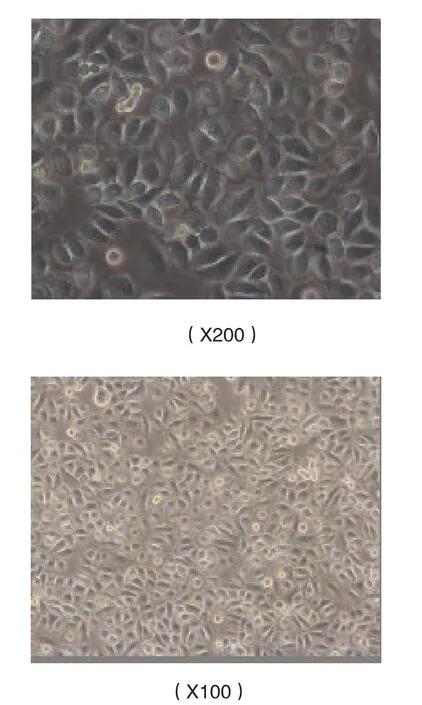
图2 培养的舌癌细胞
表1 不同pH值下细胞培养液中的NOS含量(± s,pg/mL)
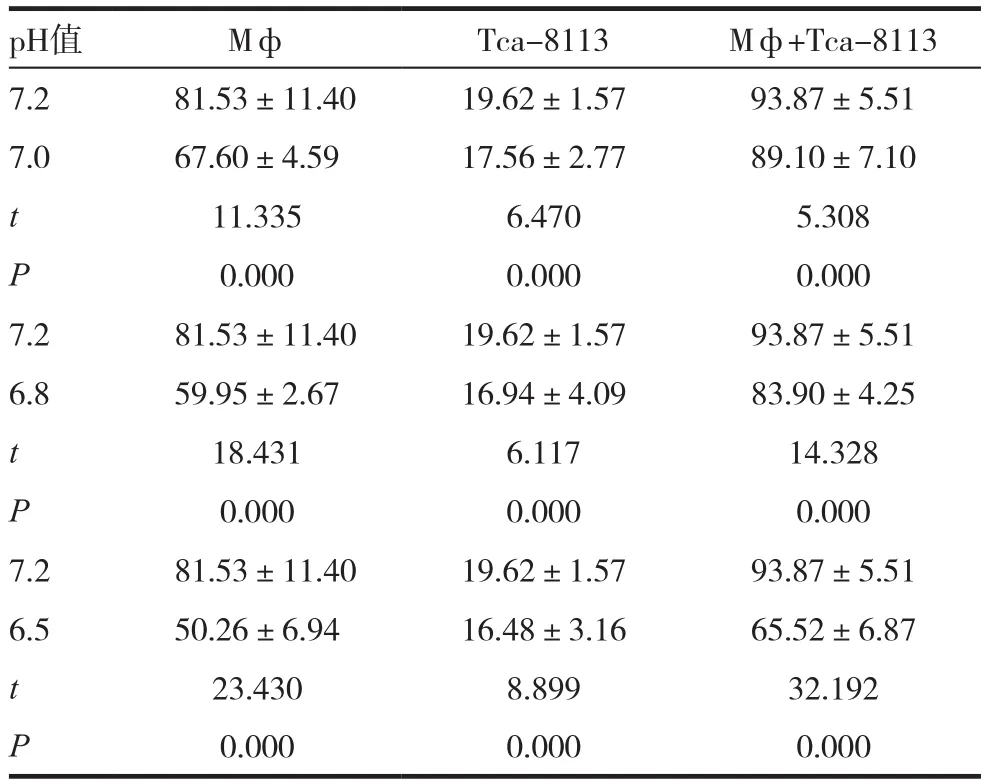
表1 不同pH值下细胞培养液中的NOS含量(± s,pg/mL)
注:Mф代表单核/巨噬细胞培养组,Tca-8113代表人舌鳞癌细胞培养组,Mф+Tca-8113为混合培养组
pH值 Mф Tca-8113 Mф+Tca-8113 7.2 81.53±11.40 19.62±1.57 93.87±5.51 7.0 67.60±4.59 17.56±2.77 89.10±7.10 t 11.335 6.470 5.308 P 0.000 0.000 0.000 7.2 81.53±11.40 19.62±1.57 93.87±5.51 6.8 59.95±2.67 16.94±4.09 83.90±4.25 t 18.431 6.117 14.328 P 0.000 0.000 0.000 7.2 81.53±11.40 19.62±1.57 93.87±5.51 6.5 50.26±6.94 16.48±3.16 65.52±6.87 t 23.430 8.899 32.192 P 0.000 0.000 0.000
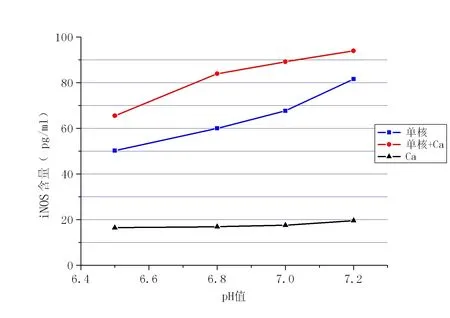
图3 不同pH值下细胞培养液中的iNOS的平均含量
2.4 ELISA法检测Arg的含量
根据酶标仪软件计算出各例标本Arg含量均值,其中混合组各个pH值所测含量均大于单核/巨噬细胞和舌癌细胞组含量差异有统计学意义(P<0.05)。见表2。
表2 ELLISA检测不同pH值下细胞培养上清液中的Arg的表达水平(± s,pg/mL)
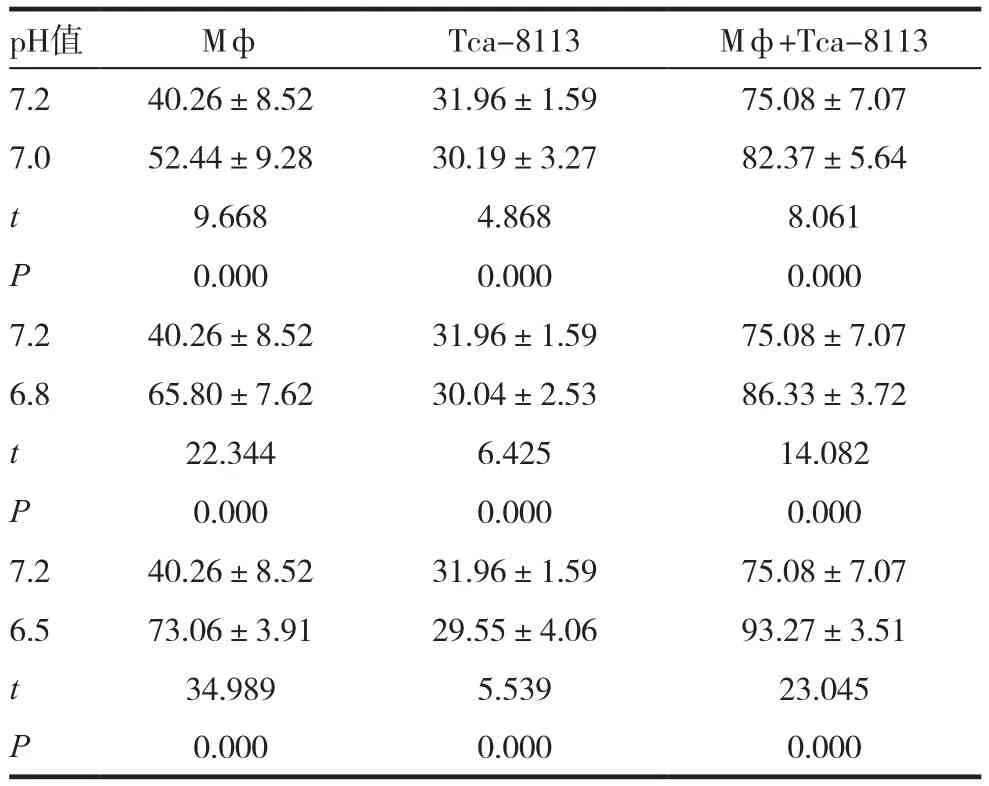
表2 ELLISA检测不同pH值下细胞培养上清液中的Arg的表达水平(± s,pg/mL)
pH值 Mф Tca-8113 Mф+Tca-8113 7.2 40.26±8.52 31.96±1.59 75.08±7.07 7.0 52.44±9.28 30.19±3.27 82.37±5.64 t 9.668 4.868 8.061 P 0.000 0.000 0.000 7.2 40.26±8.52 31.96±1.59 75.08±7.07 6.8 65.80±7.62 30.04±2.53 86.33±3.72 t 22.344 6.425 14.082 P 0.000 0.000 0.000 7.2 40.26±8.52 31.96±1.59 75.08±7.07 6.5 73.06±3.91 29.55±4.06 93.27±3.51 t 34.989 5.539 23.045 P 0.000 0.000 0.000
3 讨论
肿瘤是当前医学研究领域的热点及难点之一。其中口腔鳞状细胞癌占口腔颌面部恶性肿瘤的90%以上,是发病率和病死率较高的恶性肿瘤之一[4-7]。有资料表明,由于肿瘤细胞无限增殖,需要不停地塑造一个适于自己生长的外部组织环境,但是肿瘤细胞塑造的外部组织环境永远满足不了肿瘤细胞生长的需要,所以出现组织缺氧和酸中毒、间质高压形成、大量生长因子和蛋白水解酶的产生及免疫炎性反应等[8-10]。随着肿瘤进展,局部的营养条件已不能满足肿瘤生长的需求,这时肿瘤细胞可以通过诱导血管、淋巴管生成等途径不断构建新的营养代谢网路,同时也促进了肿瘤细胞的生长和转移[4]。
巨噬细胞作为先天免疫系统的重要组成部分,在清除衰老和感染细胞、机体损伤后的组织重塑中起重要作用[11-13]。在机体不同生理和疾病状态下,巨噬细胞表现出不同的类型,通过表型分析鉴定巨噬细胞类型已成为研究巨噬细胞功能多样性的主要方法[14-17]。经研究发现发现: IL-12的分泌、iNOS表达和活性以及膜蛋白CD16/32的表达可用于鉴定M1型巨噬细胞;而Arg-1表达和活性、CD206以及DECTIN-1的表达,是鉴定M2型巨噬细胞较为理想的表型指标[18-19]。
综上所述,此次实验结果表明肿瘤酸性环境中肿瘤相关巨噬细胞(TAM)倾向于M2型。即单核/巨噬细胞在舌癌酸性环境中M1型表达减弱,M2型表达增强。此消彼长使得TAMs下调免疫应答,更多参与了肿瘤的生长、侵袭和转移。作为巨噬细胞极化的重要标志,精氨酸酶Ⅰ和iNOS相互竞争底物精氨酸,产生不同代谢物并对巨噬细胞的功能起着重要作用。不同的细胞因子通过其特异受体可激活不同的信号通路和转录因子,从而决定巨噬细胞的极化方向和功能。若巨噬细胞通过一系列信号通路活化M1相关转录因子,激活M1相关基因表达,则向M1型巨噬细胞转化。对于M1型巨噬细胞的重要标志之一iNOS来说,转录因子NF-kB及STATl结合并激活iNOS的启动子区是调控其表达的关键步骤。若巨噬细胞通过一系列信号通路激活了M2相关的转录因子表达,则向M2型巨噬细胞活化,而其重要的标志之一精氨酸酶I则主要受STAT6和c/EBPβ调控。此次实验只是从体外模拟了舌鳞癌微环境中酸性的方面,肿瘤微环境是一个动态的过程,机制复杂,有待于我们更多的探讨。
[1] Louboutin JP,Strayer DS.Relationship between the chemokine receptor CCR5 and microglia in neurological disorders:Consequences of targeting CCR5 on neuroinflammation,neuronal death and regeneration in a model of epilepsy[J].CNS Neurol Disord Drug Targets,2013,12(6):815-829.
[2] Rodriguez-Lara V,Ignacio GS,Cerbón Cervantes MA.Estrogen induces CXCR4 overexpression and CXCR4/CXL12 pathway activation in lung adenocarcinoma cells in vitro[J].Endocr Res,2017,20:1-13.
[3] Yamashita S,Sakurai R,Hishiki K,et al.Effects of dietary plant-origin glucosylceramide on colon cytokine contents in DMH-treated mice[J].J Oleo Sci,2017,66(2):157-160.
[4] JOHANNSEN H,NOLAN S,et al.Design and analysis of a squamous cell carcinoma in vitro,model system[J].Biomaterials,2013,34(30):7401-7407.
[5] 何昌玉.miRNA 在肿瘤治疗中的研究进展[J].外科理论与实践,2014,19(4):365-368.
[6] Hosseinian N,Cho Y,Lockey RF,et al.The role of theNLRP3 inflammasome in pulmonary diseases[J].Ther AdvRespir Dis,2015,9(4):188-197.
[7] King TE,Bradford WZ,Castro-Bernardini S,et al.A phase 3 trial of pirfenidone in patients with idiopathic pulmonary fibrosis[J].N Engl J Med,2014,370(22):2083-2092.
[8] Chambers DC.Nintedanib for idiopathic pulmonary fibrosis:An Asian perspective [J].Respirology,2016,21(8):1342-1343.
[9] Rogliani P,Calzetta L,Cavalli F,et al.Pirfenidone,nintedanib and N-acetylcysteine for the treatment of idiopathic pulmonary fibrosis:A systematic review and metaanalysis[J].Pulm Pharmacol Ther,2016,40:95-103.
[10] 吴棪,陈乔尔.肿瘤免疫逃逸的相关分子及其作用机制研究 [J].安徽医药,2016,20(4):621-625.
[11] 潘桃,刘杞,孙航,等.调节性T细胞在肝再生增强因子免疫抑制机制中的作用研究[J].第三军医大学学报,2014,36(11):1194-1198.
[12] 阎永贞,那可,魏晓东,等.肿瘤免疫逃逸机制的研究进展 [J].复旦学报(医学版),2013,40(5):619-624.
[13] 梁雪,陈祥彬,李广平.肿瘤免疫逃逸机制研究进展[J].生命的化学,2015,35(4):504-508.
[14] Yang F,Wei Y,Cai Z,et al.Activated cytotoxic lymphocytes promote tumor progression by increasing the ability of 3LL tumor cells to mediate MDSC chemoattraction via Fas signaling[J].Cell Mol Immunol,2015,12(1):66-76.
[15] 刘贤奎,孔垂泽,王平,等.膀胱癌肿瘤血管生成与肿瘤细胞增值与凋亡的关系[J].中国医科大学学报,2004,33(5):438-439.
[16] Zhao H,Chen W,Du P,et al.Fas L-844T/C and Fas-1377G/A:mutations of pulmonary adenocarcinoma in South China and their clinical significances[J].Tumour Biol,2015,36(6):4319-4326.
[17] Yu X,Li Y,Yu Y,et al.Associations between FAS rs2234767and FASLrs763110 polymorphisms and the risk of lung cancer:a meta analysis of 39,736 subjects[J].Onco Targets Ther,2016,9:2049-2056.
[18] Lin Y,Liu L,Zhang T,et al.Functional investigation of fas ligand expressions in human non-small cell lung cancer cells and its clin-cial implications[J].Ann Thorac Surg,2013,95(2):412-418.
[19] Hu JZ,Huang JH,Zeng L,et al.Anti-apoptotic effect of microR-NA-21 after contusion spinal cord injury in rats[J].J Neurotrau-ma,2013,30(15):1349-6130.
Effect of acidic microenvironment on the phenotype of monocyte/ macrophage in tongue squamous cell carcinoma
ZHOU Qiang1SONG Yufeng2FENG Hongchao3
1.Department of Stomatology, Qingyuan People's Hospital, Qingyuan 511518,China; 2.Department of Stomatology, Affiliated Hospital of Guizhou Medical University, Guiyang 550004; 3. Maxillofacial Surgery, Stomatological Hospital of Guiyang City,Guiyang 550002, China
ObjectiveTo investigate the effect of acidic microenvironment on the phenotype and function of monocytes/macrophages in tongue squamous cell carcinoma(NPC).MethodsMononuclear cells/macrophages were isolated from peripheral blood of healthy subjects by density gradient centrifugation; Human tongue squamous cell carcinoma cell line(Tca-8113) were purchased from cell bank of Chinese Academy of Sciences. The two kinds of cells were cultured separately in acid microenvironment(pH 6.5/6.8/7.0) and conventional environment(pH 7.2). The changes of Arg and iNOS in the supernatant of the cultured cells were detected by ELISA after 4H.ResultsIn acidic microenvironment, the secretion of iNOS was significantly decreased and the secretion of Arg was increased significantly in monocytes/macrophages cultured alone and iNOS culture mixed with squamous cell carcinoma of the tongue, they were Higher than those in the conventional environment(P<0.05), there were significant difference between two groups; In acidic microenvironment and conventional environment, Arg and iNOS in the supernatant of tongue squamous cell carcinoma cells were not significantly changed(P>0.05), and there was no significant difference between them.Conclusionthe phenotype of monocytes/macrophages in the acidic microenvironment of tongue squamous cell carcinoma tends to be type M2, that is, monocytes/macrophages may secrete cytokines in the acidic environment of tongue squamous cell carcinoma, which may downregulate the immune response and participate in the growth, invasion and metastasis of tumor.
Monocyte/macrophage; Oral squamous cell carcinoma; Acidic microenvironment; Phenotype identification
R739.8
A
2095-0616(2017)23-29-05
2017-08-14)
