黄连多糖中单糖组成的HPLC-MSn法快速识别
2017-12-20张亚丽苗祥贞刘永刚
张亚丽 高 简 苗祥贞 张 潇 刘永刚 谭 鹏
(北京中医药大学中药学院,北京,100102)
黄连多糖中单糖组成的HPLC-MSn法快速识别
张亚丽 高 简 苗祥贞 张 潇 刘永刚 谭 鹏
(北京中医药大学中药学院,北京,100102)
目的:探讨采用HPLC-MSn法快速识别黄连多糖中的单糖组成。方法:黄连药材经过提取、分离、除蛋白、除色素,最终得到黄连多糖,用2 mol/L的三氟乙酸水解黄连多糖,以1-苯基-3-甲基-5-吡唑啉酮(PMP)作单糖衍生化试剂,利用HPLC-MSn识别黄连中单糖的组成,并解析其衍生物的裂解规律。结果:通过分析,得到的黄连多糖中含有甘露糖、核糖、鼠李糖、半乳糖醛酸、葡萄糖、半乳糖、阿拉伯糖/木糖、岩藻糖,其中核糖、岩藻糖为首次在黄连多糖中报道的单糖。结论:HPLC-MSn法对中药多糖组分中的单糖成分进行分析具有重要的指导意义。
黄连多糖;PMP;单糖;HPLC-MSn
黄连来源于毛茛科植物云连Coptis.teetaWall.、黄连C.chinensisFranch.和三角叶黄连C.deltoideaC.Y.ChengetHsiao的干燥根茎[1],在中医临床上常用于清热燥湿,泻火解毒的病症[2]。我国黄连资源丰富,并且其临床应用广泛,效果显著,千年来受到中医的青睐,但黄连的化学成分复杂,其中许多成分,如小檗碱、黄连碱等具有很强的生理和药理活性[3-11]。
黄连中含有大量的小檗碱类成分[12],其化学和药理方面是目前研究最为广泛的一类[13-23],但对黄连中的多糖类成分研究甚少[24-29]。吕秀梅等采用Box-Behnken设计-效应面法优选出黄连中黄连多糖的提取工艺条件;姜爽等[30]探讨了黄连多糖的最佳提取工艺及其体外抗氧化作用,证明了黄连多糖对超氧阴离子自由基、羟自由基和DPPH自由基均有一定的清除作用;吴玉娟等、王伟等[31]对黄连多糖进行提取,并检测了黄连多糖的抗氧化活性,均证明了黄连多糖作为抗氧化剂,具有较好的清除自由基的作用;熊雄等分离了黄连多糖成分,并研究黄连多糖及黄连水提液的降糖作用及机制,实验结果表明黄连多糖具有一定的降血糖活性,且其活性较水提液好;尹登科等[32]通过实验证明黄连多糖可通过抑制RAGE表达,从而降低AGEs对内皮细胞的激活作用。
黄连多糖已被证明有较好的活性,且多糖是在自然界中广泛存在的化合物,其单糖成分的确定是控制多糖标准的关键。Honda等[33]于1989年首次使用1-苯基-3-甲基-5-吡唑啉酮(PMP)对还原性单糖进行LC分析;在此之后Wang等[34]采用PMP-HPLC-MSn,对鲍鱼性腺多糖中的成分进行了分析;Wu等[35]用HPLC/ESI-MS技术,对水解后的羊栖菜多糖衍生化反应,对其中的单糖成分的分析也得到了较好的效果。本研究针对黄连多糖中的单糖类成分进行分析,并首次采用HPLC-MSn法,根据单糖衍生化裂解规律确定黄连多糖中单糖成分的组成。
1 仪器与试药
1.1 仪器 Thermo Scientific LTQ-Orbitrap线性离子阱串联静电轨道场高分辨质谱,美国Thermo-Fisher公司;LC-20AT岛津高效液相色谱仪,日本岛津公司;2862H UV/VIS SPETRO photometer,尤尼科上海仪器有限公司;SHZ-D(III)循环水式多用真空泵,巩义市予华仪器有限公司;RE-52A旋转蒸发仪,上海亚荣生化仪器厂;电子天平PL2002,梅特勒-托利多仪器(上海)有限公司。
1.2 试剂 甲醇、乙腈(色谱纯),美国Fisher Scientific;D-101大孔树脂购自上海源叶生物科技有限公司所;1-苯基-3-甲基-5-吡唑啉酮(PMP)、三氟乙酸(TFA)等均为分析纯;水为高纯水。
1.3 分析样品 黄连购自北京三和药业有限公司,经北京中医药大学中药鉴定系教授鉴定为毛茛科植物黄连(RhizomaCoptidis)的干燥根茎,本文中的黄连多糖即用此中药提取而得;D-半乳糖(Gal,AJ0603LA14)、D-甘露糖(Man,A16O6L4546)、L-鼠李糖(Rha,SJ0715GA13)、D-木糖(Xyl,JA412RA13)、D-葡萄糖(Glu,140648-200602)、D-阿拉伯糖(Ara,AJ0702FA14)、L-岩藻糖(Fuc,TM0312QB14)购自上海源叶生物科技有限公司所。
2 方法与结果
2.1 色谱条件 色谱条件:Agilent ZORBAX SB-C18色谱柱(250×4.6 mm);流动相:20 mmol/L醋酸铵(每100 mL加入1 mL冰醋酸)-乙腈(85∶15,v/v);柱温:室温;流速:1.0 mL/min;检测波长:254 nm;进样量:20 μL。
质谱条件:雾化电压4.0 kV;管状透镜电压110 V;鞘气流量30 L/min;毛细管温度350 ℃;辅助器流量10 L/min;负离子模式全扫描。分辨力R设为30 000,二级和三级质谱采用数据依赖性扫描,选取上一级丰度最高的3个峰进行CID碎片扫描,以离子阱检测碎片离子。
2.2 对照品溶液的制备 分别称取甘露糖、半乳糖、葡萄糖各1.80 mg,鼠李糖、岩藻糖各1.64 mg,阿拉伯糖、木糖各1.50 mg,定容于10 mL氨水中。取氨水溶液500 μL于具塞试管中,加入0.5 mol/L的PMP甲醇溶液500 μL,超声溶解,置于70 ℃水浴中加热30 min。取出冷却至室温后加入10%的冰醋酸进行中和,再加入1 mL的三氯甲烷,充分震摇、静置,离心,弃去氯仿层,重复3次以除去未反应的衍生化试剂PMP,将所得上清液进行HPLC-MSn分析。
2.3 供试品溶液的制备 将干燥的黄连药材粗粉100 g,先用10倍量的丙酮进行脱脂,加热回流1 h,再用10倍量水煎煮2次,2 h/次,离心10 min(4 000 r/min),合并滤液,浓缩至200 mL,加入95%乙醇,使乙醇浓度达到80%,4 ℃静置24 h,抽滤得草乌粗多糖沉淀,依次用丙酮、乙醇洗涤后得沉淀。
沉淀加适量水复溶,加入等量的sevage试剂(三氯甲烷:正丁醇4∶1)混合,充分震荡,离心,取最上层水液,重复上述步骤数次,直至离心时中间层无蛋白出现,合并水层,同样的醇沉方法,4 ℃放置24 h后抽滤,得沉淀。取适量用95%乙醇浸泡过夜的大孔树脂装层析柱,用少量蒸馏水溶解黄连多糖沉淀,蒸馏水洗脱,用α-奈酚反应检测流出液体至无紫色环生成,合并洗脱液用乙醇再次沉淀,抽滤,沉淀放烘箱中烘干。
精密称取多糖样品20 mg于具塞中试管中,加入2 mol/L的TFA 2 mL,密封,沸水浴加热水解8 h后,冷却至室温,离心,水浴挥干TFA,然后加入氨水溶解并定容至5 mL容量瓶,取500 μL,按2.2中方法进行PMP衍生化操作,得供试品溶液,进行HPLC-MSn分析。
2.4 样品测定结果
2.4.1 单糖对照品衍生化裂解规律 由图1的单糖对照品总离子流图可以看出利用液相色谱结合高分辨质谱技术,且在负离子模式下单糖衍生物能够获得较高的响应值,说明了该方法适合于衍生化后单糖的分析。通过观察负离子模式下PMP标记的单糖标准品质谱数据(见表1、图2)发现单糖衍生物均显示出强烈的分子离子峰[M-H]-;而二级碎片离子峰则出现相同的碎片离子[M-PMP-H]-,推断二级断裂应为单糖衍生物掉落一分子PMP的结果;三级碎片离子均出现了强峰m/z 215,且推断m/z 215碎片离子的生成可能是C2—C3键断裂的结果,具有一致的裂解规律。具体裂解过程以葡萄糖衍生物为例见图3。从单糖标准品衍生物总离子流图可以看出保留时间为52 min时,仅有一个峰,但其峰端并没有呈现尖状,可能是由于阿拉伯糖和木糖极性较为相近,导致2个单糖衍生物不能很好的分开。
2.4.2 黄连多糖的单糖组成 通过对酸水解黄连多糖的衍生化产物总离子流图的各离子峰分析发现,在不同的保留时间处,出现了8个与单糖裂解规律相同的离子峰(图4)。根据各个离子峰的质谱裂解数据,发现其二、三级碎片离子均与标准品一致,更加验证了上述推导的单糖裂解规律,因此可初步判定黄连多糖由8种成分组成。根据已有标准品对照,可以得出峰1、3、5、6、7、8分别为甘露糖(Man)、鼠李糖(Rha)、葡萄糖(Glu)、半乳糖(Gal)、阿拉伯糖(Ara)/木糖(Xyl)、岩藻糖(Fuc),进一步,依据现有参考文献[36-38]及各单糖保留时间(极性顺序),确定峰2、4分别为核糖(Rib)和半乳糖醛酸(Gal UA),其中核糖、岩藻糖为首次在黄连多糖中发现的单糖,葡萄糖为黄连多糖中的主要成分。见表2。

图1 PMP标记的单糖标准品在负离子模式下的总离子流

No.保留时间(min)MSMS2MS3分子量单糖(标品)126.05509.21335.13215.08180甘露糖232.74493.21319.13215.08164鼠李糖347.40509.21335.13215.08180葡萄糖449.24509.20335.12215.08180半乳糖552.29479.19305.11215.08150阿拉伯糖652.29479.19305.11215.08150木糖756.26493.21319.13215.08164岩藻糖
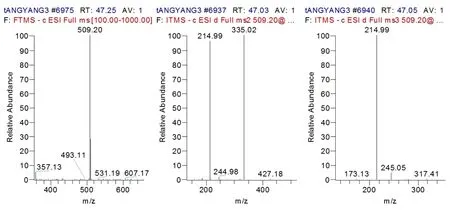
图2 负离子模式下PMP标记的葡萄糖标准品的MS1-3碎片离子
3 讨论
本实验采用PMP作为单糖的衍生化试剂,借助液质联用技术阐述了单糖与PMP衍生化过程的反应机理及裂解规律,从而根据标准品再依据质谱数据推断出黄连多糖中的单糖类成分,证明了该方法的可行性,并且首次从黄连多糖中鉴定出了核糖、岩藻糖,表明了糖类衍生物在所建立的质谱条件下呈现出专一性,且醛酸类和非醛酸类单糖均符合该裂解途径,为分析中药多糖的成分奠定了良好的基础。

表2 黄连多糖中单糖PMP衍生化产物的识别

图3 负离子模式下PMP标记的葡萄糖标准品衍生物的质谱裂解途径
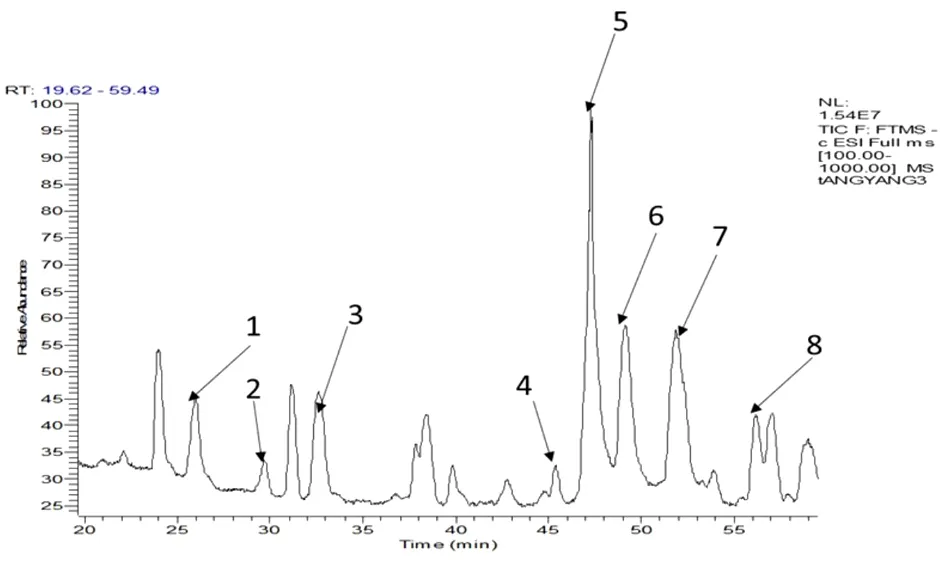
图4 负离子模式下黄连多糖中单糖衍生物总离子流
通过以上实验及数据分析,发现标准品阿拉伯糖和木糖衍生化产物在总离子流图上不能很好的分开,可能是由于二者结构、极性相近导致,黄连多糖样品成分分析中,发现在保留时间50~51 min出现一个尖峰,但不能确定其为阿拉伯糖或木糖,亦或二者都存在。将多糖酸水解,再对水解的多糖进行衍生化,利用液质联用技术对其衍生化物分析,能够准确的辨别其单糖组成,该方法准确、可靠,在医药、食品、生命科学等领域也可广泛应用。
[1]国家药典委员会.《中华人民共和国药典》2010版(一部)[M].北京:中国医药科技出版社,2010:285.
[2]王强.中药分析[M].北京:中国医药科技出版社,2005:306.
[3]王舒.中药黄连研究进展[J].亚太传统医药,2015,11(9):44-46.
[4]张月月,王君明,崔瑛,等.中药生物碱类成分抗焦虑或抑郁活性及黄连生物碱药理作用研究进展[J].中华中医药杂志,2015,30(4):1184-1187.
[5]鲁周南,包晓霞,薛晓鸥,等.黄连抗肿瘤临床运用及安全性评估研究进展[J].辽宁中医药大学学报,2017,19(1):131-133.
[6]陆瑞群,庞雅琴,庞广福.岩黄连的药理作用及临床应用研究进展[J].中国医药导报,2014,11(5):159-160,165.
[7]徐维相.探讨中药黄连的研究进展[J].世界最新医学信息文摘(连续型电子期刊),2016,16(22):13,12.
[8]尹丽丽.黄连的药理作用及现代研究进展[J].中医临床研究,2016,8(28):144-145.
[9]曲华,张莹,冒慧敏,等.黄连及其提取物治疗心血管疾病的临床研究进展[J].中医药导报,2016,22(6):103-106.
[10]赖先荣,周邦华,杜明胜,等.6种黄连饮片中6种生物碱的RP-HPLC含量测定及与“治消渴”药效学的谱-效关系分析[J].中国中药杂志,2016,42(24):4579-4586.
[11]王婷婷,钟凌云.姜制黄连炮制近年来研究进展[J].时珍国医国药,2016,27(2):427-429.
[12]卿大双,罗维早,孙建彬,等.一测多评法测定黄连及其炮制品中6种生物碱[J].中草药,2016,42(2):324-329.
[13]刘丹,曹广尚,司席席,等.黄连中生物碱类成分抗心律失常研究概述[J].山东中医杂志,2017,36(2):164-166,171.
[14]黄程程,孙磊,张泽辉,等.中药有效成分对细菌溶血素的抑制作用[J].中国畜牧兽医,2016,43(12):3363-3367.
[15]王利红,唐文照,辛义周.黄连中生物碱成分及药理作用研究进展[J].山东中医药大学学报,2015,39(4):389-392.
[16]刘卫霞,尤凯,孙燕.黄连解毒汤化学成分及临床应用的研究进展[J].沈阳医学院学报,2015,17(2):121-124.
[17]常惠,吴效科.黄连素对PCOS治疗作用及相关机制研究进展[J].现代妇产科进展,2017,26(3):235-237.
[18]马聪颖,陈佳纬,卢长林.黄连素在心血管疾病应用的研究进展[J].中西医结合心血管病(连续型电子期刊),2016,4(31):37-39.
[19]王维琪.黄连有效成分的药理研究与进展[J].中医临床研究,2016,8(26):147-148.
[20]张青,李琰,陈磊.黄连素对2型糖尿病及其并发症的治疗作用及相关机制研究进展[J].中国中药杂志,2015,40(9):1660-1665.
[21]陈瑞,吴云,田维毅.黄连化学成分及其影响相关代谢途径的研究进展[J].湖南中医杂志,2016,32(4):190-192.
[22]孟芳,谭小武.黄连素诱导肿瘤细胞凋亡机制的研究进展[J].中国现代医药杂志,2016,18(4):99-102.
[23]孙宁阳,张宏川,顾健,等.葛根黄连组分毒理学研究[J].中药药理与临床,2017,33(1):95-98.
[24]Fan G,Tao LH,Yue QH,et al.Metabolic discrimination of rhizoma coptidis from different species using 1H NMR spectroscopy and principal component analysis[J].Planta Med,2012,78(6):641-648.
[25]Fan G,Zhang MY,Zhou XD,et al.Quality evaluation and species differentiation of Rhizoma coptidis by using proton nuclear magnetic resonance spectroscopy[J].Anal Chim Acta,2012,747:76-83.
[26]霍志鹏,王玉,周水平,等.黄连生物碱成分的HPLCDADMS分析[J].天津药学,2016,28(2):8-12.
[27]黄涛阳,王晖,翁燕君,等.电喷雾电离-串联质谱快速分析黄连解毒汤的化学成分[J].中药材,2017,40(1):119-121.
[28]李云,王炜,尹登科,等.黄连多糖不同组分抗氧化活性比较研究[J].安徽中医药大学学报,2015,34(1):66-69.
[29]李敏,金晶,叶新,等.黄连多糖抗蛋白质非酶糖基化活性初步研究[J].黑龙江大学自然科学学报,2014,31(2):223-227.
[30]姜爽,李璐,王星云,等.黄连多糖提取工艺的优化及其体外抗氧化作用[J].中成药,2016,38(6):1405-1407.
[31]王伟,刘世军,安法娥,等.黄连多糖提取、分离纯化鉴定及清除羟基自由基能力测定[J].山东医药,2013,53(10):79-82.
[32]尹登科,杨晔,陈松,等.黄连多糖对AGEs诱导内皮细胞增殖及其受体表达的作用研究[J].药物生物技术,2012,19(6):476-479.
[33]Honda S,Akao E,Suzuki S,et al.High-performance liquid chromatography of reducing carbohydrates as strongly ultraviolet-absorbing and electrochemically sensitive 1-phenyl-3-methyl-5-pyrazolone derivatives[J].Anal Biochem,1989,180(2):351-357.
[34]Wang HX,Zhao J,Li DM,et al.Structural investigation of a uronic acid-containing polysaccharide from abalone by graded acid hydrolysis followed by PMP-HPLC-MSnand NMR analysis[J].Carbohydr Res,2015,402:95-101.
[35]Wu X,Jiang W,Lu J,et al.Analysis of the monosaccharide composition of water-soluble polysaccharides from Sargassum fusiforme by high performance liquid chromatography/electrospray ionisation mass spectrometry[J].Food Chem,2014,145:976-983.
[36]Wang H,Zhao J,Li D,et al.Comparison of polysaccharides of Haliotis discus hannai and Volutharpa ampullacea perryi by PMP-HPLC-MS(n)analysis upon acid hydrolysis[J].Carbohydr Res,2015,415:48-53.
[37]赵宏,柴桂芳,王秋红,等.一种车前子多糖的分离纯化及单糖组成分析[J].中国实验方剂学杂志,2014,20(19):97-100.
[38]吕永磊,卜海博,杨蕾,等.乌头母根、子根、须根多糖的比较[J].中国中药杂志,2011,36(9):1154-1157.
MonosaccharideCompositionAnalysisofPolysaccharidesfromRhizomaCoptidisBasedonHPLC-MSn
Zhang Yali, Gao Jian, Miao Xiangzhen, Zhang Xiao, Liu Yonggang, Tan Peng
(SchoolofChineseMateriaMedica,BeijingUniversityofChineseMedicine,Beijing100102,China)
Objective:To explore a rapid identification of monosaccharide composition of polysaccharide from Rhizoma Coptidis through HPLC-MSn.MethodsAfter being extracted, separated, removed of protein and pigment, Rhizoma Coptidis polysaccharide was obtained from Rhizoma Coptidis. Polysaccharides of Rhizoma Coptidis was hydrolyzed with the TFA of 2 mol.L-1. 1-phenyl-3-methyl-5-pyrazolone (PMP) was used as derivatization reagent. And high performance liquid chromatography-mass spectrometry (HPLC-MSn) was used to identify the composition of monosaccharide, and the resolve fragmentation regularity of its derivatives was analyzed.ResultsThrough analysis, the monosaccharides of polysaccharides from Rhizoma Coptidis were mannose, ribose, rhamnose, galacturonic acid, glucose, galactose, arabinose/ xylose, fucose, among which ribose and fucose were the first reported monosaccharides that obtained from polysaccharide of Rhizoma Coptidis.ConclusionHPLC-MSnhas a guiding significance in analyzing the monosaccharide composition of polysaccharides from Chinese materia medica.
Rhizoma Coptidis polysaccharide; PMP; Monosaccharide; HPLC-MSn
青年科学基金项目(81102807)
张亚丽(1993.03—),女,硕士研究生,中药炮制学方向,E-mail:Ali857@163.com
谭鹏(1980.02—),男,博士,副教授,讲师,中药炮制研究,E-mail:tanpengtcm@163.com;刘永刚(1981.02—),男,博士,副教授,讲师,中药化学研究,E-mail:liuyg0228@163.com
R284
A
10.3969/j.issn.1673-7202.2017.11.053
(2016-12-28收稿 责任编辑:杨觉雄)
