克班宁长循环脂质体的包封率、体外释放和稳定性研究
2017-12-19刘娜王琪蕾陈凌云马云淑
刘娜+王琪蕾++陈凌云++马云淑


[摘要] 目的 研究克班宁长循环脂质体的包封率、体外释放和稳定性。 方法 建立高效液相色谱法测定长循环脂质体中克班宁的含量;分别采用葡聚糖凝胶柱层析法和超滤离心法分离未包封克班宁,并对包封率和载药量进行测定;采用透析法考察克班宁长循环纳米脂质体的体外释放行为;考察不同温度和光照贮存条件下克班宁长循环脂质体外观、粒径和泄漏率。 结果 采用葡萄糖凝胶柱层析法分离游离克班宁测得包封率为79.46%,采用超滤离心法测得包封率为81.02%,克班宁长循环脂质体载药量为5.6%;克班宁长循环脂质体体外释放规律拟合为Higuchi方程:y = 0.1419 x1/2+0.1475,R2值为0.9338;在40 d内克班宁长循环脂质体在避光4℃冷藏条件下贮存稳定。 结论 超滤离心法操作简单,重现性好,所制得的脂质体具有明显的缓释释放特征,需避光冷藏贮存。
[关键词] 葡聚糖凝胶柱层析法;超滤离心法;包封率;载药量;透析法
[中图分类号] R284.1 [文献标识码] A [文章编号] 1673-7210(2017)11(a)-0004-05
Study on entrapment efficiency, drug release in vitro and stability of Crebanine long circulating liposome
LIU Na WANG Qilei CHEN Lingyun MA Yunshu
Yunnan University of TCM, Yunnan Province, Kunming 650500, China
[Abstract] Objective To study the entrapment efficiency, drug release in vitro and stability of Crebanine long circulating liposome. Methods The concentration of Crebanine in long circulating liposome was determined by high performance liquid chromatography. The liposome and free Crebanine were separated by the sephadex gel column chromatography and the centrifugal ultrafiltration, the entrapment efficiency and drug loading were determined. The release behavior of the drug from liposome was studied by the dialysis method. The liposome appearance, particle size and leakage rate were studied by the effects of different temperature and light storage. Results The entrapment efficiency was 79.46% by the gel column chromatography and 81.02% by the centrifugal ultrafiltration. Crebanine long-circulating liposome drug loading was 5.6%; the Higuchi equation of Crebanine long-circulating liposome in vitro release was y = 0.1419 x1/2+ 0.1475, the R2 value was 0.9338; Crebanine long-circulating liposome was stabilized in the avoid light of 4℃ under refrigeration. Conclusion The centrifugal ultrafiltration is simple and reproducible. The prepared liposome is typical sustained-release, the liposome needs to be kept in cold storage.
[Key words] Sephadex gel column chromatography; Centrifugal ultrafiltration; Entrapment efficiency; Drug loading; Dialysis method
克班寧(Crebanine)分子量为339.38,分子式为C20H21NO4,属于阿朴菲类Aporphine(Ap)生物碱[1-2],研究表明其有显著的抗心律失常作用,但起效快,作用时间短,治疗窗窄,限制了克班宁的应用,将其制备成长循环脂质体,有望改变传递和释放方式,提高疗效,降低毒性。本研究建立了HPLC法测定脂质体中克班宁的含量;以包封率和载药量为评价指标,考察不同的分离方法;采用透析法考察脂质体的体外释放方式;进行稳定性研究,为克班宁长循环脂质体(Cre-LCL)质量标准研究提供依据。
1 仪器与试药
1.1 仪器
winner-801纳米激光粒度仪(济南微纳颗粒仪器股份有限公司);SK250HP超声清洗仪(上海科导超声仪器有限公司);RV28旋转蒸发仪(德国,艾卡);BT25S分析天平(赛多利斯科学仪器有限公司);WFZ-UV2000紫外分光光度计(龙尼柯仪器有限公司);层析柱(上海锦华层析设备厂);Agilent1100高效液相色谱仪(美国Agilent公司);迪马C18色谱柱(4.6 mm×250 mm,5 μm);透射电子显微镜(日本JEM-2001);迷你挤出器(Avanti公司mini-extruder);超滤离心管(德国默克Millipore);RCZ-1A型溶出实验仪(上海黄海药检仪器厂)等。endprint
1.2 试药
克班宁(自制,含量为98%);大豆磷脂(上海太伟药业有限公司,批号:20140202);胆固醇(上海伯奥生物科技,批号:130409);聚乙二醇2000(天津市大茂化学试剂厂,批号:20130617);硫酸铵(天津市大茂化学试剂厂,批号:20120302);氢氧化钠(天津市大茂化学试剂厂,批号:21040312);葡聚糖凝胶SephadexG-50(规格100~300 μm,Solarbio公司,批号:727A064);聚碳酸酯微孔滤膜(Whatman公司,批号:131135012E);透析袋(USA进口分装,截留分子质量10~14 kD,昆明宝信生物技术有公司);色谱甲醇(默克公司,批号:211670);纯水。其他试剂均为分析纯。
2 方法与结果
2.1 含量测定
建立HPLC法[3-4]测定Cre-LCL中克班宁的含量。
2.1.1 溶液制备
精密称取克班宁0.3 g置于100 mL容量瓶中,加甲醇超声溶解,并稀释至刻度,摇匀,作为对照品;取克班宁长循环脂质体1 mL置于10 mL容量瓶中,用甲醇超声溶解,并稀释至刻度,用微孔滤膜(0.45 μm)滤过,取续滤液,作为供试品;精密称取卵磷脂3.3 mg、胆固醇0.67 mg、聚乙二醇2000 1.1 mg置于10 mL容量瓶中,加甲醇超声溶解,并稀释至刻度,摇匀,即为空白脂质体,作为阴性对照品。
2.1.2 色谱条件
十八烷基硅烷键合硅胶为填充剂(4.6 mm×250 mm, 5 μm),流动相以甲醇-0.008%三乙胺水(75∶25);流速1.0 mL/min,柱温30℃,检测波长280 nm。
2.1.3 专属性
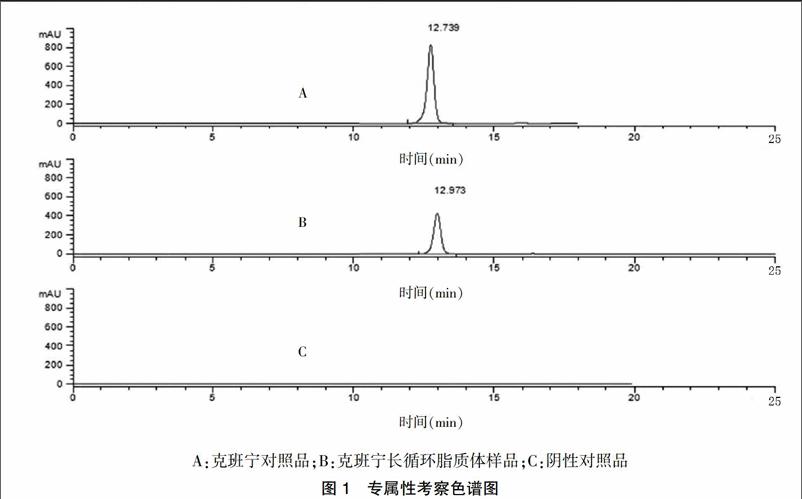
色谱图中(图1),样品中有1个色谱峰与克班宁标准品色谱峰的保留时间一致,阴性样品的色谱图中在与标准品相同保留时间(±5%)位置上没有吸收峰,分离度为9.1,理论塔板数大于5000,符合《中国药典》一部附录ⅥD高效液相色谱法(HPLC)项下规定,本法测定其含量灵敏度高,专属性强。
2.1.4 线性关系考察
取“2.1.1”下克班宁对照品适量,加甲醇稀释定容得到克班宁系列对照品溶液。分别精密吸取10 μL注入液相色谱仪,照“2.1.2”项下色谱条件测定峰面积,以峰面积(A)为纵坐标,进样量(C)为横坐标,绘制标准曲线,并计算回归方程。结果克班宁的回归方程为A = 37.168C-348.46(R = 0.9994),线性范围为0.06~1.8 mg/mL。
2.1.5 精密度
分别精密吸取“2.1.2”项下供试品溶液各10 μL,重复进样6次,测定峰面积,RSD为0.007 924%。
2.1.6 稳定性
取“2.1.2”项下供试品溶液,在0、2、4、6、8 h分别进样10 μL,测定峰面积,RSD为0.024 33%,克班宁溶液在8 h内稳定。
2.1.7 重复性
取批号140510克班宁长循环脂质体样品,按“2.1.1”项下供试品制备方法精密制备6份,分别进样10 μL测定含量,结果RSD为0.303%。
2.1.8 加样回收率
取“2.1.1”项下的对照品溶液精密量取3 mL分别用甲醇定容于10、50、100 mL的容量瓶中,配得高(881.1 μg/mL)、中(440.55 μg/mL)、低(88.11 μg/mL)克班宁对照溶液。分别取克班宁对照溶液高、中、低浓度各2 mL置于10 mL容量瓶中,再分别加入克班宁脂质体样品(2.807 mg/mL)3 mL于容量瓶,用甲醇定容,摇匀,经微孔滤膜(0.4 μm)过滤后再分别取10 μL注入液相色谱仪,照该品含量测定方法,测定含量,计算平均回收率为101.56%,RSD值为6.77%。见表1。
2.2 包封率测定
参考相关文献[5],结合自身实验条件,包封率测定选择了适用性强的凝胶柱法和超滤离心法进行比较。本研究分别采用葡聚糖凝胶柱层析法和超滤离心法[6]分离未包封克班宁,并对包封率和载药量进行测定[7-8]。
2.2.1 葡聚糖凝胶柱层析法
分别精密取1 mL Cre-LCL两份,一份加入50 mL容量瓶中,量取5 mL破膜剂,破坏磷脂双分子膜,用pH=7.4的磷酸盐缓冲液(PBS)溶液定容[9],经0.45 μm滤膜过滤后用“2.1”项下方法测得浓度C1;另一份加入葡聚糖凝胶(SephadexG-50)凝胶层析柱顶端,经层析柱分离,根据洗脱曲线收集[10]洗脱液前26 mL,置于50 mL容量瓶中,再加入5 mL破膜剂,摇匀,甲醇定容,经0.45 μm滤膜过滤后用“2.1”项下方法测得浓度C2。包封与未包封的的总药量W总=C1×V,包封的药量W包封=C2×V,包封率E%=W包封/W总×100%。
2.2.2 超滤法
2.2.2.1 超滤离心管截留量的选择 分别取10、30、100 kD截留量的超滤离心管,精密量取0.2158 mg/mL克班宁溶液10 mL,在4000 r/min下离心30 min,取滤液,0.45 μm滤膜滤过,取续滤液,HPLC法测峰面积,同时以测得0.2158 mg/mL克班宁溶液峰面积为分母,测定透过率。截留量为10、30、100 kD的透过率分别为66.02%、82.96%和95.54%。其中100 kD超滤离心管对克班宁透过率最高,10 kD和30 kD超滤膜上附着不同程度药物结晶,10 kD的最多。
2.2.2.2 离心时间的确定 分别精密量取0.2158 mg/mL克班宁溶液10 mL加入到100 kD超滤离心管中,4000 r/min分别离心30、60、90 min。取滤液,0.45 μm滤膜滤过,取续滤液,HPLC法测得峰面积,同时以测得0.2158 mg/mL克班宁溶液峰面积为分母,测定透过率。离心30、60、90 min的透过率分别为95.45%、97.60%、98.02%。最终确定超滤离心时间为60 min。60 min的透過率较30 min高,而90 min的透过率较60 min的高,但由于离心时间过长会产热,温度升高影响药物脂质体稳定性,综合考察后确定离心时间为60 min。endprint
2.2.2.3 超滤法测定包封率 分别精密量取1 mL Cre-LCL两份,一份加入10 mL容量瓶中,量取1 mL破膜剂,破坏磷脂双分子膜,用pH=7.4的PBS溶液定容,经0.45 μm滤膜过滤后用“2.1”项下方法测得浓度C1。另一份置于10mL容量瓶,用pH=7.4的PBS溶液定容,然后放于截留分子量100 kD超滤离心管中,在常温下4000 r/min离心1 h,取超滤液经0.45 μm过滤后进样,用“2.1”项下方法测得浓度C2。包封与未包封的的总药量W总=C1×V,游离的药量W游离=C2×V,包封率E% =(1-W游离/W总)×100%。
2.2.3 包封率测定结果
取同一份样品分别按照“2.2.1”和“2.2.2”项下分离方法分离并测定其包封率,结果见表2。从表2结果看出,葡聚糖凝胶柱对脂质体和游离药物分离有吸附,耗时长,Cre-LCL溶液经过凝胶洗脱分离被稀释,使药物浓度降低。超滤离心管成本偏高,但具备操作简单、用时短、将分离与浓缩同步进行等特点。用超滤离心方法的分离未包封的克班宁可得到浓度较高Cre-LCL溶液。
2.3 载药量
按比例精密称取的PEG2000、磷脂和胆固醇,总质量M,按照工艺制备成Cre-LCL溶液,经过超滤离心分离游离的药物后得到Cre-LCL的体积为V,将Cre-LCL溶液按照“2.1”项下方法测定克班宁的浓度C,载药量%=CV/(M+CV),得到载药量为5.6%。
2.4 体外释放实验
本研究参考文献[11-13]采用透析法考察克班宁长循环纳米脂质体的体外释放行为。取Cre-LCL脂质体混悬液10 mL,装入透析袋中,固定在溶出仪搅拌桨上,置于0.1 mol/L pH值7.4的等渗PBS缓冲液200 mL中[14],按中国药典“溶杯法”测定。温度控制在(37±1)℃,转速为100 r/min。分别在时间点5 min、10 min、20 min、30 min、1 h、2 h、3 h、4 h、5 h、6 h、7 h、8 h、10 h、12 h、24 h、36 h,精密取1 mL释放介质溶液,经0.45 μm滤膜过滤后用“2.1”项下HPLC法测定含量,同时迅速补充相同体积的释放介质。以最大溶出量为对照,计算各时间点的溶出度(%),以时间为横轴绘制的释放曲线见图2。
根据体外释放曲线和相关数据将克班宁长循环脂质体体外释放模型用origin8.0进行拟合,以确定是那种释放模型,结果见表3。从表中可知,Higuchi方程的R2值更高,故克班宁长循环脂质体体外释放度符合Higuchi方程的规律,具备缓释制剂的特点。Cre-LCL在3 h的释放量是38.93%,满足药典中脂质体制剂指导原则对于脂质体在0.5 h内突释量小于40%的规定。
2.5 稳定性研究
取同一批克班宁长循环脂质体,测定包封率和粒径之后,取2 mL体积熔封在安瓿瓶中,分为4组,分别贮存在室温、室温避光,4℃和4℃避光的环境下,在10、20、40 d的时候取出观察外观,测定粒径和包封率,并根据公式[15]
测定泄漏率,结果见表4。从表中总结得出:Cre-LCL对温度敏感显著,对光线敏感一般。室温(20℃)下,Cre-LCL不稳定,泄漏率高,贮存时间延长,脂质体凝聚现象明显,凝聚成团后,脂质体体系破坏;低温4℃冷藏下,Cre-LCL稳定,泄漏率低,在40 d内,脂质体无显著的凝聚现象。在避光条件下,Cre-LCL更稳定。
3 讨论
實验建立了克班宁长循环脂质体性质和质量考察的方法,为Cre-LCL的处方、工艺筛选、优化等实验提供质量评价依据。
在建立HPLC法测定Cre-LCL中克班宁的含量时,因脂质体材料特殊(大豆卵磷脂和胆固醇易形成囊泡,堵塞色谱柱[16-20]),对溶剂进行考察。分别考察了异丙醇、乙醇和甲醇的溶解性,甲醇超声溶解效果好,故选用甲醇作为溶剂。
在包封率测定中,对葡聚糖凝胶法和超滤离心法进行了考察。葡聚糖凝胶法适用性强[21-22],但本研究中Cre-LCL和游离克班宁的洗脱曲线较接近,同时,洗脱过程稀释了Cre-LCL浓度,对后续的药动学试验造成浓度过低的难题。综合考虑后,采用超滤离心法进行包封率测定,省时实用。但脂质体分离中,需特别关注离心过程中的产热现象对脂质体的影响,离心时间不宜过长。
在稳定性实验中,因克班宁见光或受热易氧化变红,故考察了光和温度对Cre-LCL的影响并对泄漏率进行测定。依据泄露率的计算公式,测量的包封率大于制备时包封率,计算得到泄漏率为负值,可认为没有发生泄漏。稳定性实验结果表中,40 d的4个条件下的包封率均高于20、10 d和0 d,本研究分析Cre-LCL在贮存时,脂质体囊材之间发生凝聚,将游离的克班宁吸附或包裹在囊材之间,放置时间越长,越利于克班宁吸附或包裹,故造成40 d时包封率高于制备时,无法测得泄漏率。同时,结果显示Cre-LCL脂质体凝聚成团后,颜色没有变红,说明克班宁包裹在脂质体囊材中减小氧化,增强了稳定性。
本研究尝试将Cre-LCL冷冻干燥制成固体便于保存,理论上应得到白色松泡状粉末[23],但制得黄色类似磷脂状的黏稠固体,故冷冻干燥法制备脂质体还有待进一步深入研究。
[参考文献]
[1] 刘娜,陈凌云,马云淑,等.克班宁长循环脂质体的制备工艺[J].中国医院药学杂志,2015,35(12):1076-1079.
[2] 刘娜,陈凌云,马云淑,等.克班宁长脂质体的制备工艺研究[J].时珍国医国药,2015,26(6):1385-1387.
[3] 纪周新,刘琳琳,李艺养,等.丹参素脂质体的制备及体外释放度研究[J].中国药师,2015,18(10):1649-1651.endprint
[4] 何文,胡翠苹,瞿振.N-三甲基壳聚糖包覆的水飞蓟宾脂质体的稳定性及体外释药的研究[J].中国药师,2015, 18(7):1076-1080.
[5] 叶兆伟,承伟.脂质体包封率测定方法及影响因素[J].中国生物制品学杂志,2007,20(10):789-792.
[6] 庄英华,张中文,韩伟,等.超滤离心法测定连翘酯苷脂质体包封率[J].中国新药杂志,2012,21(18):2209-2211, 2216.
[7] 李红茹,李淑芬.脂质体中药物包封率的测定方法[J].药物分析杂志,2007,27(11):1844-1848.
[8] 陈道阳,陈晓丹,王利胜.川芎嗪长循环脂质体包封率的测定[J].中国医药导报,2013,10(14):114-115,149.
[9] 朱泠音,郑观涛,周昌妮,等.苦参总生物碱脂质体凝胶的制备及释药机制研究[J].中国中医药信息杂志,2017, 24(1):77-81.
[10] 刘艳芳,袁苗苗,轩亚茹,等.表阿霉素-白藜芦醇长循环脂质体的制备及其体外释放[J].临床和实验医学杂志,2014,13(15):1228-1232.
[11] 陈宇潮,程怡,仝一丹,等.多烯紫杉醇长循环脂质体的制备工艺优选及体外释放性能考察[J].中国实验方剂学杂志,2014,20(12):6-9.
[12] 张成龙,张季,康聪,等.蛇床子素脂質体的处方优化及其体外释放度[J].中国医药工业杂志,2016,47(6):728-731.
[13] 李菲,张娜,郝吉福,等.多西紫杉醇纳米脂质体的制备及性质考察[J].泰山医学院学报,2015,36(10):1096-1099.
[14] 李蕊,王梅.去氢骆驼蓬碱长循环磁纳米脂质体的制备及体外性质的研究[J].西北药学杂志,2017,32(2):181-184.
[15] 李素梅.氧化苦参碱PEGs脂质体的研究[D].哈尔滨:哈尔滨商业大学,2011.
[16] 何薪宇,吕静,苏红,等.聚(2-乙基-2-噁唑啉)修饰姜黄素脂质体的制备及评价[J].中国生化药物杂志,2017, 37(6):16-19.
[17] 胡一晨,孔维军,杨美华,等.姜黄挥发油脂质体制备及其抗黄曲霉菌评价研究[J].世界中医药,2015,10(8):1157-1162.
[18] 扈本荃,廉江平,徐玥,等.甘草酸脂质体的制备及小鼠体内肝靶向效率的评价[J].中国实验动物学报,2015, 23(4):401-405.
[19] 张丽,李亚平,陈伶俐.卡巴他赛脂质体的制备及其大鼠药动学[J].中国医药工业杂志,2017,48(6):874-878.
[20] 刘琳琳,吕应年,纪周新,等.表面双膦酸盐修饰的丹参素脂质体稳定性及骨靶向性研究[J].中国药师,2016, 19(1):8-11.
[21] 邢玉桂.吴茱萸碱脂质体在大鼠体内的药动学及小鼠体内的组织分布研究[J].中国药房,2016,27(16):2236-2239.
[22] 张海军,王英杰,刘留成.卡巴他赛脂质体制备、质量控制及稳定性研究[J].中西医结合心脑血管病杂志,2017, 15(7):805-808.
[23] 徐东伟,刘同祥.黄芩素脂质体冻干粉的制备及初步评价[J].中国医药导报,2015,34(12):8-11.
(收稿日期:2017-08-02 本文编辑:张瑜杰)endprint
