超高效液相色谱-串联质谱法测定水中痕量硝基多环芳烃
2017-12-19薛洪海汪雨薇高斯屿
薛洪海,汪雨薇,,王 颖,陈 希,温 学,高斯屿,纪 宁
(1.吉林建筑大学松辽流域水环境教育部重点实验室,吉林 长春 130118; 2.北京中领工程设计咨询有限公司,北京 100035; 3.吉林省领地房地产开发有限公司,吉林 长春 130117)
超高效液相色谱-串联质谱法测定水中痕量硝基多环芳烃
薛洪海1,汪雨薇1,2,王 颖1,陈 希3,温 学1,高斯屿1,纪 宁2
(1.吉林建筑大学松辽流域水环境教育部重点实验室,吉林 长春 130118; 2.北京中领工程设计咨询有限公司,北京 100035; 3.吉林省领地房地产开发有限公司,吉林 长春 130117)
采用带有大气压化学电离离子源的超高效液相色谱-串联质谱仪,研究了水中2种典型硝基多环芳烃——1-硝基芘和1,8-二硝基芘的定量分析条件.结果表明,在多反应监测模式下,可直接分析水中痕量1-硝基芘和1,8-二硝基芘.其线性范围分别为0.72~12 μg/L和0.48~48 μg/L,相关系数分别为0.999 0和0.999 2,回收率分别为97.67%~104.44%和93.33%~103.13%,方法检出限分别为0.21 μg/L和0.15 μg/L,定量限分别为0.72 μg/L和0.26 μg/L.
1-硝基芘;1,8-二硝基芘;超高效液相色谱-串联质谱法
0 引言
硝基多环芳烃(nitro-polycyclic aromatic hydrocarbons,NPAHs)是一类具有直接致突变和致癌活性的多环芳烃(polycyclic aromatic hydrocarbons,PAHs)衍生物,[1]其致癌性和致突变性是PAHs的几十甚至数万倍.关于PAHs分析方法的报道较多,如液相色谱法、气相色谱法、气质联用(GC-MS)、液相色谱-串联质谱法(LC-MS/MS)等,[2-5]而对NPAHs进行定量分析的研究较少.1-硝基芘(1-nitropyrene,1-NP)是一类结构最简单的NPAHs,也是汽车尾气中含量最高的一类NPAHs[6];1,8-二硝基芘(1,8-dinitropyrene,1,8-DNP)是目前报道的致突变活性最高的一类化合物[7].尽管1-NP和1,8-DNP在水中溶解度较低,仅为12 μg/L和54 μg/L,但有研究者已在雨水、河流中检测到这两种NPAHs.[8-9]
目前,关于大气及大气颗粒物中NPAHs检测方法的报道较多,而对水中NPAHs分析方法的研究相对较少[10].尽管早在1994年,徐晓白院士[11]就利用带有电子捕获检测器的气相色谱仪(GC-ECD)在城市地表水样中检测到多种NPAHs,然而该方法需要复杂的富集及处理过程.最近,关于NPAHs检测方法的研究主要集中于GC-MS法[12]以及高效液相色谱-荧光检测法(HPLC-FLD)[13].鉴于NPAHs的低挥发性和热不稳定性,容易在进样口分解,因此并不适于GC-MS分析.[8]HPLC-FLD法需要先将NPAHs衍生化为氨基多环芳烃(amino-PAH,APAH),然后再测定具有荧光性的APAH,[14]从而间接获得NPAHs的浓度.但APAH性质不稳定,需要在生成后立即进行测试,且这一衍生化反应易受干扰.此外,上述两种方法检测NPAHs的灵敏度均不高.后来,研究者开发了带有化学发光检测器的高效液相色谱法(HPLC-CL)来分析NPAHs,[15]虽然灵敏度可提高100 倍,但仍然需要衍生化前处理,步骤繁琐.Straube等[16]采用带有不同离子源的LC-MS/MS分析了大鼠血浆中的DNP,结果发现电喷雾电离源中,DNP不能有效雾化,而大气压化学电离源(APCI)和大气压光化学电离源对DNP的检测效果均较好.近年来,有研究者利用LC-MS/MS分析了大气颗粒物和水中的1-NP,[17-21]获得了较高的灵敏度;对于水样来说,采用LC-MS/MS避免了繁杂的前处理过程,可以直接进样分析,因此,可以预见,LC-MS/MS适于用作水中NPAHs的分析,然而目前关于这方面的研究很少.王莉丽等[5]利用带有APCI离子源的LC-MS/MS分析了城市污水中的6种PAHs,在正离子、MRM监测模式下获得了较好的分离效果和较高的灵敏度.
本文利用LC-MS/MS法定量分析了水中痕量NPAHs,优化了质谱和色谱分析条件,通过线性范围、检出限和定量限、回收率和精密度等指标评价了方法的可行性.此外,采集实际水样,分析了其中NPAHs的浓度.本方法具有较好的分离能力、较快的分析速度和较高的灵敏度.
1 实验方法
1.1 主要仪器与装置
Ekspert Ultra LC 110 XL超高效液相色谱仪,美国Eksigent公司产品,配有两元四相梯度泵、自动进样器和柱温箱;3200 Q Trap串联质谱仪,美国AB Sciex公司产品,配有APCI离子源及Analyst 1.6数据采集和处理系统.175L液氮罐,浙江普阳深冷装备有限公司产品;超纯水机,上海摩勒科学仪器有限公司产品.
1.2 主要材料与试剂
1-NP,纯度99%,美国Sigma公司产品;1,8-DNP,纯度98%,美国Aldrich公司产品;甲醇,色谱纯,美国Tedia公司产品;纯净水,杭州娃哈哈集团有限公司产品.
1.3 样品制备
标准溶液的制备:分别准确称取0.002 4 g 1-NP和0.004 8 g 1,8-DNP标准品,用甲醇溶解并定容至1 L,配制成2.4 mg/L 1-NP和4.8 mg/L 1,8-DNP的储备液.使用前,用水稀释成所需溶液.为避免1-NP和1,8-DNP发生光解,采用棕色容量瓶和铝箔包裹,于4℃冰箱中密封保存.
1.4 实验条件
1.4.1 色谱条件
色谱柱:Agilent Zorbax RRHD SB-C18色谱柱(2.1 mm×100 mm,1.8 μm);柱温40 ℃;进样量20 μL;甲醇和水作为流动相,流速为200 μL/min.
1.4.2 质谱条件
APCI离子源;负离子扫描模式;多重反应监测模式(MRM);离子源温度500 ℃;电流-3.0 nA;气帘气(curtain gas)压力172 kPa;喷雾气(GS1)压力310 kPa;辅助加热气(GS2)压力207 kPa;碰撞气(CAD)压力为中等.
1.5 实际样品采集方法
2016年1月在吉林省长春市生态广场环岛内(N43°49′,E125°22′)采集实际积雪样品;2016年6月在吉林省长春市南湖大桥下(N43°50′,E125°18′)采集湖水样品.雪样品需在室温融化,随后将融雪水和湖水经0.45 μm滤膜过滤,当天测试其中1-NP和1,8-DNP的质量浓度.
2 结果与讨论
2.1 质谱条件的优化
在进行化合物优化——母离子扫描(MS)时,本方法对仪器进行了改进,在LC出口和APCI源进口之间加一个三通和注射泵,由注射泵引入2.4 mg/L的1-NP或4.8 mg/L的1,8-DNP的甲醇-水溶液(V(甲醇)/V(水)=50∶50),由LC提供的1.0 mL/min甲醇-水(V(甲醇)/V(水)=95∶5)作为流动相.在负离子电离模式下,分别在m/z为100~280和100~320范围进行1-NP和1,8-DNP的母离子扫描,在一级全扫描质谱中得到母离子的质量数.随后,进行产物离子扫描(product ion scan),不断增加碰撞能,最终获得多对离子对,将最强的离子对确定为定量离子对.同时,对去簇电压和碰撞能量进行优化,具体质谱参数见表1.
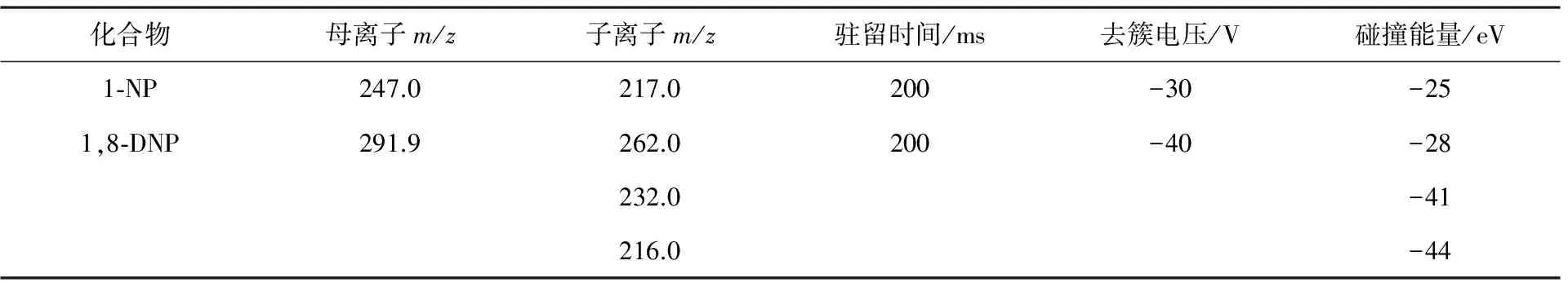
表1 1-NP和1,8-DNP的质谱参数
2.2 色谱条件的优化
由于1-NP和1,8-DNP的极性较差,尝试了较高体积比的甲醇进行了系列洗脱实验,结果见表2.由表2可见,无论对于1-NP还是1,8-DNP,当V(甲醇)/V(水)=95∶5时,保留时间最短;当V(甲醇)/V(水)=90∶10时,仪器响应值最高,但与V(甲醇)/V(水)=95∶5时响应值相差不多.为节省分析测试时间,选择V(甲醇)/V(水)=95∶5的甲醇-水溶液作为流动相.
在上述优化的质谱和色谱条件下分析1-NP和1,8-DNP,所得色谱图如图1所示.由图1可见,在选定的实验条件下,1-NP和1,8-DNP均具有良好的色谱峰.通过对同一样品重复测定发现,1-NP和1,8-DNP保留时间的重复性均较好,相对标准偏差(RSD)分别为0.19%和0.39%(n=6).1-NP和1,8-DNP的结构及其二级质谱图如图2所示.

表2 1-NP和1,8-DNP的色谱参数

图1 1-NP(a)和1,8-DNP(b)的多反应监测扫描模式色谱图
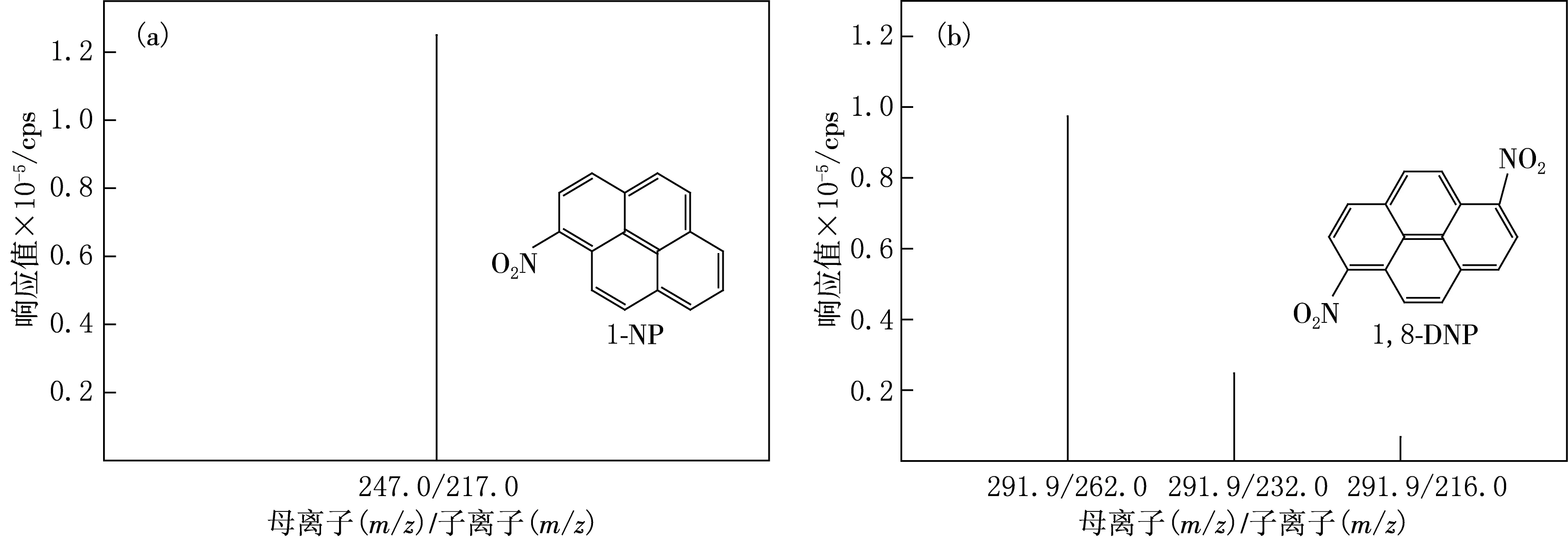
图2 1-NP(a)和1,8-DNP(b)的二级质谱图及其结构式
2.3 方法评价
2.3.1 线性范围、检出限和定量限
在上述优化实验条件下进行方法评价.分别配制0.72,1.2,3,6,9,12 μg/L的1-NP水溶液和0.48,3.6,12,24,36,48 μg/L的1,8-DNP水溶液,进LC-MS/MS分析,对不同浓度目标物的峰面积进行线性回归,结果表明,1-NP和1,8-DNP分别在0.72~12 μg/L和0.48~48 μg/L的浓度范围内具有的良好线性关系,相关系数(R2)分别为0.999 0和0.999 2.以3倍信噪比(S/N)为方法检出限(LOD),10倍S/N为定量限(LOQ),得到1-NP和1,8-DNP的检出限和定量限,结果见表3.Barreto等[22]采用APCI-LC-MS/MS方法检测柴油机油烟中的1-NP,检出限为0.2 μg/L,与本文相当.Straube等[16]采用APCI-LC-MS/MS方法检测大鼠血浆中的1,8-DNP,检出限为5 μg/L(S/N值=5),劣于本论文.

表3 1-NP和1,8-DNP的线性方程、相关系数、检出限、定量限
2.3.2 回收率和精密度
在不同质量浓度的1-NP和1,8-DNP标准品中分别添加0.5和1倍的加标量,进行回收率测定,结果见表4.由表4可见,在3~6 μg/L范围内,1-NP的回收率为97.67%~104.44%;在2.4~24 μg/L范围内,1,8-DNP的回收率为93.33%~103.13%.相对标准偏差均小于5%,结果令人满意.

表4 1-NP和1,8-DNP的回收率和精密度(n=3)
2.3.3 1-NP和1,8-DNP的同时分析
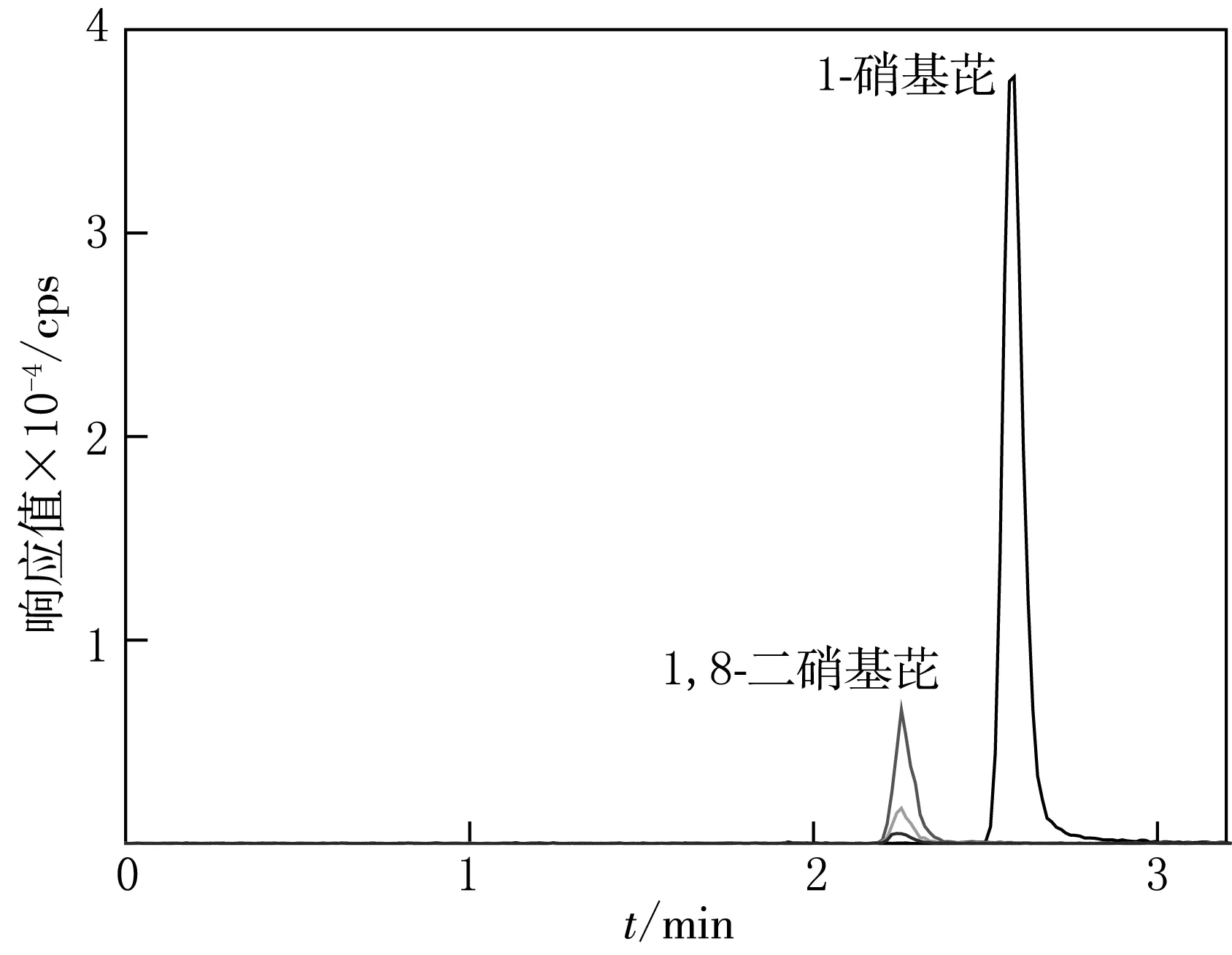
图3 1-NP和1,8-DNP的多反应监测扫描模式色谱图
将1-NP和1,8-DNP的分析方法进行合并(Merge,MRM),利用合并后的方法,测定混合标准品中1-NP和1,8-DNP的浓度,结果见图3.由图3可见,本方法可有效分离出混合组份中的1-NP和1,8-DNP,且色谱峰良好.
应用本方法对长春市生态广场积雪以及南湖水样中的1-NP和1,8-DNP浓度进行了同时分析,结果表明,两个采样点融雪水和湖水中1-NP和1,8-DNP的浓度均低于检出限(LOD).
4 结论
本文以APCI为离子源,在MRM模式下,通过对质谱和色谱条件的优化,成功建立了水中2种代表性NPAHs化合物1-NP和1,8-DNP的LC-MS/MS分析方法.与已报道方法相比,本方法不需样品前处理过程,且具有较好的分离能力、较快的分析速度和较高的灵敏度等诸多优点,适用于水环境中痕量NPAHs的分离分析.
[1] WANG W,JING L,ZHAN J,et al.Nitrated polycyclic aromatic hydrocarbon pollution during the Shanghai World Expo 2010[J].Atmospheric Environment,2014,89:242-248.
[2] 陶敬奇,王超英,李碧芳,等.固相微萃取-高效液相色谱联用分析环境水样中的痕量多环芳烃[J].色谱,2003,21(6):599-602.
[3] 罗世霞,朱淮武,张笑一.固相微萃取-气相色谱法联用分析饮用水源水中的 16 种多环芳烃[J].农业环境科学学报,2008,27(1):395-400.
[4] 李庆玲,徐晓琴,黎先春,等.固相微萃取-气相色谱-质谱联用测定海水和沉积物间隙水中的痕量多环芳烃[J].中国科学:B辑,2006,36(3):202-210.
[5] 王莉丽.城市污水中多环芳烃的测定方法及其去除特性研究[D].西安:西安建筑科技大学,2012.
[6] ARCE R,PINO E F,VALLE C,et al.Photophysics and photochemistry of 1-nitropyrene[J].Journal of Physical Chemistry A,2008,112(41):10294-10304.
[7] 占洁,杨颜,柳杜鹃,等.大气中硝基多环芳烃的研究进展[J].中国科学:地球科学,2012 (1):1-9.
[8] MURAHASHI T,ITO M,KIZU R,et al.Determination of nitroarenes in precipitation collected in Kanazawa,Japan[J].Water Research,2001,35(14):3367-3372.
[9] OHE T,NUKAYA H.Genotoxic activity of 1-nitropyrene in water from the Yodo River,Japan[J].The Science of the Total Environment,1996,181(1):7-12.
[10] PERRINI G,TOMASELLO M,LIBRANDO V,et al.Nitrated polycyclic aromatic hydrocarbons in the environment:formation,occurrences and analysis[J].Annali Di Chimica,2005,95(7/8):567-577.
[11] 马明生,徐晓白,康致泉,等.城市水样中首次检出痕量硝基多环芳烃(NO2-PAH)[J].环境化学,1994(6):543-549.
[12] 郭丽,惠亚梅,郑明辉,等.气相色谱-质谱联用测定土壤及底泥样品中的多环芳烃和硝基多环芳烃[J].环境化学,2007,26(2):192-196.
[13] SCHAUER C,NIESSNER R,POSCHLU.Analysis of nitrated polycyclic aromatic hydrocarbons by liquid chromatography with fluorescence and mass spectrometry detection:air particulate matter,soot,and reaction product studies[J].Analytical and Bioanalytical Chemistry,2004,378(3):725-736.
[14] DELHOMME O,HERCKES P,MILLET M.Determination of nitro-polycyclic aromatic hydrocarbons in atmospheric aerosols using HPLC fluorescence with a post-column derivatisation technique[J].Analytical and Bioanalytical Chemistry,2007,389(6):1953-1959.
[15] HAYAKAWA K.Environmental behaviors and toxicities of polycyclic aromatic hydrocarbons and nitropolycyclic aromatic hydrocarbons[J].Chemical & Pharmaceutical Bulletin,2016,64(2):83-94.
[16] STRAUBE E A,DEKANT W,VOLKELW.Comparison of electrospray ionization,atmospheric pressure chemical ionization,and atmospheric pressure photoionization for the analysis of dinitropyrene and aminonitropyrene LC-MS/MS[J].Journal of the American Society for Mass Spectrometry,2004,15(12):1853-1862.
[17] MILLER-SCHULZE J P,PAULSEN M,TORIBA A.Analysis of 1-nitropyrene in air particulate matter standard reference materials by using two-dimensional high performance liquid chromatography with online reduction and tandem mass spectrometry detection[J].Journal of Chromatography A,2007,1167(2):154-160.
[18] COCHRAN R E,SMOLIAKOVA I P,KUBATOVA A.Detection of nitrated and oxygenated polycyclic aromatic hydrocarbons using atmospheric pressure chemical ionization high resolution mass spectrometry[J].International Journal of Mass Spectrometry,2016,397:6-17.
[19] LIEN G W,CHEN C Y,WU C F.Analysis of polycyclic aromatic hydrocarbons by liquid chromatography/tandem mass spectrometry using atmospheric pressure chemical ionization or electrospray ionization with tropylium post-column derivatization[J].Rapid Communications in Mass Spectrometry,2007,21(22):3694-3700.
[20] TORIBA A,KITAOKA H,DILLS R L,et al.Identification and quantification of 1-nitropyrene metabolites in human urine as a proposed biomarker for exposure to diesel exhaust[J].Chemical Research in Toxicology,2007,20(7):999-1007.
[21] HUTZLER C,LUCH A,FILSER J G.Analysis of carcinogenic polycyclic aromatic hydrocarbons in complex enviromental mixtures by LC-APPI-MS/MS[J].Analytica Chimica Acta,2011,702(2):218-224.
[22] BARRETO R P,ALBUQUERQUE F C,NETTOA D P.Optimization of an improved analytical method for the determination of 1-nitropyrene in milligram diesel soot samples by high-performance liquid chromatography-mass spectrometry[J].Journal of Chromatography A,2007,1163(1/2):219-227.
DeterminationoftraceNitro-PAHsinwaterbyultraperformanceliquidchromatography-tandemmassspectrometry
XUE Hong-hai1,WANG Yu-wei1,2,WANG Ying1,CHEN Xi3,WEN Xue1,GAO Si-yu1,JI Ning1
(1.Key Laboratory of Songliao Aquatic Environment,Ministry of Education,Jilin Jianzhu University,Changchun 130118,China; 2.Beijing Zhongling Engineering Design & Consulting Co.Ltd,Beijing 100035,China; 3.Jilin Leading Real Estate Exploitation Ltd,Changchun 130117,China)
Using ultra performance liquid chromatography-tandem mass spectrometry equipped with atmospheric pressure chemical ionization ion source,this work established the quantitative analysis methods of two typical nitro polycyclic aromatic hydrocarbons,that is,1-nitropyrene and 1,8-dinitropyrene.The results showed that both 1-nitropyrene and 1,8-dinitropyrene could be determined directly under multiple reaction monitoring mode.Both 1-nitropyrene and 1,8-dinitropyrene displayed excellent linearity in the concentration range of 0.72~12 μg/L and 0.48~48 μg/L,the correlation coefficients of the calibration curve were 0.999 0 and 0.999 2.The average rates were in the rang of 97.67%~104.44% and 93.33%~103.13%.In addition,the limits of detection of 1-nitropyrene and 1,8-dinitropyrene were 0.21 μg/L and 0.15 μg/L,and the limit of quantitation were 0.72 and 0.26 μg/L respectively.
1-nitropyrene;1,8-dinitropyrene;ultra performance liquid chromatography-tandem mass spectrometry (UPLC-MS/MS)
1000-1832(2017)04-0134-06
10.16163/j.cnki.22-1123/n.2017.04.025
2017-04-22
国家自然科学基金资助项目(41403101).
薛洪海(1984—),女,博士,副教授,主要从事环境化学研究;通讯作者:王颖(1978—),女,博士,副研究员、主要从事环境生态学研究.
X 132学科代码610·1015
A
(责任编辑:方林)
