医疗改革的未来—2015年CDER主任在美国参议院听证会上的证词
2017-12-19美国食品药品管理局药品评价和研究中心主任珍妮特伍德科克
文 / 美国食品药品管理局药品评价和研究中心主任 珍妮特·伍德科克
译 / 唐健元
尊敬的主席先生和各位委员会成员们:
我是美国食品药品管理局药品评价和研究中心主任珍妮特·伍德科克。我很荣幸在食品药品管理局负责审察新药安全性和有效性。今天感谢诸位就目前医药改进的力度和领域听取我的意见。
1980年,我初到食品药品管理局的时候,管理局审批新药是否可以进入市场并销售给患者的过程总是遭受诸多批评,或是因为审批过程太慢,或是落后于其他国家,还有缺少透明度以及和新药开发商合作不足等。
如今,凭借食品药品管理局上下的通力合作,我国的药品审查过程呈现出焕然一新的局面——和其他国家相比,我们实施救助患者的新治疗方法是最快的,比以往任何时候都迅速。在2014年,由药品评价和研究中心审批的新药(“新分子实体”)中,大约2/3的新药在美国最早获批(见图1)。此外,令人瞩目的是,我们增强了美国药品安全管理系统,使药品审查程序更加现代化,并将新的基因组和相关科学引入到药品评价程序中。
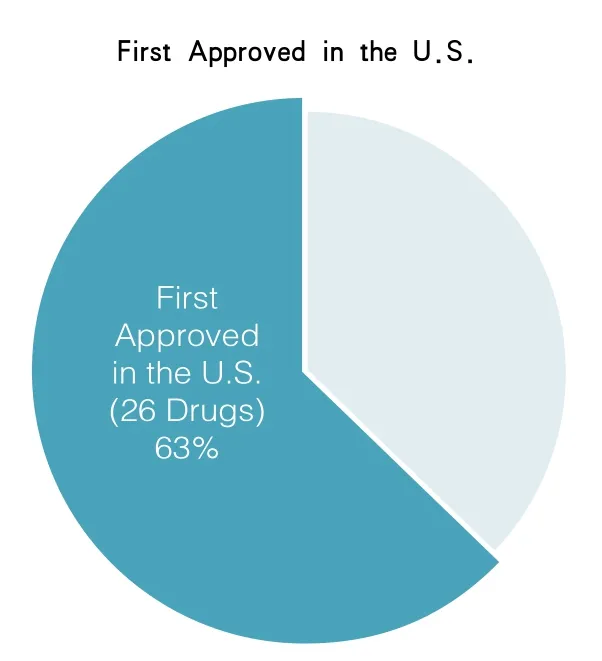
图1 在2014年,由药品评价和研究中心审批的新药(“新分子实体”)中,将近2/3的新药是在美国最早获批
促成药品审查和发展速度加快的因素
今天的局面不是由单一的行动或是计划性的改变促成的,而是基于《处方药使用者付费法》,新政府和其他因素的资金投入,其他项目的稳步改进。我们基于外界和内部之间已确认的差距开展这些改进,因此,现在我们有更多可预见的审查时间和额外的资源应对来自应用领域的工作负荷,以及管理局员工与药品制造商之间的额外互动来确保有价值的药品可以及时送到患者手中。
处方药使用者费用项目
委员会批准1992年《处方药使用者付费法》是我们在审批时间上改进的重要因素之一。顾名思义,《处方药使用者付费法》以使用者费用的名义为食品及药品管理局提供自己雇佣足够的员工承担日益增加有关新药在美国上市的应用工作。
不过该法案还具有更深远的意义。它建立了及时审批,这是对制造商和患者都是至关重要的原则,食品药品管理局应当在预定的时间内执行审查工作。
在《处方药使用者付费法》颁布不久,我担任了药品评价和研究中心主任。起初,我就下定决心要按照商业模式来运行该程序,即使用现代化的项目管理技术,建立明确的目标,在执行这些目标过程中,实行审查职员和管理者责任问询制。最后大家围绕中心工作共同努力,稳步降低了审查时间,加大了产业的可预见性,最重要的是,加快了患者使用新型治疗方法的速度。
因此,我非常感谢委员会对使用者费用项目的支持。在不降低管理局对产品安全、功效和质量评判的高标准情况下,对改革我国的药物审批程序和加快新药使用速度起到了推动作用。在2014年,药品评价和研究中心完成了《处方药使用者付费法》的目标,有98%的新药得到了审批。除了《处方药使用者付费法》外,还有许多其他的举措对于我们在实现这些目标中取得的进步都有促进作用,包括:加快美国食品药品管理局审批项目,加大与医药产业的合作以及使用替代终点来推进医药发展。
加快美国食品药品监察局审批项目
对于重症患者,现有的治疗方法无法满足他们的需要,这时就需要让新的治疗方法能够迅速地进入患者和主治医师的手中。FDA的加快审批项目是建立在意识到这种新的需要的基础之上的。
加快批准
自《处方药使用者付费法》实施以来,FDA创建了加快批准项目,允许针对治疗严重的和威胁生命的疾病的某一新药在“替代终端”的基础上获批。换句话说,就是不再直接衡量该产品对患者的益处,而是使用生物标记物或者标准在可能合理的情况下预测临床的益处。
加快批准的情况下,申请人必须实施或完成批准后期必须是研究以确保药品可以真正地帮助人们。替代终端作为临床终端的临时替代者用来测量药品的真实效益:不管是患者感觉好起来,还是作用更换或是活得更长。替代终端通常允许在更短的时间内更少的人口数量下进行临床试验从而降低药品研发的时间和成本。更多关于替代终端和其他的生物标记物如何被用来加快研发药品的信息在下面将会提到。
因为加快批准项目,药品评价和研究中心已经加快批准了90多种新药和生物制剂。在2014年,在药品评价和研究中心批准的41种新药中有8种是在加快批准项目中得到批注的(占据20%)(见图2)。
优先审批
“优先审批”也针对一些药品,这些药品与现有的药品相比在治疗严重的或威胁生命的疾病方面就安全性和有效性而言,可能有显著提高。优先审批药品会有一个将审批时间缩短至6个月的FDA审批计划。举例来说,从2008年开始到2014年底,药品评价和研究中心已经在根据优先审批指令,将93种新药和生物制剂的审批时间均缩短为6个月。在2014年,药品评价和研究中心将41种新药中的25种制定为优先审批药物(见图3)。
快速通道
“快速通道”是另一个快捷项目,帮助减少药品进入市场的时间,研发这些药品主要是为治疗那些严重的威胁生命的疾病。指定的快速通道主要是用于针对某些药品,在严重状况下,有非临床或临床数据证明该药品可能会满足现有的医药不能满足的需求。
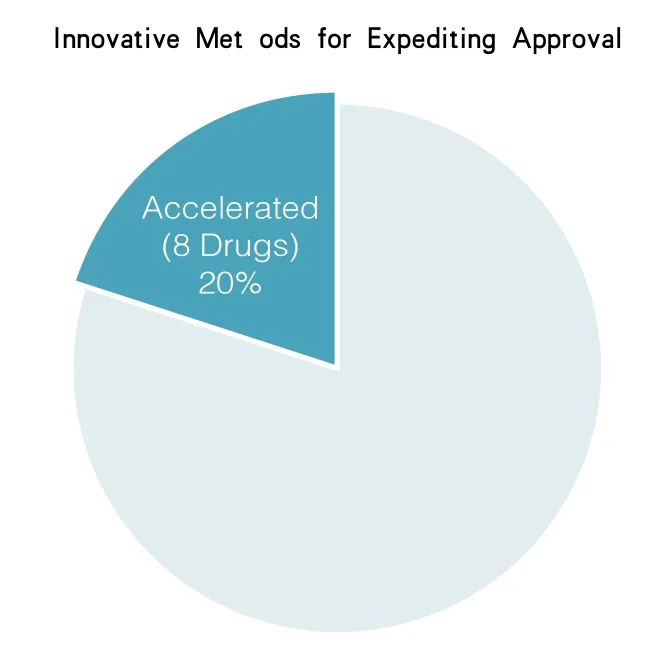
图2 在2014年,在药品评价和研究中心批准的41种新药中有8中是在加快批准项目中得到批注的(占据20%)
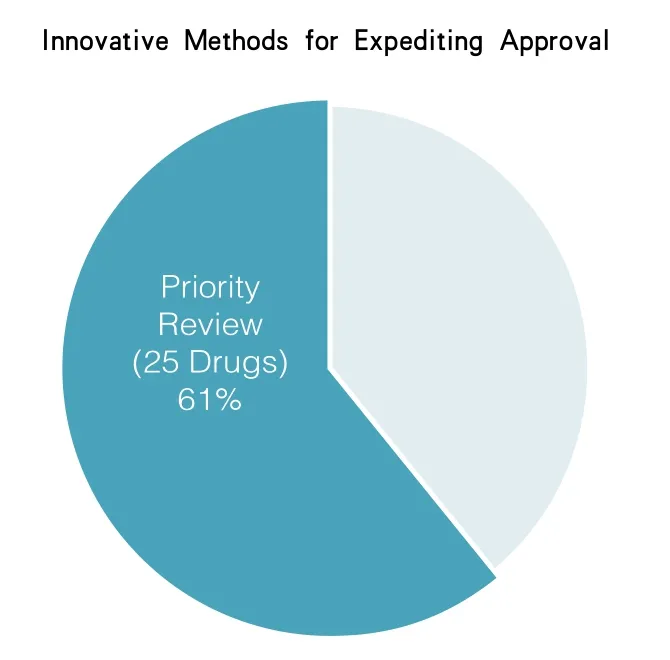
图3 在2014年,药品评价和研究中心将41种新药中的25种制定为优先审批药物
一种药品收到指定的快速通道名额时,FDA会和药品的注册申请人会密切协作加快提交药品发展规划,设计临床试验并鉴定任何必需的数据去支持FDA批准该药。此外,一旦申请人开始开发支持审批的数据,可以提交该数据用于“滚动式审查”。滚动式审查允许申请人在完全投入应用之前提交上市申请的部分数据进行审查,而不是按照通常的审查程序将上市申请的所有程序都提交上去。
从2008年到2014年药品评价和研究中心已经通过快速通道审批了76种新药和生物制剂。2014年,药品评价和研究中心审批的41种新药中,有17种是在快速通道下审批的(占据41%)(见图4)。
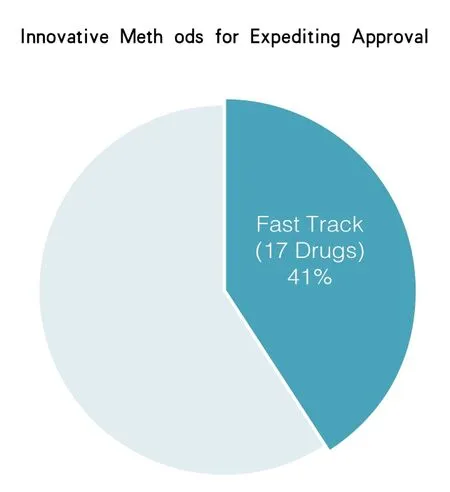
图4 2014年,药品评价和研究中心审批的41种新药中,有17种是在快速通道下审批的(占据41%)
突破性疗法认定
在2012年,国会将“突破性疗法”认定作为另一种新的工具,用来加速推进针对严重的和威胁生命疾病的新型重要治疗方法。突破性疗法认定是针对某种药品提出的,在非常严重的情况下,有初步的临床证据显示该药品与现有的疗法相比,就一种多种临床终端而言可能表现出实质性的提高。像某些药物可以享受快速通道认定一样,上述突破性疗法可以享受FDA的集中引导,帮助申请人更好地设计他们的药品研发项目,因此,将快速顺利获批的可能性提高到最大化。此外,突破性疗法药品可以收到来自FDA高级管理者和有经验的审批专家的共同承诺,他们会通力协作加快这些潜在的高效药品的审批。
自2015年4月16日起,药品评价和研究中心与生物学评价和研究中心指定了超过84种新型疗法作为突破性疗法,其中24种已经收到营销审批。此外,在许多案例中突破性进展程序不再使用更多的FDA快速审批次数,缩短了这些疗法的整体研发时间。在FAD和新型药品申请人紧密合作下,突破性疗法项目有望取得进一步成功。
在2014年,药品评价和研究中心批准的41种新药中有9种被指定为突破性疗法(占22%)药品(见图5)。
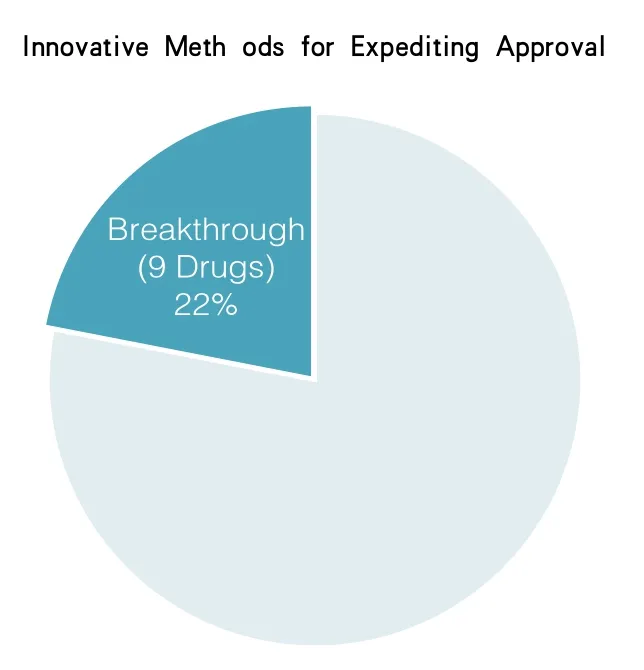
图5 在2014年,药品评价和研究中心批准的41中新药种有9种被指定为突破性疗法药品(占22%)
扩大与医药产业的合作
正如突破性疗法项目这一举措,通过努力,我们扩大了FDA与医药产业的合作,这是我在FDA任职期间发生的具有更深远变革的事件之一。近年来,FDA与医药产业之间的会议已成为惯例。事实证明,这些会议对于提高已计划的临床试验、研发时间表和数据需求等方面的交流是非常宝贵的。
在提高FDA与医药产业之间的交流后,其影响变得越来越明显。最近,FDA检查了在新药审核前的交流下审批的新药研发时间,并和没有在此会谈下审批的新药的研发时间进行了对比,结果相当惊人。比如,在2010年和2012年间,在审批的新药中,平均临床研发时间是过去没有进行召开新药审核前会议的三倍还要快。2014年在《柳叶刀》杂志上一篇名为《生物医学研究:增加价值,减少浪费》(2014年1月11日)的文章,记载每年全球花在研究上的开支有85%(即2000亿美元)都浪费在毫无计划的开支上了,因此我认为加大FDA与医药产业的合作可以明显减低这种浪费。
扩大FDA与医药产业合作另一个成果就是实质性地降低了申请审批周期。“多重审批周期”会在申请人提交待批复的上市申请之后而FDA并没有在第一轮审批中同意时出现。如果最终药品能通过审核,对于FDA和产业而言,最有效的结果是在申请第一轮审批中就能获批。
在第一轮审批中没有得到FDA批准的药品,其申请人必须返回重新收集额外的数据,解决他们上市申请中的缺陷,在此提交他们的申请让FDA再次审批。不过,想要在第一轮审批通过就需要准备一份无重大缺陷的申请。
作为FDA和医药产业更好合作的结果,是帮助公司在提交申请之前鉴别所需要的数据,分析得到批注所必需的材料,目前第一轮就能获批的新药已经超过提交药品的70%,而在过去这连总提交药品的一半都达不到。
比如,在2014年,药品评价和研究中心批准的41种新药中有78%的新药是在第一轮审批中获批的(见图6)。如图7所示,这种转变减低了医药产业和早期接触这种新疗法的患者成本。在使用者费用项目没有成立之前,这种有利于项目加速研发的早期和频繁交流是不可能的。因此,我再次感谢委员会授权和再授权使用者付费项目。
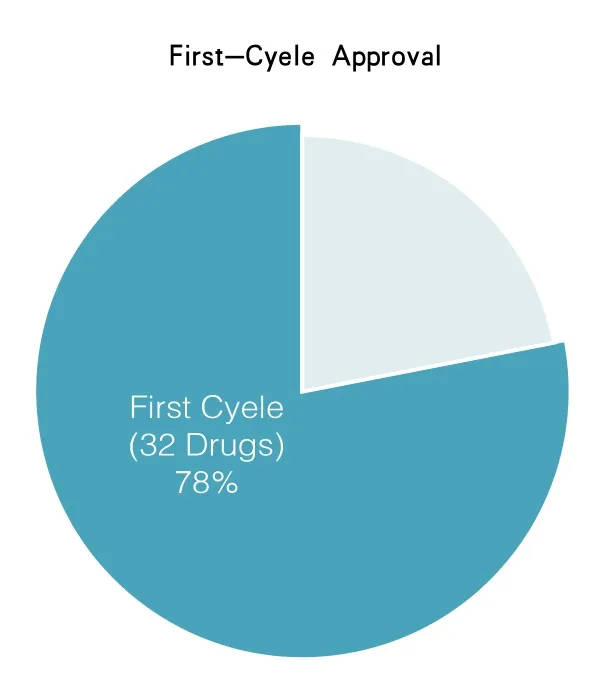
图6 在2014年药品评价和研究中心批准的新药中,有一大部分是在第一轮审批中批准的(占78%)
使用替代终点来推进医药发展
正如上面所提到的,按照惯例,预计替代品可能对某一严重的或者是威胁生命但又缺乏好的治疗方法的疾病有一定效果时,FDA在加速审批的基础上,允许使用替代终点。不过,当科学研究进步到可以有效地在替代终点和临床受益建立相互联系的时候,替代终点可能会依靠惯例审批,抵消研究确认的要求,在加速审批的情况下,申请人只得服从。举一个例子,降低增高的血压水平是众所周知的替代终点,用来反映心血管并发症的降低,诸如中风。在过去的很多年中,FDA允许惯例批准的途径应用于批准大范围的治疗血压疾病的药品,因此,大大地扩大了抗击中风和其他与心血管状况相关的治疗机会。
在过去的五年间(2010~2014年),共有197种新药和新的生物制剂得到FDA批准,其中有84种(占43%)是依靠替代终点得到批注(见图8)。列有依靠替代终点获批的84种新药和生物制剂(包括管理审批和加速审批)的测定表格与附录是连在一起的。

图7 CDER首轮审批通过率
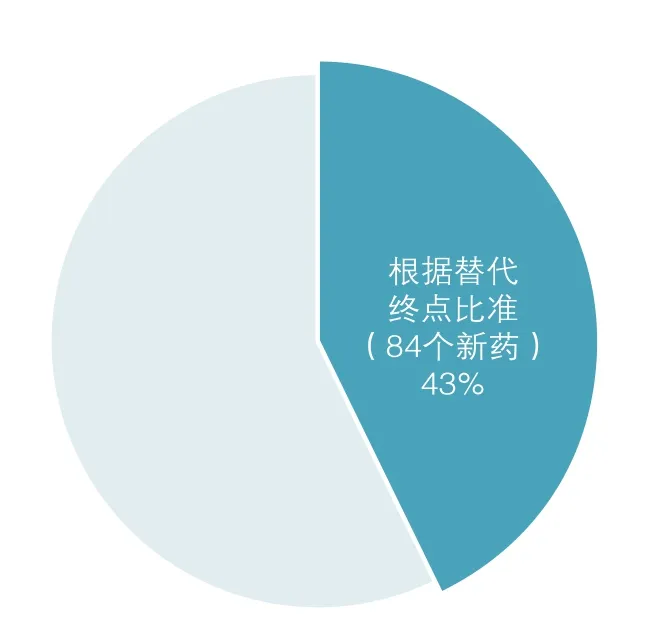
图8 根据替代终点批准的新药(2010-2014)
有关新的治疗方法越来越多的活动记录
上述每一项改进都有助于加速阻止和抵抗疾病的新治疗方法的研发和审批。过去的一年,我们展示了这些改进是如何起作用的:FDA一共审批了51种新药和新的生物制剂,其中41种是由药品评价和管理中心审批的,10种是由生物学评价和研究中心审批的。此外,在51种新药中有21种是罕见病用药。
过去很多年,我们国家的审批时间总是晚于其他国家,如今这种状况已经扭转过来了。现在,FDA审批药品的平均时间比其他任何国家都要快:比日本快40天,比加拿大快70天,比欧盟快174天。根据英国监管科技创新中心的报道,从2004年到2013年,在日本、欧盟、加拿大、澳大利亚、瑞士和FDA获批的新药中,有75%首先在FDA获批。不过,正如下方的图9所示,通过另一项独立的分析得出:在新药的引进方面,FDA继续引领欧盟和其他先进国家。
这项进步最重要的影响就是对于美国患有无法治疗或者治疗情况糟糕的疾病的病人而言,他们可以比其他国家患者更快更好地收到最新的治疗方法。此外,FDA在药品安全监督系统中采取的重大改进,意味着美国的患者可以确信这些新审批的药品在美国上市之后,会持续得到认真地审查,以检测任何未预测到的副作用,从而为FDA采取快捷合适的行动留出余地。
前行的道路
虽然我们已经取得了很大的进步,但是正如委员会指出,如果我们想确保美国在生物医学上的引领地位,还有很多困难需要去克服。当国会和FDA携手合作极大程度上减少FDA审批时间的时候,许多严重阻碍药品研发的挑战出现在FDA审批之间。为了将基础科学知识大爆炸有效地转化为患者需要的治疗方法,我们必须共同努力克服挡在前进路上、那些存在于基础设施和科学中的关键障碍。在2015年1月,政府开启了“精准医学行动”,旨在促进和提高在正确的时间对正确的病人进行靶向治疗。在总统的2016年预算中,准备向“精准医学行动”投入2.15亿美元,承诺用最新的工具、知识和治疗方法来武装临床医生,争取让每一位患者都能收到最好的治疗。下面,我要讲述一下推进研发新的治疗方法的几个具体方面。
削减临床试验费用
首先,在医药研发过程中,临床试验费用持续增长,是成本增加的一个最重要的原因。现在,一种新药的开发商花费数百万美元来设计临床试验,建造一系列精密的试验设施,寻找并招募研究者,实施一系列试验,最后掌握试验数据。每当一种新药在检验时,检验过程都是重复的。但是花了巨大费用建造成的试验设施,在研究一结束就要全部拆掉。
我们相信会有许多方法来提高临床试验效率,诸如广泛使用临床试验网络和主协议。我们愿意和大家一道来检验这些可能性。
对生物标记物技术和其他工具进行优化

图9 全球新活性物质首次上市区域(2010~2014)
其次,必须极大地优化鉴别和评估生物标记物应用的技术以及其他科学工具。这些工具可以用来预测和评估候选药物在临床试验和人身上的效果。从学术上讲,生物标记物被定义为具有物理的、生物化学的或者基因的特征并且能够被客观地测量和评估的物体,可以用来作为健康或疾病的指示器,或者是用来评估治疗干预的反应。换句话说,生物标记物就是在身体上所做的实验产生的结果,比如血糖或者胸透。生物标记物在药品研发方面用处很多,比如识别出合适的患者去参加临床试验,执行安全监控和筛选治疗特定患者的方法。现在有成百上千的生物标记物应用到药品研究中去。不过,基于新科学认识的生物标记物在临床应用上的发展很慢,很大一部分是因为缺乏证明它们有效性的证据。缺乏新的、充分认识的生物标记物也会影响到药品的研发,这些新的实验可能会加速药品性能的评估,包括药品安全和有效性的预测。和临床试验遇到的问题相同,用来评估新的生物标记物的科学基础设施也无法跟进该活动的需要。
通常,在为新的分子申请新药审核前交流活动时,注册申请人会和FDA就临床药物研发中的新生物标记物产生互动。这些讨论是在保密的情况下进行的,如果新的生物标记物是用于一个特定的药品研发项目,它们就没有必要受制于更大范围的科学监察。为了解决这一困境,药品评价和研究中心最近设立了生物标记物资格项目。在该项目中,FDA指定那些在某一确定用途具有功用的生物标记物为合格的生物标记物,在监管程序下,任一开发商都可以在特定用途下使用。这些合格的生物标记物只是FDA在审批过程中用到的生物标记物的一部分。
FDA意识到如何通过审批程序让这些新的生物标记物变得合格,对此人们依然会有困惑。一些人认为许多生物标记物在资格过程中“止步不前”。真实的情况是在生物标记物鉴定程序中,大部分项目仍处于搜集证据的阶段,还需要大量的时间(因为在科学界还需要大量的研发工作)。不过,注意到生物标记物不需要通过正式的鉴定程序,或者大部分都不需要是很重要的。正如先前所提到的,FDA有能力与那些想要在他们的药品研发项目中使用不同的新生物标记物的申请人直接合作。比如,申请人可以提议在临床试验中使用替代终点——生物标记物中的一种,不过这要建立在科学领域现有的关于特定替代终点的知识之上。申请人可以通过《处方药使用者付费法》项目中具有的“临床试验方案制定特许”程序要求FDA同意其使用替代终点。这些特定产品的替代终点是生物标记物为了支持药品研发和审批不需要通过我们的正式鉴定程序的一个例子。生物标记物在所谓的“个性化”或“精准”药品的发展领域也是非常重要的。在此领域,药品的使用人群被定向为患有基因决定或其他疾病特征的一小部分人群。靶向药品的研发是未来药品疗法最有前途的领域之一。患者可以根据特定的试验结果选择治疗方法(比如基因试验或其他的生物标志物),这些药品对患者的疾病(肿瘤、丙型肝炎、囊胞性纤维症)都可能产生效果。
在20世纪90年代初期,在FDA审批的新药中靶向治疗药品仅占了5%。今年来,约有1/4的新药审批是在靶向药物研发项目下进行的,而且比例随时间呈现不断增长趋势。
最近审批的新型重要靶向癌症治疗包括:治疗黑素瘤的曲美替尼(曲美替尼)和达拉菲尼(达拉菲尼胶囊);治疗淋巴瘤和白血病的依鲁替尼;治疗肺癌的色瑞替尼(色瑞替尼)。上述靶向治疗的研发正在迅速扩展开来。同样的,对于其他疾病的靶向治疗也已得到审批,包括:囊胞性纤维症的治疗,丙型肝炎的突破性治疗都潜在地在接受治疗的绝大多数人群中收到了效果。当靶向治疗变得普及时,就必须提高生物标记物在这些治疗方法中的标准程度,并且增加人们对生物标记物的认识。
利用临床试验的迹象
关于药品作用的信息来源可以通过临床试验的迹象(也称为“实际循证”或“海量数据”)我曾经非常积极地实施“FDA哨兵行动”即建立一个全国范围的电子系统,使FDA可以监察药品和生物制剂上市后的安全问题。“哨兵行动”可以使FDA通过该行动进入各种卫生保健数据库——比如电子档的健康记录系统,行政的和保险索赔数据库,登记系统来快捷安全地评价可能的药品安全问题。“哨兵行动”是在卫生保健中此类信息的最大用途之一,在检测安全性和分析安全信号方面至关重要。但是利用临床试验的迹象来建立药品有效性的技术,比如评估新药用途仍处于初期阶段。因此,为了实现利用临床试验迹象的这一目标,我们首先必须建立所需的方法论。
增强患者参与
最后一个例子主要强调让患者参与处于药品研发的中心位置。FDA意识到患有慢性疾病的患者才是最了解疾病疗效和当前治疗情况的专家。正像大家所看到的一样,FDA安全与创新法案指导FDA开启一项让更多患者参与到药品研发中的项目。我们已经有数次公开会议从患者那里来获得重要见解。不过我们也认识到,只有通过有组织、有代表性的形式搜集信息,才会对药品研发最有用。我希望在即将进行的立法中,可以和大家一道共同推进以患者为重点的药品研发活动。
结论
还有一些其他领域是我们想和大家一起合作的,包括使医药制造现代化、鼓励研发新的抗生素、提高FDA药品/器械联合产品的审批过程。
我相信上面我所提到的挑战是FDA、医药产业和患者群体共同的挑战,因为我们有共同的利益。我期待能和国会一起携手解决这些挑战,从而更好地为患者服务并促进医疗改革。
再次感谢今天邀请我和大家分享我的看法。
