维药毛菊苣95%乙醇提取物对刀豆蛋白A诱导小鼠免疫性肝损伤的保护作用及机制研究Δ
2017-12-19胡利萍张钰秦冬梅依巴古力艾拜都拉努力比亚阿布都克尤木孙晓风张跃新新疆医科大学第一附属医院感染科乌鲁木齐830054石河子大学药学院新疆石河子8300
胡利萍,张钰,秦冬梅#,依巴古力·艾拜都拉,努力比亚·阿布都克尤木,孙晓风,张跃新(.新疆医科大学第一附属医院感染科,乌鲁木齐830054;.石河子大学药学院,新疆石河子8300)
维药毛菊苣95%乙醇提取物对刀豆蛋白A诱导小鼠免疫性肝损伤的保护作用及机制研究Δ
胡利萍1*,张钰2,秦冬梅2#,依巴古力·艾拜都拉1,努力比亚·阿布都克尤木1,孙晓风1,张跃新1(1.新疆医科大学第一附属医院感染科,乌鲁木齐830054;2.石河子大学药学院,新疆石河子832002)
目的:考察维药毛菊苣95%乙醇提取物(CG-I)对小鼠免疫性肝损伤的保护作用及机制,为后期筛选其有效部位提供参考。方法:将60只小鼠随机分为空白对照组(生理盐水)、模型组(生理盐水)、阳性对照组(甘草酸二铵,100 mg/kg)和CG-I高、中、低剂量组(以生药量计分别为200、100、50 g/kg),每组10只,每天ig给药1次,连续给药10 d。末次给药后1 h,除空白对照组外的其余各组小鼠均通过尾iv刀豆蛋白A(Con-A)诱导免疫性肝损伤。造模8 h后,检测小鼠血清中肿瘤坏死因子α(TNF-α)、干扰素γ(IFN-γ)和白细胞介素1β(IL-1β)含量,计算肝、脾指数,观察肝组织病理学变化并检测肝组织中天冬氨酸转氨酶(AST)、丙氨酸转氨酶(ALT)、谷胱甘肽S-转移酶(GST)、碱性磷酸酶(AKP)、总超氧化物歧化酶(T-SOD)、丙二醛(MDA)水平。结果:与空白对照组比较,模型组小鼠血清中TNF-α、IFN-γ、IL-1β含量显著增加,肝、脾指数及肝组织中AST、ALT、GST、AKP、T-SOD水平显著升高,肝组织中MDA水平显著降低,差异均有统计学意义(P<0.05或P<0.01);小鼠肝索排列杂乱,肝细胞出现肿胀、坏死等病变。与模型组比较,除CG-I低剂量组小鼠肝组织中AST、ALT、AKP水平以及CG-I中、低剂量组小鼠血清中MDA、IFN-γ含量降低不显著外,其余各指标均显著改善(P<0.05或P<0.01);肝组织病理变化均不同程度地减轻。结论:CG-I对Con-A所致小鼠免疫性肝损伤具有保护作用,尤其以高、中剂量效果较好;其机制可能与抗氧化、抗炎作用有关。
维药;毛菊苣;95%乙醇提取物;免疫性肝损伤;抗氧化;抗炎;小鼠
肝病在世界范围内都是导致死亡的重要原因,而我国是肝病发生率较高的国家之一[1-2],肝病的治疗不容忽视。造成肝损伤的因素较多(如病毒、酒精、化学毒物或药物等),而免疫细胞介导的免疫反应,是造成肝细胞损伤的重要原因[3-4]。免疫性肝损伤(Immunological liver injury,ILI)是由于外界异物进入体内,引发机体的免疫应答,致使大量炎症细胞浸润,从而导致的肝损伤[5]。菊苣系菊科植物毛菊苣(Cichorium glandulosum Boiss.et Huet)或菊苣(Cichorium intybus L.)的干燥地上部分或根,是维吾尔族和蒙古族的常用药材,具有清肝利胆、利尿消肿、健胃消食、清热解毒的功效,维医在临床上将其广泛应用于肝胆疾病的治疗[6-7]。毛菊苣95%乙醇提取物(CG-I)中主要含萜类成分[8-9],其次还含有香豆素、生物碱等成分[10]。本课题组前期研究证实,CG-I对小鼠四氯化碳所致急性肝损伤及急性酒精性肝损伤均有较好的保护作用[11-12]。为全面考察其保肝作用,本研究应用刀豆蛋白A(Con-A)复制小鼠免疫性肝损伤模型,通过检测小鼠血清中炎症因子和肝组织中氧化酶水平的变化以及肝组织病理学改变,考察CG-I对免疫性肝损伤的保护作用。
1 材料
1.1 仪器
H1酶标仪(美国Bio Tek公司);TDL-50台式离心机(上海安亭科学仪器厂);CI-S倒置显微镜、DS-U3成像系统(日本尼康公司);Optima MAX-XP超速冷冻离心机(美国贝克曼库尔特公司);722N可见分光光度计、FA210B电子天平(上海精密科学仪器有限公司)。
1.2 药材、药品与试剂
毛菊苣来自新疆和田维吾尔医药专科学校种植基地,经石河子大学药学院李鹏教授鉴定为毛菊苣(Cichorium glandulosum Boiss.et Huet)的干燥根;甘草酸二铵胶囊(正大天晴股份有限公司,批号:20160208,规格:50 mg/粒);Con A(美国Sigma公司,纯度:98%);天冬氨酸转氨酶(AST)、丙氨酸转氨酶(ALT)、总超氧化物歧化酶(T-SOD)、谷胱甘肽S-转移酶(GST)、丙二醛(MDA)、碱性磷酸酶(AKP)酶联免疫吸附(ELISA)试剂盒和考马斯亮蓝试剂盒(南京建成生物工程研究所,批号:20160503、20160509、20160512、20160511、20160509、20160509、20160427);小鼠白细胞介素1β(IL-1β)、肿瘤坏死因子α(TNF-α)、干扰素γ(IFN-γ)ELISA试剂盒(上海雅吉生物科技有限公司,批号:20160417、20160405、20160415);其余试剂均为分析纯。
1.3 动物
清洁级KM小鼠60只,♀♂各半,体质量(20±2)g,购自新疆医科大学动物中心,动物生产许可证号:SYXK(新)2003-0001。动物购入后,于温度为(25±2)℃、相对湿度为(45±5)%、自然光照条件下适应性饲养5 d后进行实验,饲养期间小鼠自由进食、饮水。
2 方法
2.1 CG-I的制备
将毛菊苣干燥根粉碎成粗粉,精密称取干燥至恒质量的粗粉2 kg,加入500 mL的95%乙醇浸泡24 h;加热回流提取3次,每次2 h,趁热用脱脂棉过滤。滤液经浓缩、干燥后得CG-I浸膏粉178.5 g(提取率约为9.0%,CG-I中萜类成分的质量分数约为65.1%)。
2.2 分组、给药与造模
将60只小鼠按随机数字表法分为空白对照组、模型组、阳性对照组和CG-I高、中、低剂量组。阳性对照组小鼠ig 100 mg/kg的甘草酸二铵(以生理盐水制备成质量浓度为2 mg/mL的溶液,为临床成人用量按照体表面积法换算而得);CG-I高、中、低剂量组小鼠分别ig以生药量计分别为200、100、50 g/kg的CG-I(分别以生理盐水制备成质量浓度为0.35 g/mL的溶液,其中中剂量为临床成人用量根据体表面积法换算而得);空白对照组和模型组小鼠ig等体积生理盐水。每天给药1次,连续给药10 d。末次给药后1 h,模型组和各给药组小鼠均尾iv 15 mg/kg的Con A溶液(以无菌生理盐水制备成1.5 mg/mL的溶液),诱导小鼠急性免疫性肝损伤;空白对照组和模型组小鼠尾iv等体积无菌生理盐水。诱导免疫性肝损伤后,小鼠禁食不禁水8 h。实验期间观察小鼠一般生长情况和体征变化,包括生长发育状况、精神状况、饮食情况以及毛色等。
2.3 取材与指标检测
诱导小鼠免疫性肝损伤8 h后,摘眼球取血并收集小鼠肝、脾组织,用于以下指标检测。(1)血清炎症指标。将血液以3 000×g离心10 min,分离血清,于4℃保存,按照相关试剂盒说明书操作检测血清中TNF-α、IFN-γ和IL-1β含量。(2)脏器指数。将小鼠肝、脾组织放入冰生理盐水中漂洗,取出后用滤纸拭干,称质量,计算肝(脾)指数[肝(脾)质量(g)/小鼠体质量(20 g)]。(3)肝组织中肝功能相关指标。取肝右叶相同部位的一小块肝组织,用冰生理盐水漂洗后,剔除脂肪及结缔组织,吸水纸吸干,称质量,放入10 mL离心管中,加入适量的冷生理盐水,以20 000×g匀浆10 s、间歇30 s,反复3次,制成10%的组织匀浆;采用高速冷冻离心机,在4℃下以3 500×g离心10 min,取上清液,按照相应试剂盒说明书操作检测肝组织中T-SOD、AST、ALT、MDA、GST、AKP水平。(4)肝组织病理学变化。取出于10%福尔马林溶液中固定24 h的肝组织,在0.01 mol/L的磷酸盐缓冲液(PBS)中放置12 h,梯度乙醇脱水,石蜡包埋后进行组织切片(4 μm),行苏木精-伊红(HE)染色,再次梯度乙醇脱水,中性树胶封片,显微镜观察并拍照。
2.4 统计学方法
采用SPSS 19.0统计学软件进行统计分析。实验结果以±s表示,采用独立样本t检验进行组间比较。P<0.05表示差异具有统计学意义。
3 结果
3.1 一般生长状况及体征
实验期间各组小鼠的行为、运动状态、摄食、摄水及大便等未见明显异常;眼、耳、鼻、口未见异常分泌物;被毛色白,毛质光滑;对外界刺激的反应正常;无特殊异常状态出现,无死亡现象。
3.2 血清中TNF-α、IFN-γ、IL-1β含量
与空白对照组比较,模型组小鼠血清中TNF-α、IFN-γ、IL-1β含量均显著增加(P<0.05);与模型组比较,阳性对照组和CG-I各剂量组小鼠血清中TNF-α、IL-1β含量均显著减少(P<0.05或P<0.01),且CG-I高剂量组小鼠血清中IFN-γ含量显著减少(P<0.05),结果见表1。
表1 各组小鼠血清中TNF-α、IFN-γ、IL-1β含量的测定结果(±s,n=10,pg/mL)Tab 1Determination results of TNF-α,IFN-γ,IL-1β contentsin serum of mice in each group(±s,n=10,pg/mL)

表1 各组小鼠血清中TNF-α、IFN-γ、IL-1β含量的测定结果(±s,n=10,pg/mL)Tab 1Determination results of TNF-α,IFN-γ,IL-1β contentsin serum of mice in each group(±s,n=10,pg/mL)
注:与空白对照组比较,*P<0.05;与模型组比较,#P<0.05,##P<0.01Note:vs.blank control group,*P<0.05;vs.model group,#P<0.05,##P<0.01
组别IL-1β剂量TNF-αIFN-γ
3.3 脏器指数
与空白对照组比较,模型组小鼠肝、脾指数均显著升高(P<0.05);与模型组比较,阳性对照组和CG-I各剂量组小鼠肝、脾指数均显著降低(P<0.05或P<0.01),结果见表2。
3.4 肝损伤相关指标
3.4.1 肝组织中AST、ALT、AKP、GST水平与空白对照组比较,模型组小鼠肝组织中AST、ALT、AKP、GST水平均显著升高(P<0.05或P<0.01);与模型组比较,阳性对照组和CG-I高、中剂量组小鼠肝组织中AST、ALT、AKP、GST水平及CG-I低剂量组小鼠肝组织中AKP水平均显著降低(P<0.05或P<0.01),结果见表3。
表2 各组小鼠肝、脾指数的测定结果(±s,n=10)Tab 2Determination results of liver,spleen indexes of mice in each group(±s,n=10)
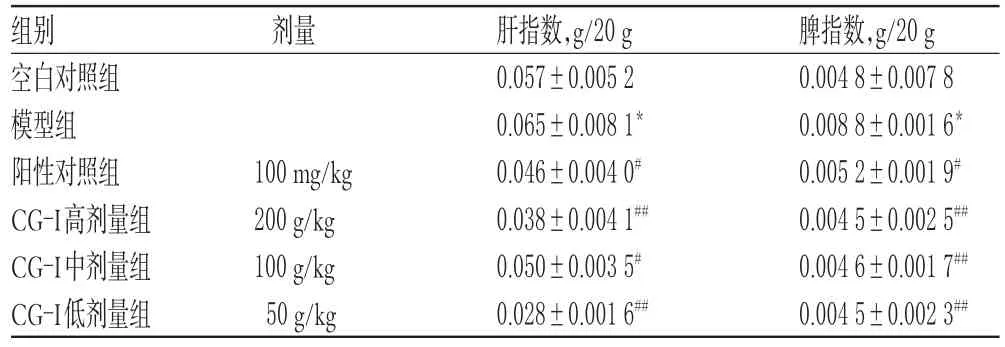
表2 各组小鼠肝、脾指数的测定结果(±s,n=10)Tab 2Determination results of liver,spleen indexes of mice in each group(±s,n=10)
注:与空白对照组比较,*P<0.05;与模型组比较,#P<0.05,##P<0.01Note:vs.normalcontrolgroup,*P<0.05;vs.model group,#P<0.05,##P<0.01
脾指数,g/20 g 0.004 8±0.007 8 0.008 8±0.001 6*0.005 2±0.001 9#0.004 5±0.002 5##0.004 6±0.001 7##0.004 5±0.002 3##组别空白对照组模型组阳性对照组CG-I高剂量组CG-I中剂量组CG-I低剂量组剂量100 mg/kg 200 g/kg 100 g/kg 50 g/kg肝指数,g/20 g 0.057±0.005 2 0.065±0.008 1*0.046±0.004 0#0.038±0.004 1##0.050±0.003 5#0.028±0.001 6##
表3各组小鼠肝组织中AST、ALT、AKP、GST水平的测定结果(±s,n=10,U/mL)
Tab 3Determination results of AST,ALT,AKP,GST levels in liver tissue of mice in each group(±s,n=10,U/mL)
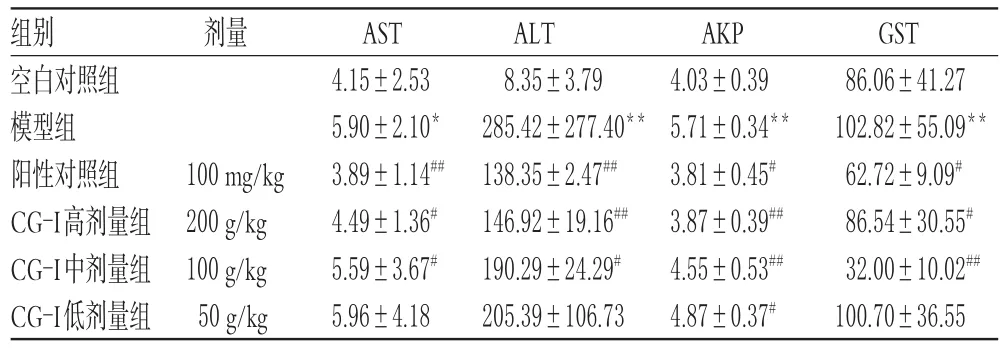
注:与空白对照组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01Note:vs.blank control group,*P<0.05,**P<0.01;vs.model group,#P<0.05,##P<0.01
3.4.2 肝组织中T-SOD、MDA水平与空白对照组比较,模型组小鼠肝组织中T-SOD水平显著降低(P<0.01),MDA水平显著增加(P<0.01)。与模型组比较,阳性对照组和CG-I各剂量组小鼠肝组织中T-SOD水平均显著升高(P<0.01),阳性对照组和CG-I高剂量组小鼠肝组织中MDA水平显著降低(P<0.05),结果见表4。
3.5 肝组织病理学变化
空白对照组小鼠肝组织的肝窦、汇管区和肝小叶均无病变,肝索分布规律;肝细胞几乎无变性或坏死,且肝细胞间隙内未见炎症细胞浸润。模型组小鼠肝索排列杂乱,较多肝细胞出现肿胀、坏死,肝细胞边界模糊、肝窦不明显,炎症浸润导致肝细胞呈气球样病变。与模型组比较,阳性对照组小鼠肝组织的肝索排列较规则,肝细胞的胞质均匀,炎症细胞浸润显著减轻;CG-I各剂量组小鼠肝组织的炎症减轻,肝细胞边界清晰、肝窦排列趋于规则,结果见图1。
表4 各组小鼠肝组织中T-SOD、MDA水平的测定结果(±s,n=10)Tab 4Determination results of T-SOD,MDA levelsinlivertissueofmiceineach group(±s,n=10)
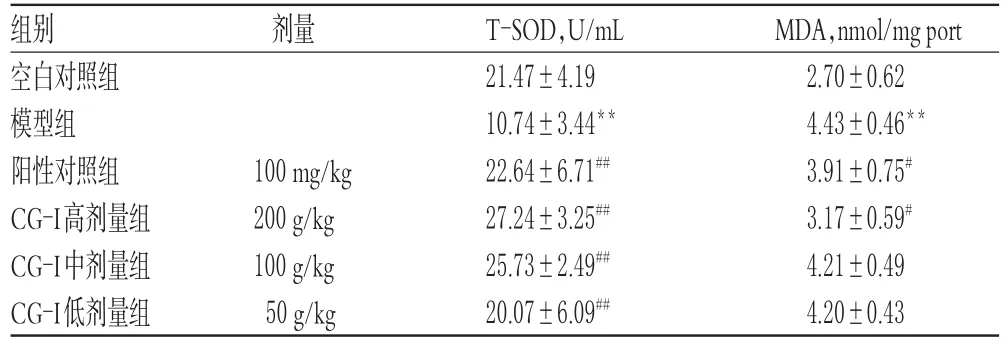
表4 各组小鼠肝组织中T-SOD、MDA水平的测定结果(±s,n=10)Tab 4Determination results of T-SOD,MDA levelsinlivertissueofmiceineach group(±s,n=10)
注:与空白对照组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01Note:vs.blankcontrolgroup,**P<0.01;vs.model
MDA,nmol/mg port 2.70±0.62 4.43±0.46**3.91±0.75#3.17±0.59#4.21±0.49 4.20±0.43组别空白对照组模型组阳性对照组CG-I高剂量组CG-I中剂量组CG-I低剂量组剂量100 mg/kg 200 g/kg 100 g/kg 50 g/kg T-SOD,U/mL 21.47±4.19 10.74±3.44**22.64±6.71##27.24±3.25##25.73±2.49##20.07±6.09##
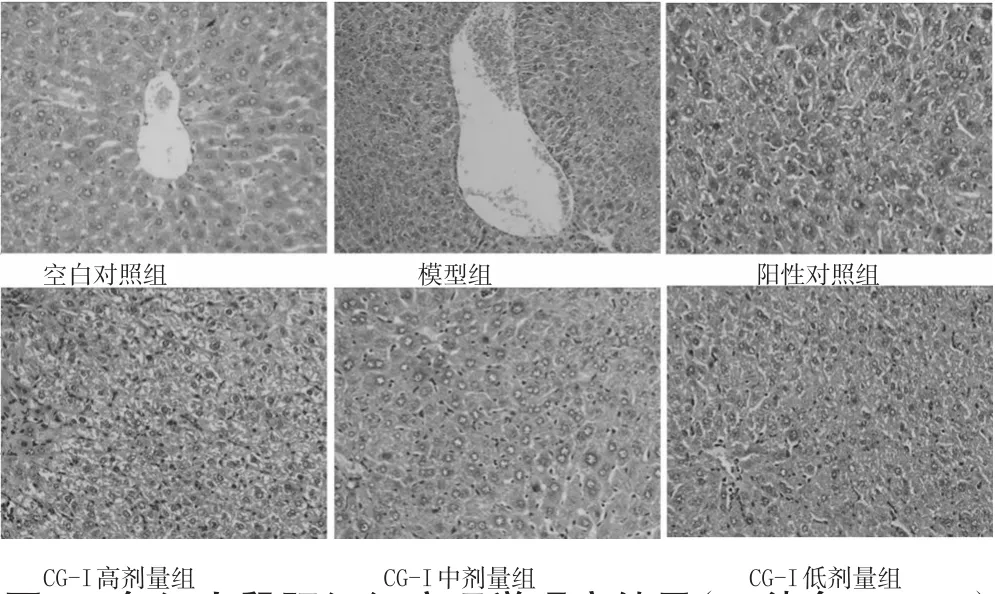
图1 各组小鼠肝组织病理学观察结果(HE染色,×200)Fig 1Observation results of pathology in liver tissue of mice in each group(HE staining,×200)group,#P<0.05,##P<0.01
4 讨论
Con A是一种能活化T淋巴细胞并且可在体外激活T细胞,从而导致免疫性肝损伤的植物凝集素[13]。Con A诱导的免疫性肝损伤能很好地模拟人病毒性肝炎、自身免疫性肝病的病理变化[4],故本研究以此法造模。甘草酸二铵是中药甘草有效成分的第三代提取物,具有较强的抗炎、保护肝细胞膜及改善肝功能的作用,在临床上广泛应用,因此本研究以其为阳性对照。
AST和ALT是肝内主要的功能酶,当肝细胞受损时,AST和ALT从肝细胞质或线粒体中释放到血液[13-14]。GST是与肝解毒功能有关的酶,肝组织中GST的含量可以作为肝损伤的敏感指标[15]。细胞损伤后,会产生大量的氧自由基和过氧化物,T-SOD催化氧自由基的歧化反应,是机体内清除氧自由基的主要酶之一;MDA为过氧化物的最终产物,可严重破坏细胞膜结构[16]。本研究表明,CGI能显著降低免疫性肝损伤小鼠肝组织中AST、ALT、AKP、GST、MDA水平,升高T-SOD水平,抑制自由基的产生并将其清除,抑制氧自由基引起的脂质过氧化反应,减少MDA生成,并降低肝毒性及减少肝细胞损伤导致的胆汁淤积,提示CG-I能有效防治免疫性肝损伤。
TNF-α由活化的T细胞产生,是具有重要生物活性的细胞因子,其对多种肿瘤细胞有细胞毒作用,与炎症疾病有密切关系。IL-1β是一种细胞因子,属于白细胞介素的一种,其是白细胞或免疫细胞间相互作用的淋巴因子。白细胞介素在传递信息,激活与调节免疫细胞,介导T、B细胞的活化、增殖与分化及在炎症反应中起重要作用[17]。本研究结果显示,CG-I能显著抑制免疫性肝损伤小鼠血清中TNF-α、IFN-γ和IL-1β等炎症因子的释放,能减轻Con A所引起的免疫性肝损伤,且以高剂量CG-I作用更为明显,并在实验剂量范围内显示出剂量依赖性。肝组织病理学观察结果也证实了CG-I能减轻肝损伤小鼠的肝细胞肿大、炎症细胞浸润以及坏死严重程度。
综上所述,CG-I对Con A所致免疫性肝损伤具有较好的保护作用,其机制可能与促进内源性氧自由基清除系统及抑制炎症因子的释放等有关。另外,从免疫性角度考虑,毛菊苣的保肝作用还可能具有免疫调节机制,但仍需进一步实验探究。
[1]Mokdad AH,Forouzanfar MH,Daoud F,et al.Global burden of diseases,injuries,and risk factorsforyoungpeople'shealthduring1990-2013:a systematic analysis for the global burden of disease study 2013[J].Lancet,2016,387(11):2383-2401.
[2]Pokorska- piewak M,Kowalik-Miko ajewska B,Aniszewska M,et al.Predictors of liver disease severity in children with chronic hepatitis B[J].Adv Clin Exp Med,2016,25(4):681-688.
[3]Friedman SL.Mechanisms of disease:mechanisms of hepatic fibrosis and therapeutic implications[J].NatClinPractGastroenterol Hepatol,2008,1(2):98-105.
[4]林兴,黄权芳,张士军,等.山芝麻水提取物对小鼠免疫性肝损伤的保护作用[J].中国现代应用药学,2012,29(1):1-5.
[5]贺国芳,丁伊玲,徐清霞,等.白芨及多糖预防免疫及化学性肝损伤[J].医药导报,2016,35(7):714-717.
[6]中国药品生物制品检定所.中国民族药志:第二卷[M].北京:人民卫生出版社,1990:476-481.
[7]国家药典委员会.中华人民共和国药典:一部[S].2015年版.北京:中国医药科技出版社,2015:310.
[8]Waseem R,Mohd F,Syed S,et al.Anti-inflammatoryactivityofrootsofCichoriumintybus due to its inhibitory effect on various cytokinesandantioxidantactivity[J].AncSci Life,2014,34(1):44-49.
[9]Su JH,Kim YW,Park Y,et al.Anti-inflammatory effects of chlorogenic acid in lipopolysaccharide-stimulatedRAW264.7cells[J].Inflamm Res,2014,63(1):81-90.
[10]Wu H,Su Z,Yang Y,et al.Isolation of three sesquiterpene lactones from the roots of Cichorium glandulosum Boiss.et Huet.by high-speed counter-currentchromatography[J].JChromatogr A,2007,1176(1/2):217-222.
[11]秦冬梅,胡利萍,文志平,等.维药毛菊苣提取物对小鼠四氯化碳急性肝损伤的保护作用[J].中国药理学通报,2012,28(8):1180-1181.
[12]秦冬梅,胡利萍,曹文江,等.维药菊苣提取物对小鼠酒精性肝损伤的保护作用[J].中国实验方剂学杂志,2011,17(7):128-131.
[13]徐博,沈楠,安英,等.汉防己多糖对急性酒精性肝损伤小鼠氧化应激及肝细胞凋亡的影响[J].中国药房,2017,28(7):885-888.
[14]冯海荣,郑轶,常海茹,等.紫叶李果实总黄酮对大鼠酒精性肝损伤保护作用机制研究[J].中国药房,2017,28(10):1332-1337.
[15]王华,徐德祥,王安连,等.N-乙酰半胱氨酸对小鼠免疫性肝损伤的影响[J].中国药理学通报,2007,23(4):468-470.
[16]中华人民共和国卫生部药典委员会.中华人民共和国卫生部药品标准:维吾尔药分册[S].乌鲁木齐:新疆科技卫生出版社,1999:136、159、164、189.
[17]Wang LN,Li ZZ,Zhang XJ,et al.Protective effectofshikonininexperimentalischemic stroke:attenuatedTLR4,p-p38MAPK,NF-κB,TNF-α and MMP-9 expression,up-regulated claudin-5 expression,ameliorated BBB[J].Neurochem Res,2014,39(1):97-106.
Study on the Protective Effect and Mechanism of Wei Medicine Cichorium glandulosum 95%%Ethanol Extract on Con-A-induced Immunological Liver Injury in Mice
HU Liping1,ZHANG Yu2,QIN Dongmei2,ABAGULI·Aibaidula1,NULIBIYA·Abudukeyoumu1,SUN Xiaofeng1,ZHANG Yuexin1(1.Dept.of Infection,the First Hospital of Xinjiang Medical University,Urumqi 830054,China;2.College of Pharmacy,Shihezi University,Xinjiang Shihezi 832002,China)
OBJECTIVE:To investigate the protective effect and mechanism of Wei medicine Cichorium glandulosum 95%ethanol extract(CG-I)on immunological liver injury in mice,and provide reference for post-screening its effective site.METHODS:60 mice were randomly divided into blank control group(normal saline),model group(normal saline),positive control group(Diammonium glycyrrhizinate,100 mg/kg)and CG-I high-dose,medium-dose,low-dose groups(calculated by crude drugs as 200,100,50 g/kg),10 in each group,intragastrically administrated once every day,for 10 d.After 1 h of last administration,except for blank control group,mice in other groups were intravenously injected Con-A in tail to induce immunological liver injury.After 8 h of modeling,tumor necrosis factor α(TNF-α),interferon γ(IFN-γ),interleukin 1β(IL-1β)contents in serum were detected;liver and spleen indexes were calculated.The pathological changes in liver tissue were observed,and aspartate aminotransferase(AST),alanine aminotransferase(ALT),glutathione S-transferase(GST),alkaline phosphatase(AKP),total superoxide dismutase(T-SOD),malondialdehyde(MDA)levels in liver tissue were detected.RESULTS:Compared with blank control group,TNF-α,IFN-γ,IL-1β contents in serum in model group were significantly increased;liver,spleen indexes and AST,ALT,GST,AKP,T-SOD levels in liver tissue were significantly increased;and MDA level in liver tissue was significantly reduced,with statistical significances(P<0.05 or P<0.01);liver of mice in model group was cluttered,showing swelling,necrosis and other diseases in liver cells.Compared with model group,except that AST,ALT,AKP levels in liver tissue in CG-I low-dose group and MDA,IFN-γ contents in serum in CG-I medium-dose,low-dose groups had no signifi-cant decrease,other indexes were significantly improved(P<0.05 or P<0.01);and pathological changes in liver tissue were relieved to varying degrees.CONCLUSIONS:CG-I shows protective effect on Con-A-induced immunological liver injury in mice,especially the high dose and medium dose.The mechanism may be associated with its anti-oxidation and anti-inflammatory effects.
Wei medicine;Cichorium glandulosum;95%ethanol extract;Immunological liver injury;Anti-oxidant;Anti-inflammatory;Mice
R285.5
A
1001-0408(2017)34-4830-05
DOI10.6039/j.issn.1001-0408.2017.34.20
新疆维吾尔自治区自然科学基金资助项目(No.2015211C048)
*主治医师,讲师,硕士。研究方向:肝病及感染性疾病。电话:0991-4363441。E-mail:ping200707@163.com
#通信作者:副教授,硕士生导师,博士。研究方向:中药民族药研究及制剂开发。电话:0993-2057010。E-mail:dongmeiqinli@163.com
2017-05-03
2017-09-13)
(编辑:林静)
