地西他滨抑制A431细胞生物学功能的机制
2017-12-19徐道知欧阳玲
徐道知,欧阳玲
(1. 中国医科大学附属盛京医院妇产科,沈阳 110004; 2. 沈阳医学院附属第二医院普外科,沈阳 110035)
地西他滨抑制A431细胞生物学功能的机制
徐道知1,2,欧阳玲1
(1. 中国医科大学附属盛京医院妇产科,沈阳 110004; 2. 沈阳医学院附属第二医院普外科,沈阳 110035)
目的检测地西他滨对A431细胞生物学功能的影响并初步探讨其机制。方法将0、5、10和20 μ mol/L的地西他滨分别作用于A431细胞,通过MTT法观察地西他滨对细胞增殖的影响,通过Western blotting和实时PCR检测地西他滨作用于A431细胞后细胞增殖相关蛋白Cyclin B1、PCNA和CDC2的改变。通过Hoechst 33258染色检测0、5和10 μ mol/L地西他滨对A431细胞凋亡状态的影响,采用Western blotting和实时PCR检测地西他滨对A431细胞凋亡相关蛋白Bax和Bcl-2的影响。采用transwell实验检测细胞侵袭转移情况,并通过Western blotting和实时PCR检测0、5和10 μ mol/L的地西他滨对侵袭转移相关蛋白MMP2的影响。结果MTT检测发现,5、10和20 μ mol/L的地西他滨作用于A431细胞24 h后对细胞增殖的抑制率分别为 (43.81±1.53) %、(48.64±4.65) %和 (50.69±4.99) %,随着药物的浓度增加,对A431细胞的增殖抑制率显著增加 (P < 0.05) 。Hoechst 33258染色发现,地西他滨可以显著促进细胞凋亡,transwell实验也证明地西他滨可以明显抑制A431细胞的转移能力。Western blotting和实时PCR结果显示,地西他滨影响A431细胞中Cyclin B1、CDC2、PCNA、Bax、Bcl-2和MMP2蛋白及mRNA水平,地西他滨处理组与对照组比较,差异均有统计学意义 (P < 0.05) 。结论地西他滨对外阴鳞状细胞癌的生物学功能有很强的抑制作用,可以作为治疗外阴鳞状细胞癌的化疗药物。
地西他滨; A431; 增殖; 凋亡; 转移
外阴鳞状细胞癌的预后相对不良,目前的治疗方式一般以手术为主,并且配合放化疗的使用[1-2],但是由于放化疗药物的不良反应明显以及根治性手术经常导致严重术后并发症、局部畸形及功能障碍,显著降低了患者的生存质量。因此,有必要寻找一种更好的化疗药物或者化疗辅助药物。地西他滨是一种2’-脱氧胞苷类似物,具有极强的抗肿瘤活性,而且不同剂量作用机制不尽相同,高浓度地西他滨具有较强的细胞毒性作用,低浓度时具有去甲基化作用[3]。地西他滨通常作用于细胞的G2/M期,将细胞周期阻滞于G2/M期,进而抑制细胞增殖[4]。地西他滨的去甲基化作用可以在体内、体外通过抑制DNA甲基转移酶使抑癌基因恢复正常的去甲基状态,重新激活那些由于DNA过度甲基化而失活的基因,使细胞恢复正常终末分化、衰老或凋亡[5-7]。目前地西他滨主要用于白血病的治疗,对肠癌和乳腺癌等实体瘤也有一定的抗肿瘤效果[8]。很多研究证实,地西他滨可以抑制肺癌、膀胱癌和胃癌等多种肿瘤细胞的生长与侵袭,但是关于地西他滨对外阴鳞状细胞癌的作用研究较少[9]。
本研究以人外阴鳞状细胞癌细胞系A431为研究对象,探讨地西他滨对A431细胞生长与转移功能的抑制作用,进一步初步探索其抑制机制,为临床上寻找更好的外阴鳞状细胞癌治疗方案提供理论基础。
1 材料与方法
1.1 材料
人外阴鳞状细胞癌细胞系A431 (实验室冻存) ,DMEM培养基 (美国Hyclone) ,胎牛血清 (天津灏洋),地西他滨 (江苏豪森) ,四甲基偶氮唑蓝、DMSO (美国Sigma) ,台盼蓝 (上海碧云天) 。
1.2 方法
1.2.1 细胞培养和分组:将A431细胞接种于含体积分数10%灭活胎牛血清的DMEM培养基中,置37 ℃、体积分数5%CO2培养箱中培养。
1.2.2 MTT实验:将处于对数生长期的细胞消化传代,以1×104/mL浓度接种于96孔培养板中,终体积200 μ L。将细胞分为对照组( 0 μ mol/L地西他滨)、5 μ mol/L地西他滨组、10 μ mol/L地西他滨组和20 μ mol/L地西他滨组。处理后的细胞于0、12、24、36、48 h和60 h( 每个浓度每个时间点分别设3个副孔) 分别加入5 mg/mL MTT溶液10 μ L,置37 ℃、体积分数5%CO2培养箱中培养4 h后,弃上清,每孔中加入200 μ L DMSO,震荡10 min后在490 nm处记录吸光( optical density,OD) 值。药物对细胞抑制率计算方法:细胞生长抑制率( %) =( 对照组OD值-药物组OD值) /对照组OD值×100。
1.2.3 Hoechst 33258染色:将对数生长期的细胞制成1×106/L浓度的细胞悬液接种于6孔板中,贴壁培养24 h后,将细胞分为对照组( 0 μ mol/L地西他滨) 、5 μ mol/L地西他滨组和10 μ mol/L地西他滨组。药物作用24 h后,每孔加入100 μ L Hoechst 33258孵育染色15 min,PBS洗净后,用荧光显微镜观察细胞凋亡情况。
1.2.4 transwell实验:取对数生长期细胞以1×105/mL浓度接种于上室中,终体积200 μ L,下室加入600 μ L双无培养基,细胞培养12 h后更换培养基,将细胞分为对照组( 0 μ mol/L地西他滨) 、5 μ mol/L地西他滨组和10 μ mol/L地西他滨组,各组均设3个副孔。24 h后取出小室,棉签擦去上层细胞,PBS清洗后95%乙醇固定20 min,4%台盼蓝染色20 min,200倍显微镜下观察。药物对细胞的抑制率计算公式:抑制率(%) =1-( 剂量组平均细胞数/对照组平均细胞数) ×100。
1.2.5 Western blotting:实验所用细胞分为对照组( 0 μ mol/L地西他滨) 、5 μ mol/L地西他滨组和10 μ mol/L地西他滨组,药物作用24 h后,使用RIPA裂解液搜集并裂解细胞,提取蛋白,通过G250定量后。取30 μ g蛋白进行电泳( 80~120 V) 、转膜( 100 V,1 h) 后,用5%脱脂奶粉室温封闭1 h。一抗4 ℃过夜后TBST清洗3次。二抗室温1 h后TBST清洗3次。Cyclin B1、CDC2、PCNA、Bax、Bcl-2、MMP2和GAPDH抗体及二抗均购置美国Santa公司。
1.2.6 实时PCR:实验用细胞分为对照组( 0 μ mol/L地西他滨)、5 μ mol/L地西他滨组和10 μ mol/L地西他滨组,药物作用24 h后,Trizol法提取RNA,反转录成cDNA,进行实时PCR反应。所用引物:Cyclin B1,正 向5’-CATTATTGATCGGTTCATGC-3’, 反 向5’-CTAGTGCAGAATTCAGCTGTGGTA-3’;CDC2,正 向5’-GAAGATTATACCAAAATAGAGA-3’,反 向5’-CTACATCTTCTTAATCTCTGATTGTCC-3’;Bcl-2,正向5’-GGTGAACTGGGGGAGGATTG-3’,反向5’-G GCAGGCATGTTGACTTCAC-3’; Bax,正向5’-AGCT GAGCGAGTGTCTCAAG-3’,反向5’-GTCCAATGTCC AGCCCATGA-3’;MMP2,正向5’-CGCATCTGGGGCT TTAAACAT-3’;反向5’-TCAGCACAAACAGGTTGCA G-3’;PCNA,正向5’-TTTGAGGCACGCCTGATC-3’;反向5’-GATCAGGCGTGCCTCAAA-3’;GAPDH,正向5’-GGCAAATTCAACGGCACAGT-3’;反向5’-TAGG GCCTCTCTTGCTCAGT-3’。
1.3 统计学分析
采用SPSS 17.0软件进行统计学分析,组间比较采用非配对 t 检验分析,P < 0.05为差异有统计学意义。
2 结果
2.1 地西他滨对A431细胞增殖的影响
不同浓度的地西他滨作用于A431细胞0 、12、24、36、48和60 h后,显著抑制A431细胞的增殖,与对照组比较有统计学差异 (P < 0.05) ,且地西他滨对细胞增殖的抑制作用随着浓度的增加而增加。见表1。
2.2 不同浓度地西他滨对A431细胞增殖相关蛋白的影响
不同浓度地西他滨对Cyclin B1、PCNA和CDC2蛋白及mRNA水平均有一定程度的抑制作用,随着药物浓度的升高抑制作用增强。5 μ mol/L和10 μ mol/L地西他滨作用后,Cyclin B1、CDC2、PCNA蛋白和mRNA水平均显著下调,与对照组比较有统计学差异(P < 0.05),10 μ mol/L地西他滨组与5 μ mol/L地西他滨组比较,Cyclin B1、CDC2和PCNA蛋白和mRNA水平的差异也有统计学意义(P < 0.05)。见图1。

表1 不同剂量的地西他滨对A431细胞增殖的抑制率 (%)Tab.1 Inhibition of the proliferation of A431 cells treated with different decitabine concentrations(%)
2.3 不同浓度地西他滨对A431细胞凋亡的影响
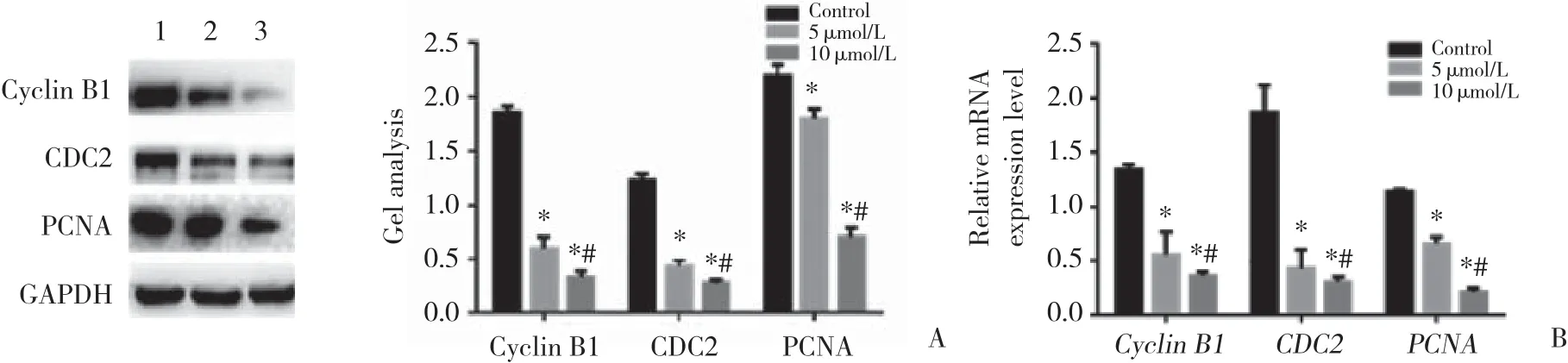
图1 不同浓度地西他滨作用下A431细胞增殖相关蛋白的变化Fig.1 Proteins related to the proliferation of A431 cells treated with different decitabine concentrations
Hoechst 33258染色 (图2) 结果显示,地西他滨可以促进A431细胞的凋亡,随着药物浓度的增加,凋亡细胞明显增加。不同浓度地西他滨对Bax和Bcl-2蛋白和mRNA水平均有一定程度的影响,随着药物浓度的升高作用增强。5 μ mol/L和10 μ mol/L地西他滨作用后Bax蛋白和mRNA水平均显著上调,Bcl-2蛋白和mRNA水平均显著下调,与对照组比较有统计学差异(P < 0.05),10 μ mol/L地西他滨组与5 μ mol/L地西他滨组比较,Bax和Bcl-2蛋白和mRNA水平的差异也有统计学意义(P < 0.05)。见图3。
2.4 不同浓度地西他滨对A431细胞转移的影响

图2 不同剂量地西他滨作用下A431细胞的凋亡情况Fig.2 Apoptosis of A431 cells treated with different decitabine concentrations
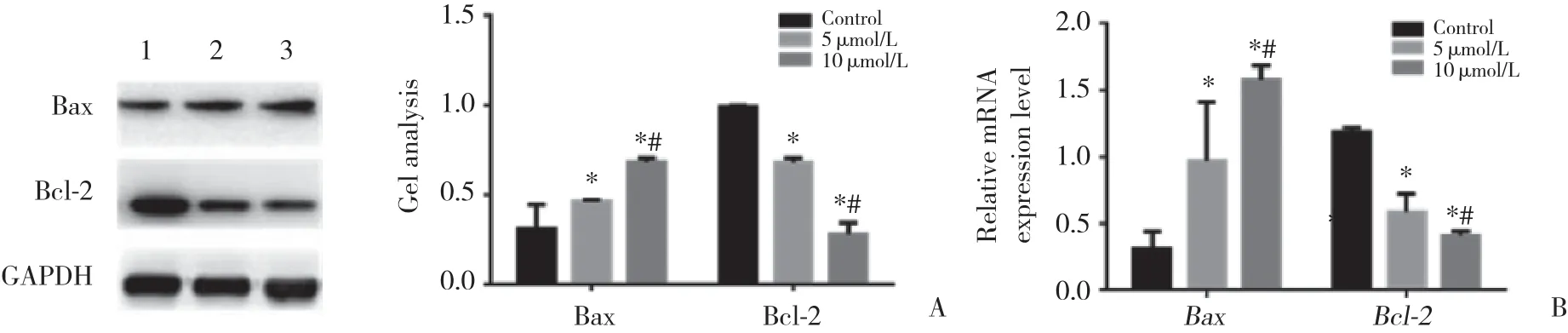
图3 不同浓度地西他滨作用下A431细胞凋亡相关蛋白的变化Fig.3 Proteins related to the apoptosis of A431 cells treated with different decitabine concentrations
台盼蓝染色 (图4) 结果显示,地西他滨可以抑制A431细胞的转移。对照组、5 μ mol/L地西他滨组、10 μ mol/L地西他滨组的转移细胞数分别为153.76±4.63、121.24±14.92、79.37±24.35,随着药物浓度的增加,转移细胞数目减少,5 μ mol/L地西他滨组、10 μ mol/L地西他滨组与对照组比较,10 μ mol/L地西他滨组与5 μ mol/L地西他滨组比较,差异均有统计学意义 (P < 0.05) 。
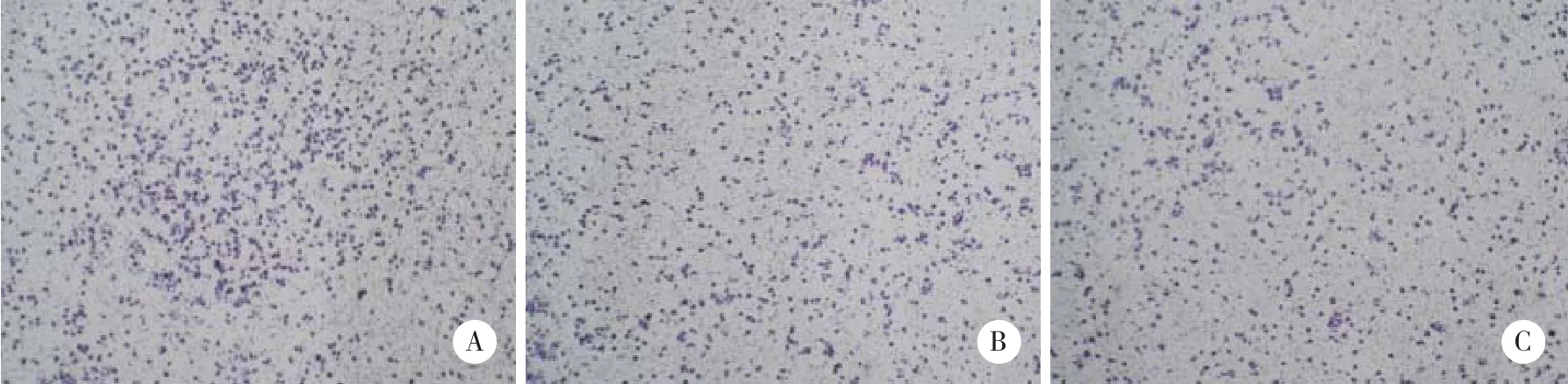
图4 不同浓度的地西他滨作用下A431细胞的转移情况Fig.4 Migration of A431 cells treated with different decitabine concentrations
不同浓度地西他滨对MMP2有一定程度的抑制作用,随着药物浓度的升高抑制作用增强,5 μ mol/L地西他滨组、10 μ mol/L地西他滨组与对照组比较,10 μ mol/L地西他滨组与5 μ mol/L地西他滨组比较,MMP2蛋白和mRNA水平的差异均有统计学意义(P < 0.05) 。见图5。
3 讨论
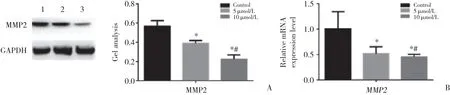
图5 不同浓度地西他滨作用下A431细胞迁移相关蛋白的变化Fig.5 Proteins related to the migration of A431 cells treated with different decitabine concentrations
地西他滨作为一种治疗原发性和继发性骨髓增生异常的化疗药物,目前被很多研究人员用于实体肿瘤实验中[10],地西他滨目前对实体肿瘤的治疗仍处于临床试验阶段。地西他滨可以通过活化肿瘤细胞中异常甲基化的细胞周期相关基因来激活肿瘤内抑癌基因的表达[11],地西他滨还可以恢复肿瘤细胞对化疗药物的敏感性[12]。研究[13]表明,地西他滨单独应用时对肿瘤的增殖抑制作用可能并不明显,但是可以显著增加肿瘤细胞对顺铂、卡铂、表柔比星等多种抗肿瘤药物的敏感性。地西他滨在体外可以明显逆转胃癌顺铂耐药细胞株,抑制其抑癌基因的甲基化状态来恢复抑癌基因的表达。也有报道指出,地西他滨可以通过调节p21等蛋白的表达,明显将细胞周期抑制在G2/M期。地西他滨也可以显著增加细胞的凋亡来抑制肿瘤细胞的生长。
本研究通过将不同浓度的地西他滨作用于A431细胞中,发现地西他滨可以明显抑制A431细胞的增殖。进一步实验发现地西他滨可以显著下调A431细胞中Cyclin B1与CDC2蛋白的表达。高等真核生物通过长期进化过程逐渐形成了多层次的细胞周期调控通路,这些调控通路都集中在细胞周期依赖蛋白激酶的调节上。其中Cyclin B1的合成、降解以及亚细胞定位均对有丝分裂的调控起着重要作用,Cyclin B1参与细胞周期监测点的调控,也维持基因组的稳定性[14]。很多报道指出,Cyclin B1的异常表达与肿瘤的发生发展、侵袭转移以及预后密切相关。在调节G2/M期进程时,Cyclin B1通过与CDC2蛋白结合共同发挥作用,PCNA本身与细胞的甲基化水平密切相关,也与细胞增殖关系密切[15-16]。有研究指出,地西他滨可以调节肿瘤细胞的G2/M期。本研究也发现地西他滨可以抑制A431细胞的增殖,进一步检测地西他滨对Cyclin B1、CDC2蛋白的作用,结果发现地西他滨可以通过抑制Cyclin B1、PCNA与CDC2蛋白的表达来抑制A431细胞的增殖。
本研究发现地西他滨可以促进A431细胞的凋亡,通过检测凋亡相关的经典蛋白Bax与Bcl-2,结果发现地西他滨可以通过调节其活性来促进A431细胞的凋亡,进一步加强了地西他滨抑制A431细胞生长的水平。
临床观察表明,肿瘤患者大多死于肿瘤的侵袭转移,因此肿瘤细胞的侵袭转移是众多研究人员的关注热点。目前的研究表明,基质金属蛋白酶家族可以有效地降解细胞外基质成分,破坏基底膜,为肿瘤的侵袭转移提供了便利。MMP2是基质金属蛋白酶家族中的重要成员[17-18]。本研究通过transwell实验检测发现,地西他滨对A431细胞的转移功能有一定的抑制作用,进而检测了地西他滨对MMP2蛋白的作用,结果发现地西他滨可以显著抑制MMP2的表达。
综上所述,地西他滨可以通过抑制A431细胞的增殖,促进其凋亡来抑制A431细胞的生长,地西他滨也可以抑制A431细胞的转移功能。由此可见,地西他滨可以成为治疗外阴鳞状细胞癌的潜在药物。
[1] 曹泽毅,乔杰.妇产科学[M]. 北京:人民卫生出版社,2014:246.
[2] HORDING U,JUNGE J,DAUGAARD S,et al. Vulvar squamous cell carcinoma and papillomaviruses:indication for two different etiologies [J]. Gynecol Oncol,1994,52 (2) :241-246. DOI:10.1006/gyno.1994.1039.
[3] 柳凤芝,何玲,王季石,等. 地西他滨对白血病细胞DKK1基因去甲基化的实验研究[J]. 中国实验血液学杂志,2016,24 (1) :56-60. DOI:10.7534/j.issn.1009-2137.2016.01.011.
[4] CRUIJSEN M,HOBO W,VAN DER VELDEN WJFM,et al. Addition of 10-day decitabine to fludarabine/total body irradiation conditioning is feasible and induces tumor-associated antigen-specific T cell responses[ J]. Biol Blood Marrow Transplant,2016,22( 6) :1000-1008.DOI:10.1016/j.bbmt.2016.02.003.
[5] DAVER N,KANTARJIAN H,RAVANDI F,et al. A phase Ⅱ study of decitabine and gemtuzumab ozogamicin in newly diagnosed and relapsed acute myeloid leukemia and high-risk myelodysplastic syndrome[ J]. Leukemia,2016,30( 2) :268-273. DOI:10.1038/leu.2015.244.
[6] GENG S,YAO H,WENG J,et al. Effects of the combination of decitabine and homoharringtonine in SKM-1 and Kg-1a cells[ J]. Leukemia Research,2016,44:17-24. DOI:10.1016/j.leukres.2016.02.002.
[7] HE ZH,CHEN Y,CHEN P,et al. Decitabine enhances stem cell antigen-1 expression in cigarette smoke extract-induced emphysema in animal model[ J]. Exp Biol Med( Maywood),2016,241( 2) :131-139. DOI:10.1177/1535370215598402.
[8] LEE JY,LEE SM,LEE JY,et al. Mixed-phenotype acute leukemia treated with decitabine[ J]. Korean J Intern Med,2016,31( 2) :406-408. DOI:10.3904/kjim.2014.353.
[9] HORTON JD,ARBINI AA,PERLE MA,et al. Rapid and robust reversion to essential thrombocythemia on treatment with decitabine in a case of hydroxyurea-induced t-MDS/AML[ J]. Clin Case Rep,2015,4( 1) :46-50. DOI:10.1002/ccr3.431.
[10] MAWAD R,BECKER PS,HENDRIE P,et al. PhaseⅡstudy of tosedostat with cytarabine or decitabine in newly diagnosed older patients with acute myeloid leukaemia or high-risk MDS[ J]. Br J Haematol,2016,172( 2) :238-245. DOI:10.1111/bjh.13829.
[11] WU L,SHI W,LI X,et al. High expression of the human equilibrative nucleoside transporter 1 gene predicts a good response to decitabine in patients with myelodysplastic syndrome[ J]. J Transl Med,2016,14:66. DOI:10.1186/s12967-016-0817-9.
[12] LU BY,THANAWALA SU,ZOCHOWSKI KC,et al. Decitabine enhances chemosensitivity of early T-cell precursor-acute lymphoblastic leukemia cell lines and patient-derived samples[ J]. Leuk Lymphoma,2016,52( 8) :1938-1941. DOI:10.3109/10428194.2015.1110747.
[13] ZHANG LY,YUAN YQ,ZHOU DM,et al. Impact of global and gene-specific dna methylation in de novo or relapsed acute myeloid leukemia patients treated with decitabine[ J]. Asian Pac J Cancer Prev,2016,17( 1) :431-437.
[14] CHAE SW,SOHN JH,KIM DH,et al. Overexpressions of Cyclin B1,cdc2,p16 and p53 in human breast cancer:the clinicopathologic correlations and prognostic implications[ J]. Yonsei Med J,2011,52(3) :445-453. DOI:10.3349/ymj.2011.52.3.445.
[15] CHOI HJ,ZHU BT. Critical role of cyclin B1/Cdc2 up-regulation in the induction of mitotic prometaphase arrest in human breast cancer cells treated with 2-methoxyestradiol[ J]. Biochim Biophys Acta,2012,1823( 8) :1306-1315. DOI:10.1016/j.bbamcr.2012.05.003.
[16] CHOI HJ,FUKUI M,ZHU BT. Role of cyclin B1/Cdc2 up-regulation in the development of mitotic prometaphase arrest in human breast cancer cells treated with nocodazole[ J]. PLoS One,2011,6( 8) :e24312. DOI:10.1371/journal.pone.0024312.
[17] TABOURET E,BERTUCCI F,PIERGA JY,et al. MMP2 and MMP9 serum levels are associated with favorable outcome in patients with inflammatory breast cancer treated with bevacizumab-based neoadjuvant chemotherapy in the BEVERLY-2 study[ J]. Oncotarget,2016,7( 14) :18531-18540. DOI:10.18632/oncotarget.7612.
[18] CHAN YC,CHEN CW,CHAN MH,et al. MMP2-sensing up-conversion nanoparticle for fluorescence biosensing in head and neck cancer cells[ J]. Biosens Bioelectron,2016,80:131-139. DOI:10.1016/j.bios.2016.01.049.
Mechanism of the Inhibition of Decitabine in A431 Cells
XU Daozhi1,2,OUYANG Ling1
(1. Department of Obstetrics and Gynecology,Shengjing Hospital,China Medical University,Shenyang 110004,China; 2. Department of General Surgery,The Second Hospital of Shenyang Medical College,Shenyang 110035,China)
ObjectiveTo investigate the effect of decitabine on the biological function of A431 cells and examine its mechanism.MethodsDifferent concentrations (5,10,and 20 μ mol/L) of decitabine were used to treat A431 cells. The effect of decitabine on cell proliferation was observed on MTT . Hoechst 33258 staining was used to detect A431 cell apoptosis after the administration of decitabine. The metastasis of A431 cells was detected via transwell assay. The expressions of the proteins related to cell proliferation,apoptosis,invasion,and metastasis were detected using Western blotting and real-time polymerase chain reaction (PCR) .ResultsThe MTT assay revealed that after treatment with 5,10,and 20 μ mol/L decitabine,the inhibition rates of cell proliferation were 43.81% ± 1.53%,48.64% ± 4.65%,and 50.69% ± 4.99%. With the increase in drug concentration,the rate of inhibition of A431 cell proliferation increased significantly (P< 0.05) . Hoechst 33258 staining showed that this treatment could promote apoptosis significantly. The transwell experiments showed that decitabine significantly inhibited the metastasis of A431 cells. Western blotting and real-time PCR showed that the expressions of Cyclin B1,CDC2,Bax,Bcl-2 and MMP2 protein and mRNA in A431 cells were significantly affected by decitabine (P < 0.05) .ConclusionDecitabine has a strong inhibitory effect on the biological function of vulvar squamous cell carcinoma and can be used as a chemotherapeutic agent for vulvar squamous cell carcinoma.
decitabine; A431; proliferation; apoptosis; metastasis
R737.35
A
0258-4646 (2017) 12-1105-06
http://kns.cnki.net/kcms/detail/21.1227.R.20171130.1810.020.html
10.12007/j.issn.0258-4646.2017.12.011
沈阳市科学技术计划 (F15-199-1-34)
徐道知 (1987-) ,男,医师,硕士研究生.
欧阳玲,E-mail:ouyang1964@163.com
2016-07-13
网络出版时间:2017-11-30 18:10
(编辑 陈 姜)
