不可手术局部晚期非小细胞肺癌放化疗安全性及疗效分析
2017-12-19袁梦韩琤波马洁韬黄乐天张树玲孙丽
袁梦,韩琤波,马洁韬,黄乐天,张树玲,孙丽
(中国医科大学附属盛京医院肿瘤科,沈阳 110022)
不可手术局部晚期非小细胞肺癌放化疗安全性及疗效分析
袁梦,韩琤波,马洁韬,黄乐天,张树玲,孙丽
(中国医科大学附属盛京医院肿瘤科,沈阳 110022)
目的回顾性分析不可手术局部晚期非小细胞肺癌(LA-NSCLC)的放化疗疗效和安全性及影响其预后的因素。方法收集2010年1月至2015年12月于我科治疗的不可手术LA-NSCLC患者98例。其中单纯放疗组26例、同步放化疗组37例、序贯放化疗组35例,统计其无进展生存期(PFS)及总生存时间(OS)。采用Kaplan-Meier绘制生存曲线,并用log-rank/Breslow检验进行组间比较;单因素和COX多因素回归分析PFS和OS的独立预后因素。结果序贯放化疗组的中位PFS优于单纯放疗组,同步及序贯放化疗的中位OS均优于单纯放疗组(P < 0.05)。较早的淋巴结分期、双药联合化疗及联合应用放化疗是PFS获益的独立影响因素;较早的淋巴结分期是OS获益的独立影响因素;总体治疗安全性良好,血液学毒性与化疗方案及患者的KPS评分相关(P < 0.05)。结论对于LA-NSCLC,较早的淋巴结分期、双药联合化疗及联合应用放化疗治疗是PFS获益的独立影响因素;较早的淋巴结分期是OS获益的独立影响因素。总体治疗安全性良好,但联合化疗和较低的KPS评分会增加血液学毒性。
局部晚期; 非小细胞肺癌; 生存; 临床疗效; 毒性反应
肺癌是世界上最常见的恶性肿瘤之一,也是癌症相关死亡的首要疾病[1]。肺癌中约80%为非小细胞肺癌(non-small cell lung cancer,NSCLC),其中大约1/3的患者发现时已发展为局部晚期[2]。局部晚期非小细胞肺癌(locally advanced non-small cell lung cancer,LA-NSCLC)一般是指ⅢA/ⅢB期NSCLC患者,目前对于不可手术的LA-NSCLC同步放化疗是其标准治疗[3],但因同步放化疗毒性反应较大,或许更适合体力状态较好、能够耐受不良反应的患者[4]。一些靶向药物的临床试验目前也尚未得到改善生存的结果[5-6]。本研究中收集了2010年1月至2015年12月于我科治疗的LA-NSCLC患者98例,采用了单纯放疗、序贯放化疗或同步放化疗治疗,对不同的治疗模式的疗效及安全性进行了比较,并分析影响LA-NSCLC患者生存和安全性的预后因素,为LA-NSCLC患者的治疗及预后提供参考。
1 材料与方法
1.1 病例入选和排除标准
入选标准:(1)经病理组织或细胞学确诊的初诊NSCLC患者,既往未接受过放化疗;(2) 经多学科评估为不可手术且临床分期为ⅢA或ⅢB期(AJCC第7版)的患者。排除标准:(1) 合并其他肿瘤;(2) 合并严重内科疾病。
1.2 方法
记录患者的基本特征、肿瘤特征、治疗相关因素。治疗模式分为单纯放疗、同步放化疗及序贯放化疗。
1.3 疗效评价及毒性反应
统计患者的无进展生存期(progression-free survival,PFS)、总生存时间(overall survival,OS)及客观缓解率(objective response rate,ORR)。治疗结束后1~3个月内复查,并按照实体瘤的疗效评价标准1.1版评价疗效。治疗相关毒性反应根据NCI-CTC 3.0毒性反应评价标准进行评价。
1.4 随访
采用电话、公安户籍查询等形式随访,结束时间为2016年1月10日。
1.5 统计学分析
应用SPSS 19.0软件,计数资料采用χ2检验,计量资料采用单因素方差分析,生存曲线采用Kaplan-Meier绘制,生存比较采用log rank/Breslow检验;采用COX多因素回归分析PFS和OS的独立预后因素。P < 0.05为差异有统计学意义。
2 结果
2.1 入组患者临床资料
98例患者中,不同治疗模式的基本资料分布无统计学差异(P > 0.05),见表1。
2.2 疗效评价
治疗结束后1~3个月内复查并评价疗效,98例患者中,部分缓解患者25例、稳定患者64例,进展患者7例。ORR为26.04%,疾病控制率92.70%,临床疗效在KPS评分、性别上分布有统计学差异(P < 0.05),男、女患者的疾病控制率分别为97.5%、70.6%。KPS评分70、80和90分患者疾病控制率分别为50.0%、92.7%和96.1%。
2.3 生存情况
患者的PFS和OS分别为8.9(95%CI:8.30~9.50)个月及22.2(95%CI:17.43~27.04)个月,单纯放疗组、同步放化疗组、序贯放化疗组的中位PFS分别为5.53个月、8.60个月和11.53个月,其中序贯放化疗组的中位PFS明显优于单纯放疗组(P = 0.015)。单纯放疗组、同步放化疗组、序贯放化疗组的中位OS分别为14.5个月、20.8个月和30.7个月,其中同步放化疗组中位OS明显优于单纯放疗组(P = 0.04),序贯放化疗组的中位OS明显优于单纯放疗组(P = 0.04)。见图1。
2.3.1 单因素分析:将年龄、性别、肿瘤部位、放疗剂量等相关因素分别对PFS及OS进行单因素分析。结果表明,PFS在淋巴结分期、化疗药物中的分布有统计学差异(P < 0.05);OS在淋巴结分期的分布有统计学差异(P < 0.05),见表2。
2.3.2 多因素分析:将单因素分析结果中P < 0.1的变量纳入对PFS及OS的多因素分析中,另外将治疗模式纳入。结果表明,在PFS的多因素分析中,最终进入COX回归方程的变量为放化疗模式、化疗方案及淋巴结分期;在OS的多因素分析中,最终进入回归的变量为淋巴结分期,见表3。
2.4 安全性分析
患者3/4级放射性肺炎发生率1.0%,在不同因素中的分布除了性别有差异外(P < 0.05),其他均无差异;无3/4级放射性食管炎发生;3/4级血液毒性发生率为20.4%,血液毒性在化疗方案、KPS评分上分布有统计学差异(P < 0.05),含铂双药联合方案、单药化疗及未化疗患者的3/4级血液毒性发生率分别为26.2%、14.3%及8.3%;KPS为70、80、90分 的 患 者3/4级血液毒性发生率分别为50.0%、21.4%和17.3%。
3 讨论
目前,不可手术LA-NSCLC标准治疗是放疗和化疗综合治疗,而同步放化疗相比序贯放化疗能获得更长的生存受益[3-4],但因毒性反应较大,同步放化疗更适宜体力状态耐受良好的患者。 本研究中,放疗和化疗联合治疗较单纯放疗在PFS及OS上均存在一定的优势,但序贯放化疗与同步放化疗之间的PFS、OS对比差异无统计学意义,原因可能是由于本研究属于回顾性研究,不强制分组,医生可根据患者KPS、合并疾病和年龄等因素对化疗方案和治疗模式进行人为选择。虽然本研究中序贯放化疗和同步放化疗在患者OS和PFS上均未看到差异,但结果显示,使用以铂类为基础的双药联合化疗的患者生存会更好。目前诱导化疗及巩固化疗均未得到阳性结果,那么若对诱导化疗、巩固化疗及同步化疗的方案加以调整是否可影响患者生存,这些问题在本研究中并未进一步分析。本研究通过单因素和多因素分析显示,放化疗联合治疗较单纯放疗并未增加毒性反应,但在放化疗联合治疗中使用双药联合化疗或患者KPS评分较低会增加患者的血液毒性,这与前述不同,分析原因可能是病例数较少,且本研究中不论是序贯放化疗组还是同步放化疗组,都未对化疗方案进行限制,部分患者采用单药化疗或化疗周期数较少,影响分析结果。
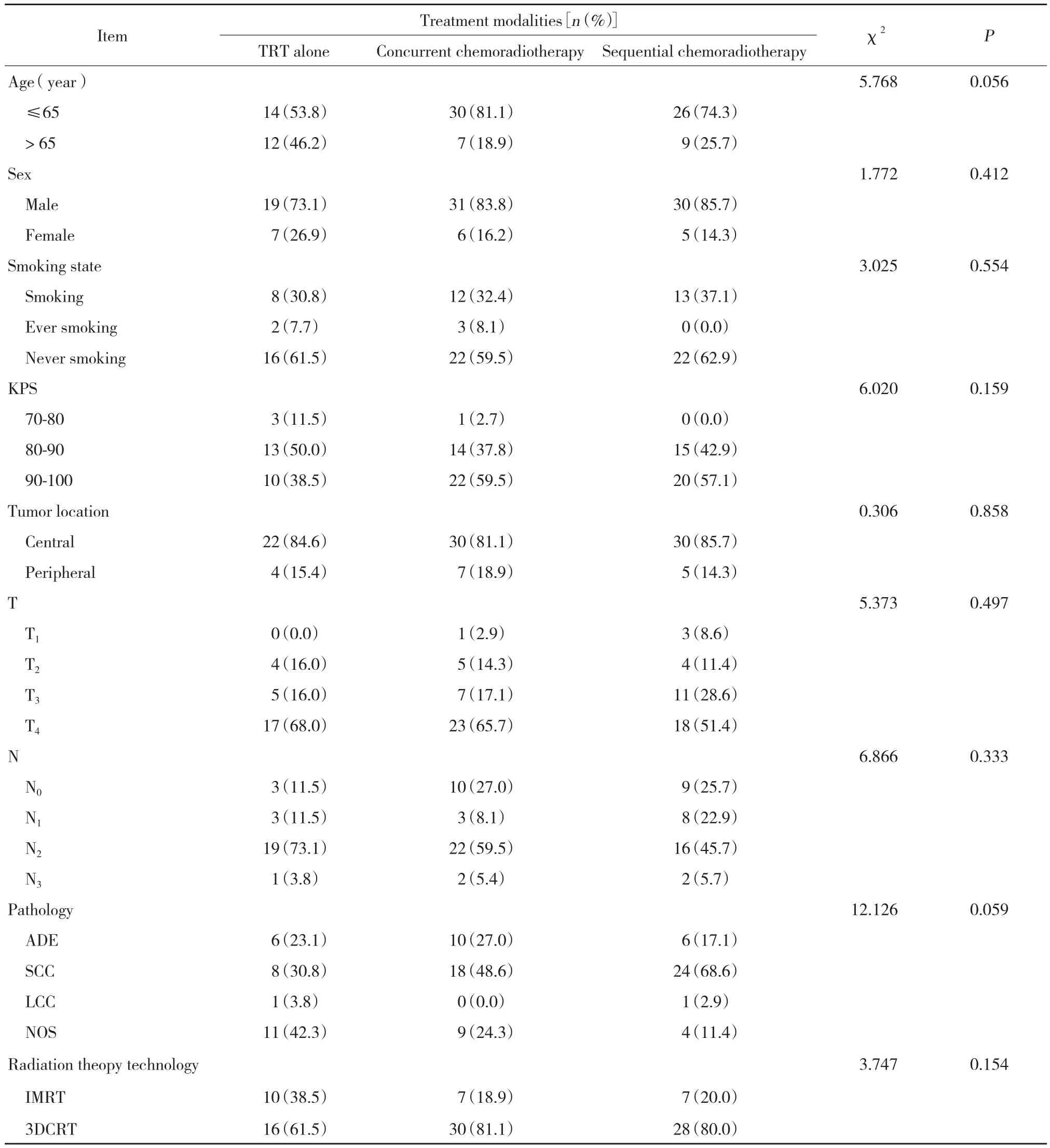
表1 不同治疗模式组患者基本特征比较Tab.1 Comparison of basic characteristics of patients that underwent different treatment modes
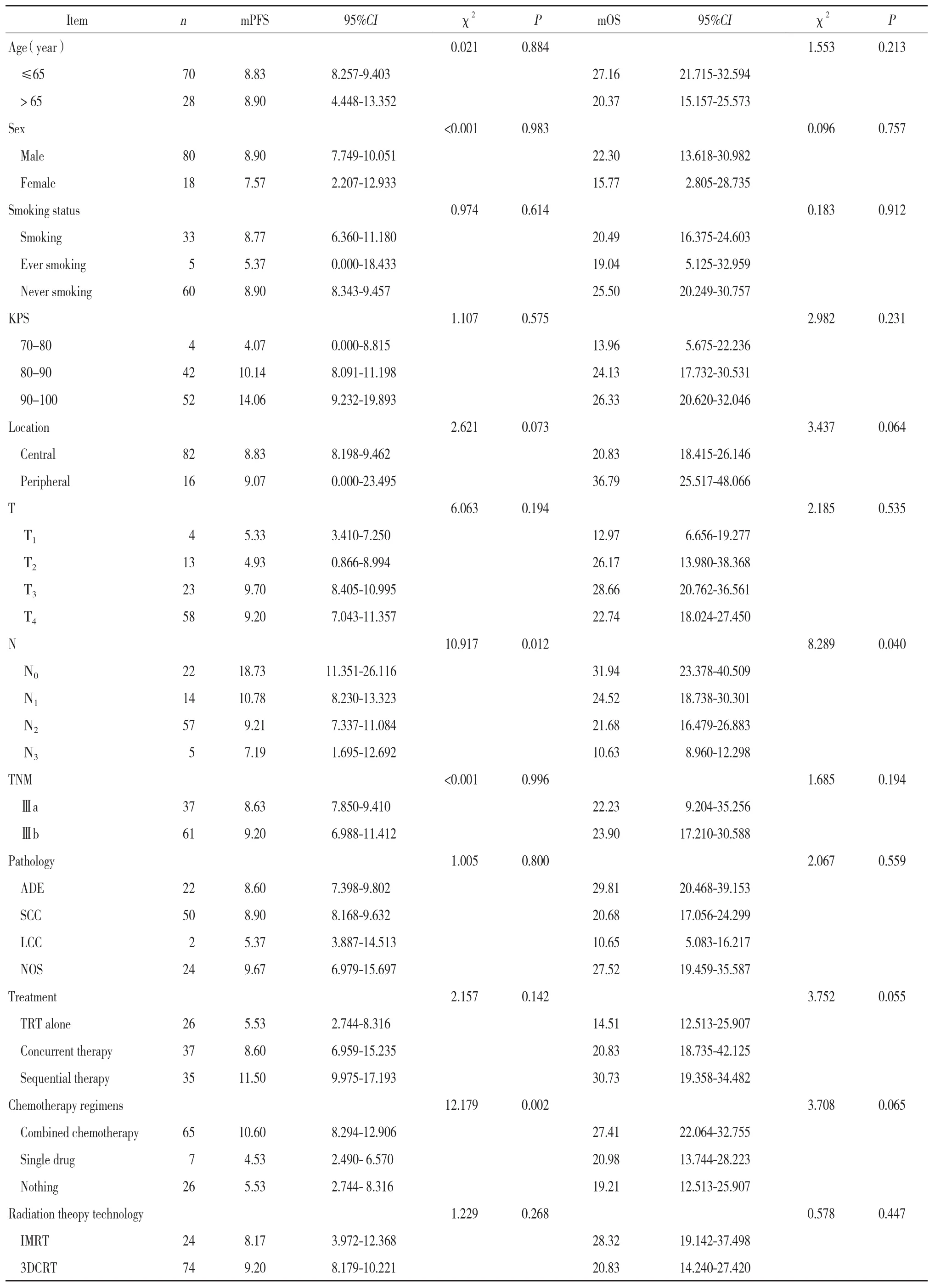
表2 单因素分析PFS及OS的影响因素Tab.2 Factors influencing PFS and OS in univariate analysis
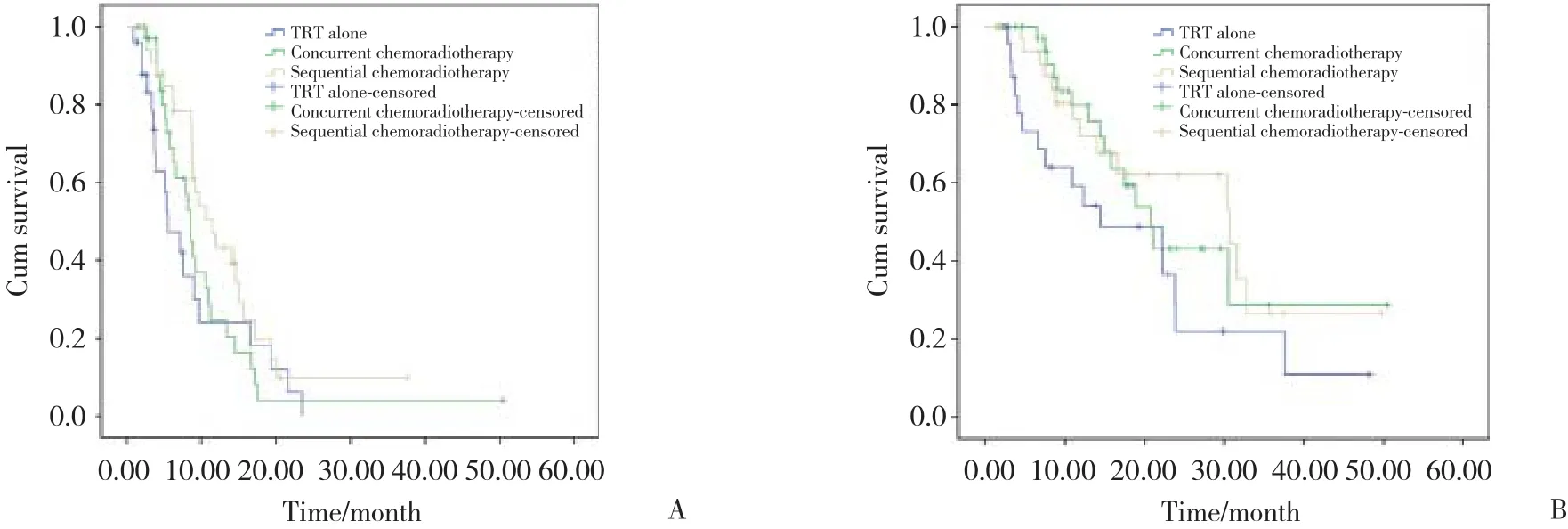
图1 3组患者PFS及OS的Kaplan-Meier生存曲线Fig.1 Survival curves of the patients in the three groups
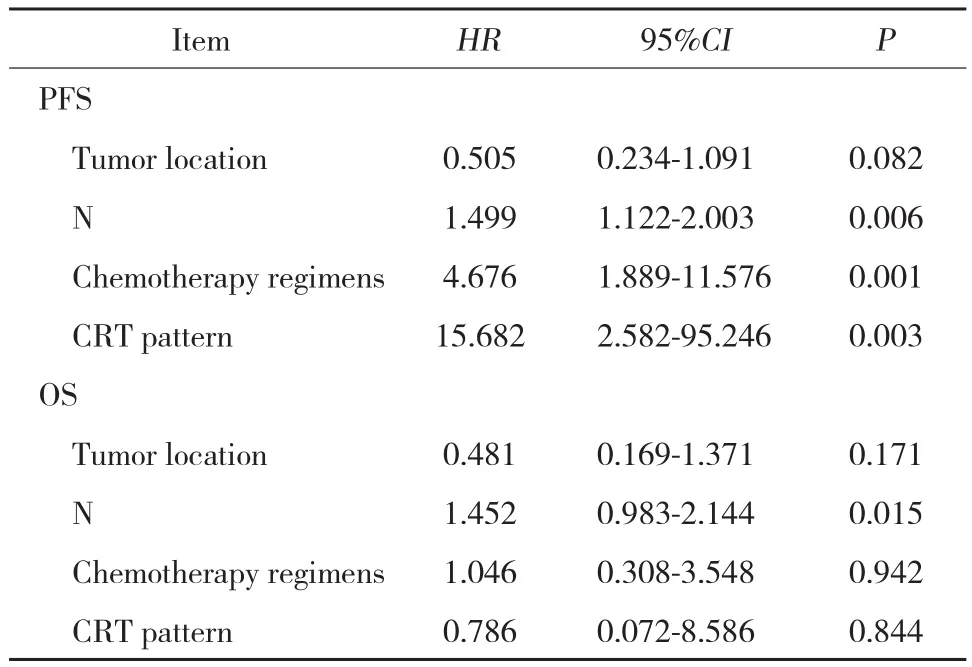
表3 PFS和OS的多因素分析结果Tab.3 PFS and OS multivariate analysis results
总之,本中心数据显示,LA-NSCLC采用以3DCRT和IMRT先进放疗技术为基础的放化疗综合治疗,总体上安全性良好,生存结果满意,不论是同步还是序贯放化疗都可以取得良好的局部控制,推迟疾病进展。当前,靶向药物在LA-NSCLC中是否可同步放化疗尚未得到阳性结果,免疫治疗药物PD-1或PD-L1抑制剂联合立体定向放射治疗的初步疗效给未来LA-NSCLC放化疗同步免疫治疗带来了希望,这将是未来研究的方向。
[1] SIEGEL R,NAISHADHAM D,JEMAL A. Cancer Stastistics,2012 [J].CA Cancer J Clin,2012,62(1):10-29. DOI:10.3322/caac.20138.
[2] JEMAL A,SIEGEL R,WARD E,et al.Cancer statistics 2006 [J].CA Cancer J Clin,2006,56(2):106-130. DOI:10.3322/canjclin.56.2.106.
[3] AUPERIN A,LE PECHOUX C,ROLLAND E et al. Meta-analysis of concomitant versus sequential radiochemotherapy in locally advanced non-small-cell lung cancer [J]. J Clin Oncol,2010,28(13):2181-2190. DOI:10.1200/jco.2009.26.2543.
[4] CURRAN WJ,JR,PAULUS R,LANGER CJ et al. Sequential vs.concurrent chemoradiation for stageⅢnon-small cell lung cancer:randomized phaseⅢtrial RTOG 9410 [J]. J Natl Cancer Inst,2011,103(19):1452-1460. DOI:10.1093/jnci/djr325.
[5] BRADLEY JD,PAULUS R,KOMAKI R et al. Standard-dose versus high-dose conformal radiotherapy with concurrent and consolidation carboplatin plus paclitaxel with or without cetuximab for patients with stage ⅢA or ⅢB non-small-cell lung cancer (RTOG 0617):a randomised,two-by-two factorial phase 3 study [J]. Lancet Oncol,2015,16(2):187-199. DOI:10.1016/S1470-2045(14)71207-0.
[6] WOZNIAK AJ,MOON J,THOMAS CR,et al. A pilot trial of cisplatin/etoposide/radiotherapy followed by consolidation docetaxel and the combination of bevacizumab (NSC-704865) in patients with inoperable locally advanced stageⅢnon-small-cell lung cancer:SWOG S0533 [J]. Clin Lung Cancer,2015,16(5):340-347. DOI:10.1016/j.cllc.2014.12.014.
Safety and Efficacy of Chemotherapy and Radiotherapy for the Treatment of Unresectable Locally Advanced Non-small Cell Lung Cancer
YUAN Meng,HAN Chengbo,MA Jietao,HUANG Letian,ZHANG Shuling,SUN Li
(Department of Oncology,Shengjing Hospital,China Medical University,Shenyang 110022,China)
ObjectiveThe aim of this study was to retrospectively review the efficacy and safety of treatment for unresectable locally advanced non-small cell lung cancer (LA-NSCLC).MethodsA total of 98 patients treated in our hospital between January 2010 and December 2015 were enrolled in this study. Patients were divided into three groups:the thoracic radiotherapy (TRT) alone,concurrent chemoradiotherapy,and sequential chemoradiotherapy groups. The progression-free survival (PFS) and overall survival (OS) were analyzed via the Kaplan-Meier method,and compared with the log-rank/Breslow test. The prognostic factors were analyzed using the Kaplan-Meier and Cox multivariate proportional hazards models.ResultsThe median PFS in the concurrent therapy group was longer than that in the TRT alone group (P < 0.05). The median OS was improved in patients treated with concurrent or sequential therapy than in the TRT alone group (P < 0.05). N stage, chemotherapy regimens,and radiotherapy modalities were independent prognostic factors of PFS in all patients (P <0.05). Similarly,N stage was an independent prognostic factor of OS in all patients (P < 0.05). Overall,the treatment was deemed safe. The occurrence of hematotoxicity related to Karnofsky performance score (KPS) and chemotherapy regimens (P < 0.05).ConclusionPatients with a lower N stage who
cisplatin-based double chemoradiotherapy demonstrated improved survival rates. Survival was significantly improved in LA-NSCLC patients treated with concurrent or sequential therapies compared with TRT alone. Overall,the treatment is safe. KPS and chemotherapy combination regimens may increase the occurrence of hematotoxicity.
locally advanced; non-small cell lung cancer; efficacy; survival; toxicity
R734.2
A
0258-4646(2017)12-1124-05
http://kns.cnki.net/kcms/detail/21.1227.R.20171130.1810.026.html
10.12007/j.issn.0258-4646.2017.12.014
袁梦(1991-),女,硕士研究生.
韩琤波,E-mail:hancb@126.com
2017-03-16
网络出版时间:2017-11-30 18:10
(编辑 于 溪)
