动态增强MRI用于新辅助放化疗食管癌患者的治疗反应研究*
2017-12-18柏根基
张 泉 ,陈 力 ,张 辉 ,吴 建 ,彭 进 ,柏根基 ,王 浩△
1.南京医科大学附属淮安第一医院 (淮安223300),2.陕西省肿瘤医院肿瘤放疗科(西安710061)
动态增强MRI用于新辅助放化疗食管癌患者的治疗反应研究*
张 泉1,陈 力2,张 辉1,吴 建1,彭 进1,柏根基1,王 浩2△
1.南京医科大学附属淮安第一医院 (淮安223300),2.陕西省肿瘤医院肿瘤放疗科(西安710061)
目的:探讨和评价动态对比增强磁共振成像(DCE-MRI)在用于预测新辅助放化疗(nCRT)食管癌病理反应的潜在价值。方法:收集食管癌患者27例分别于nCRT前、nCRT 2~3周期间、及nCRT后进行DCE-MRI检查。术后评估肿瘤病理反应分级(TRG),计算肿瘤浓度时间曲线下面积(AUC)、峰值时间(TTP)及斜率。根据不同的DCE参数制定和分析好的反应(GR)和差反应(noGR),及完全病理反应(pCR)和不完全病理反应(nopCR)发生情况。结果:27例中13例(48.1%)显示GR,其中9例(33.3%)pCR。AUC在治疗中的变化显示,AUC per-pre最能预测GR。在22.7%的临界值时,灵敏度92%,特异度77%,阳性预测值(PPV)79%,阴性预测值(NPA)91%。而AUCpost-pre最能预测pCR,在-24.6%的临界值时,灵敏度83%,特异度88%,PPV71%,NPV93%。TTP和斜率都与病理反应无相关性。结论:在食管癌治疗过程中,AUC的变化有望预测新辅助放化疗食管癌的组织病理反应。
食管癌是全世界第8常见癌症,并且发病率迅速增加[1]。食管癌治疗主要依靠手术治疗或药物治疗,但是治疗效果并不理想[2]。近年同步放化疗、新辅助化疗等治疗策略提高了食管癌的治疗效果[3-4]。最近的研究发现新辅助放化疗可以提高5年生存率大约13%[5-7]。nCRT目前被考虑作为食管鳞癌和腺癌的标准治疗。然而,不是所有患者都可获得相同获益,治疗效果取决于患者对放化疗的反应[6,8]。内镜活检和(或)超声、18F-FDG-PET已经被广泛用于评估反应。在术前给予准确的反应预测,调整治疗策略,选择合适的治疗方案,例如保留食管的保守方案,改变nCRT或终止新辅助治疗尽早开始手术等等。随着成像技术的发展,可以获得更多的患者病灶信息从而为制定更加合理有效的治疗方案提供技术保证[9]。内镜活检和(或)超声、18F-FDG-PET已经被广泛用于评估反应[10],但这些方法对预测病理反应没有足够的准确性[11]。18F-FDG-PET似乎是最好的预测方法,67%~70%的诊断价值还不足以产生准确的临床决策[12]。目前也没有其它基于分子生物标记和临床参数的预测病理反应的图像方法[13]。Pilot关于DCE-MRI的研究证实了食管癌成像的可行性[14-15]。目前很少有使用DCE-MRI测量(早期)食管肿瘤对nCRT的病理反应的研究。本研究的目的是探索DCE-MRI在食管癌患者中预测早期病理反应的潜力。本研究目的是探索DCE-MRI在食管癌患者中预测早期病理反应的潜力,报告如下。
资料与方法
1 一般资料 经院医学伦理委员会批准的,并书面告知所有患者。所收集食管癌患者27例,男性19例,女性8例,年龄38~72岁,中位年龄63岁,T2 7例,T3 20例,N0 8例,N1 19例,鳞癌25例,腺癌1例,腺鳞癌1例,颈段2例,胸上段3,胸中段15例,胸下段7例。全组患者均接受1~2周期的同期化疗,方案为FP(顺铂12.5 mg/m2×5 d或25 mg/m2×3 d,5-FU 450~500 mg/m2× 5 d)或TP(紫杉醇135 mg/m2,第1天;顺铂25 mg/m2,第2、3、4天),21 d为1周期,第1、5周给予。同时放疗(DT40Gy/20F),nCRT完成5~10周后行手术切除。术后对切除标本进行病理检测和测定肿瘤病理反应分级。
2 研究方法 将病例良好反应(GR组)定义为pCR(TRG1)与pCR(TRG2),而相对差的病理反应(noGR)定义为TRG3或更高,对pCR(TRG1)与nopCR(TRG≥2)进行分析。绘制并分析受试患者工作特征曲线,测定分析两组敏感性、特异性、阳性预测值(PPV)和阴性预测值(NPV)被估计出最佳阈值,其中敏感性和特异性给予同等重要地位。AUC值与TRG的相关性采用Spearman’s等级相关测试评估。
3 MRI采集 治疗前(5.6±2.8) d(pre)、nCRT开始后(11.2±2.7) d(per)、治疗结束后(38.5±12.9) d在手术前(post)采集MRI图像。所有的MR图像都是采用1.5T场强MRI,使用躯干线圈(16通道)或前/后(28通道)接收线圈。为了解剖学验证,采用多叶旋转回波序列T2加权扫描(TR/TE=1983/100 ms,分辨率=0.67×0.67×4 mm3),使用呼吸器自身触发。一系列DCE-MRI62张图像是用三维的梯度回波序列。(TR/TE=3.43/1.53 ms,翻转角=20°,矩阵尺寸=432×432×33,重建图像体素=1.18×1.18×3 mm3),3 s的间隔。在第10张图像时,对比剂(CA)gadobutrol(Gd-BT-D03 A,Gudouit;Schering AG,柏林,德国)以体重0.1 mmol/kg和流速1 ml/s自动注射器泵注射。
在动态系列前,具有相同扫描特性的5个翻转角(α=2°/6°/10°/12°/16°)被用于测定前对比的T1值。选择这个翻转角系列是对大范围组织的T1值是敏感的。DCE-MRI用0,200和800 S/ mm2的b值获得。单指数b值(STIR短时间反转恢复序列,脂肪抑制,分辨率=3.5×3.5×4 mm3)。
4 图像分析方法 采用非参数方法对DCE-MRI进行分析。对于每个肿瘤,用仿真的定制的曲线拟合方法(Mathsworks公司,Natick,MA)计算绘制浓度时间曲线的峰值时间(TTP)和斜率。AUC被定义为在造影剂注射后60s时间的浓度-时间曲线上的梯形积分。在肿瘤内计算3个百分位,P25、P50、P75的AUC。此外,相对于第一次扫描(pre)进行计算时间点之间的差异。AUC t-pre=(AUCt - AUCpre)/AUCpre×100%。t表示第2次(per)或第3次扫描(post)
5 统计学方法 运用SPSS 21.0统计学软件。使用Mann-Whitney U试验来比较DCE-MRI得到的各项参数。P<0.05被认为差异有统计学意义。
结 果
27例病理标本显示,对nCRT反应良好(TRG1-2)13例(48.1%),病理反应较差(TRG≥3)14例(51.9%)。在良好反应者中,9例(33.3%)显示pCR(即TRG1),4例(14.8%)有近pCR(即TRG2)。
GR组与noGR组DCE-MRI测量参数比较,见表1。对单个时间节点的AUC值分析,只有初始扫描时两组间P25AUC比较有统计学差异。P25 AUC pre最明显,其中GR组的AUC明显高于noGR组。
治疗过程中,noGR组AUC在治疗2周后出现减少,但其减少幅度明显小于GR组。GR组与noGR组AUC与最初值之间变化发现,在P75 AUC per-pre之间比较最具有统计学差异。P75 AUC per-pre最佳阈值22.7%,敏感性92%,特异性77%,阳性预测值79%,阴性测值91%。
pCR组和no-pCR组DCE-MRI参数之间比较有统计学差异,见表2。显示P75 AUC post-pre最具预测性,相对于no-pCR组和pCR组表现出更低AUC,最佳阈值-24.6%,其敏感性83%,特异性88%,PPV 71%,NPV 93%。同时显示P75 AUC per-pre也是有意义的,最佳阈值-10.3%,敏感性88%,特异性82%,PPV 70%,NPV 93%。两组间TTP和斜率以及单时间节点AUC比较均没有统计学差异。
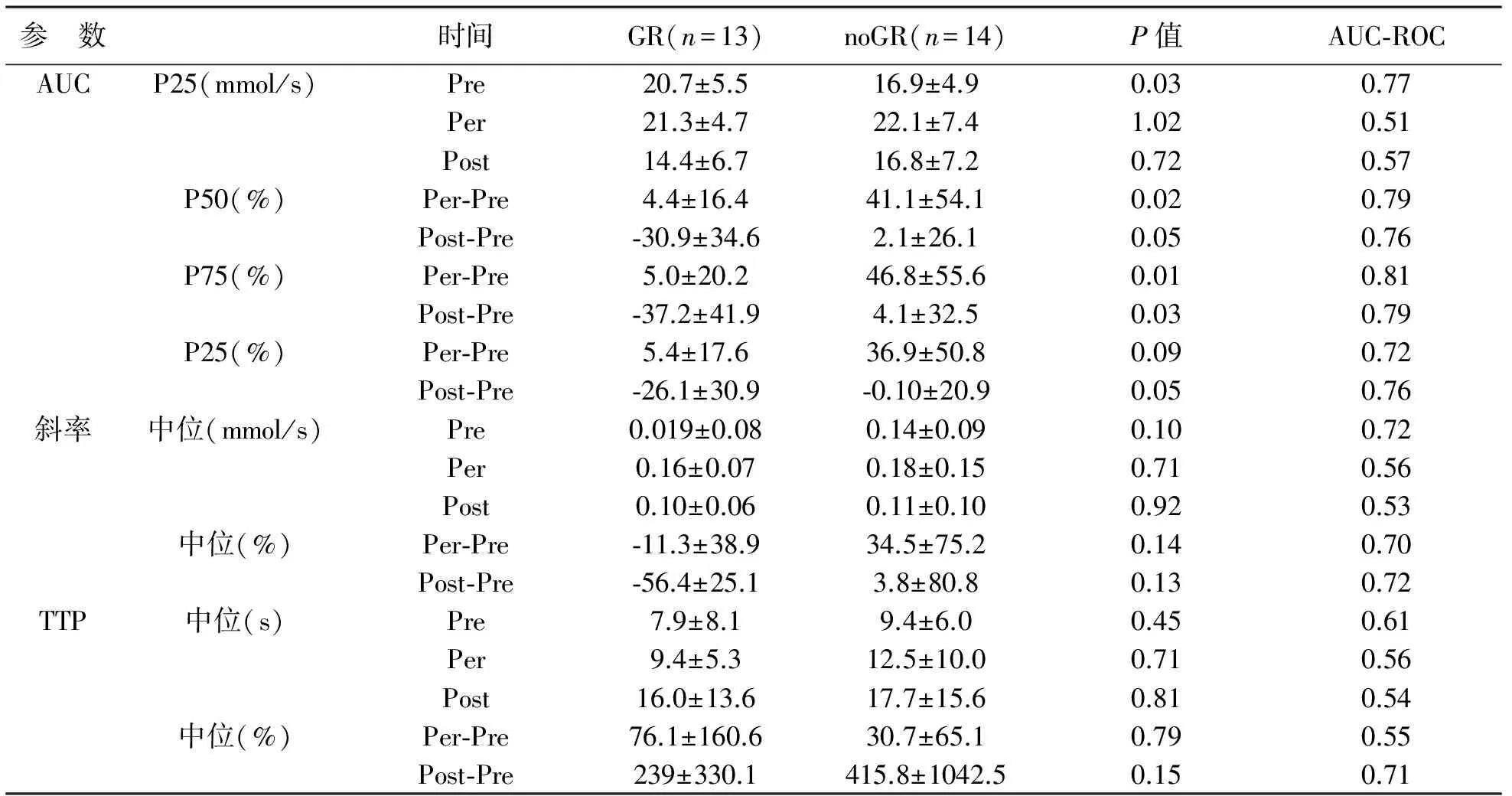
表1 DCE-MRI参数变化与病理良好反应(GR)及不良反应(noGR)之间关系
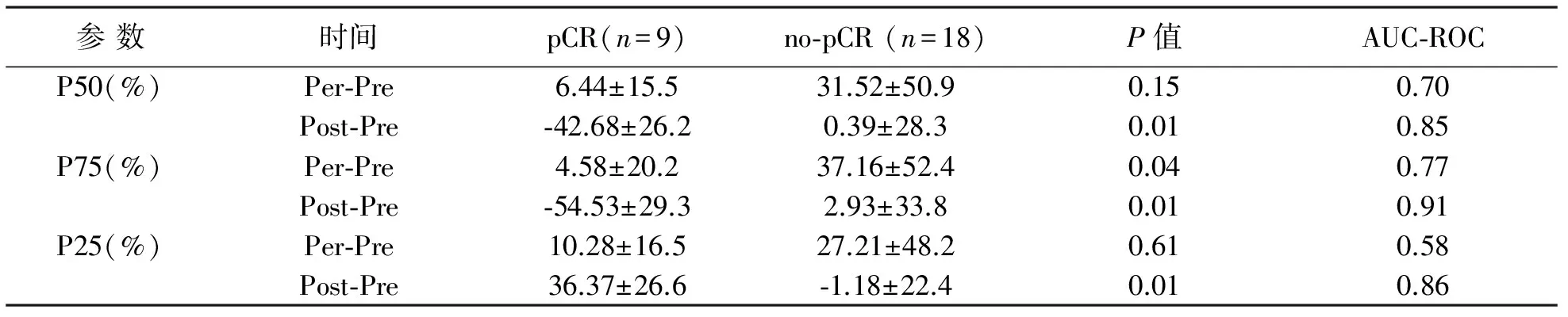
表2 DCE-MRI参数在病理完全反应(pCR)与无病理完全应答(no-pCR)之间的关系
讨 论
不同部位肿瘤研究表明,与参数测量相比,DCE-MRI具有更高的预测能力[16]。计算相对时间曲线的开始的面积下浓度(AUC),反映血液流动、血管通透性和组织间隙分数[17],是一个相对直接的无模型参数,提供肿瘤血管变化的信息,显示肿瘤的吸收能力。在一组nCRT组中29%患者达到完全病理反应(pCR),5年生存率上升到48%~65%[2,8]。显示了DCE-MRI评估和预测食管癌患者nCRT治疗后反应的潜力。在GR组和noGR组之间在治疗期间P75 AUC per-pre 比较有统计学差异,其具有良好的诊断价值。这对于早期修改治疗测量或停止在预期noGR的nCRT特别有帮助。此外,P75 AUC post-pre 在pCR组和no-pCR组之间也有统计学差异,这些可能有助于制定是否不做手术的临床决策。
在恶性肿瘤治疗过程中瘤体缩小,ADC值的升高都是肿瘤早期有效治疗的表现,肿瘤治疗中的组织结构的变化与DWI检测结果有较好的相关性。 DW-MRI通 过观 察 组 织 的 生 理、病理和血供改变来了解活体器官功能状态,被认为有助于提高诊断正确率。ADC反映患者食管癌病灶的变化,在放化疗的作用下,肿瘤细胞发生凋亡和坏死,导致细胞膜损坏,通透性增强,同时细胞的密度减小,进而引起水分子扩散运动发生明显的变化,即表现为ADC值升高。张安度等认为放疗前ADC值可能为预测食管鳞癌治疗反应和预后的有意义指标。放疗前高ADC值组的近期疗效和预后均优于放疗前低ADC值组显示放疗前高ADC值组ADC值上升较好的患者生存情况最优,而放疗前低ADC值组ADC值上升不佳的患者预后最差,放疗后高ADC值组生存情况明显优于疗后低ADC组患者。
DCE-MRI显示了不同的生理特性(肿瘤微环境下的灌注及血管通透性)相对于DW-MRI(在组织中扩散),能提供DW-MRI之外的信息。在本研究中,不仅获得治疗前后的测量结果,也获得治疗开始后2周的信息,在三个不同的时间节点,比较各项参数的预测潜能。在一个以往的研究中,观察12例食管鳞癌患者中DCE-MRI参数有显著的变化,然而该项研究只进行了有限的分析(只进行了治疗前、后DCE-MRI扫描,并且没有与病理反应进行比较)。
DCE-MRI初始扫描显示治疗结果的预测值。在nCRT 2周后进行第二次扫描,与治疗前和治疗后相比,增加更多的诊断价值,产生更高的预测价值。DCE-MRI在nCRT早期发现肿瘤参数的变化可以预测病理结果的,结论与先前使用DWI-MRI做的研究一致。其他肿瘤使用DCE-MRI也可以预测病理反应。通过和多平面重建结合,还能够用于对血管是否受侵的临床评价。
基于MRI来监测和预测病理反应,对未来治疗改变的研究,有利的是可以提前做MRI,这可以帮助在新辅助治疗的第一阶段形成准确的治疗策略。此外,目前的扫描结果参数在pCR和no-pCR患者之间显示出鉴别诊断价值,这可能发现在好的病理反应和差病理反应之间的早期区别。敏感性和特异性一般赋予同等重要,但依赖于分析的目的(如改变治疗方案,不做手术),这侧重点可能会发生变化。临床参数的互补价值变得越来越重要,应该结合其他成像模式(如FDG-PET)和分子生物标志物等等。
Li等研究结果显示化疗有效者AUC的下降,而放疗反应者,在放疗最初的1~2周内,AUC最初增长,随后出现下降。正如前面提出,AUC反映血流和血管的渗透性,它在肿瘤组织中是增加的。P75 AUC的优异的预测价值这一事实可以表明,它是对肿瘤生长活跃(更好的灌注或通气)是更加敏感的。
综上所述,我们的研究表明DCE-MRI的分析对于接受放化疗的食管癌患者有治疗反应评估和预测的潜能。在治疗最初2~3周内 AUC的变化被发现在好的病理反应组和差的病理反应组之间有显著差异,这可能允许对治疗反应进行早期预测。此外,术前AUC的变化在病理完全反应组和非病理完全反应组之间被发现有显著差异。由于本研究样本量小可能导致了对真实预测值的高估或低估,因此我们的结论需要在更大的患者队列中加以验证。
[1] Torre L, Bray F, Siegel RL,etal. Global cancer statistics [J]. CA: A Cancer J Clin,2015,65:87-108.
[2] 赵文龙,廖清平,刘景杰.食道癌放疗体位固定的临床探讨[J].中国医学创新,2015,12(11):95-97.
[3] 程 欣,陈思禹,刘福国,等.食管癌化疗进展[J].癌症进展,2013,ll(5):425-430.
[4] 宋仕茂,王 云,骆志国.靶向干扰Spyl表达增强食管癌化疗敏感性的研究[J].中国肿瘤,2015,24(3):241-245.
[5] Van-Hagen P, Hulshof MCCM, Van-Lanschot JJB,etal. Preoperative chemoradiotherapy for esophageal or junctional cancer[J].N Engl J Med,2012,366:2074-2084.
[6] Sjoquist KM, Burmeister BH,Smithers BM,etal. Survival after neoadjuvant chemotherapy or chemoradiotherapy for resectable oesophageal carcinoma: an updated meta-analysis[J]. Lancet Oncol,2011,12:681-692.
[7] Shapiro J,Van Lanschot JJB, Hulshof MCCM,etal. Neoadjuvant chemoradiotherapy plus surgery versus surgery alone for oesophageal or junctional cancer (CROSS): long-term results of a randomised controlled trial[J]. Lancet Oncol,2015,16:1090-1098.
[8] Donahue JM, Nichols FC, Li Z,etal. Complete pathologic response after neoadjuvant chemoradiotherapy for esophageal cancer is associated withenhanced survival[J]. Ann Thorac Surg,2009,87:392-399.
[9] 张合明,张喜军,原爱杰,等.食管癌的CT检查与手术治疗[J].中国医疗前沿,2011,6(10):59-60.
[10] Ajani JA, Correa AM, Hofstetter WL,etal. Clinical parameters model for predicting pathologic complete response following preoperative chemoradiation in patients with esophageal cancer[J]. Ann Oncol, 2012,23:2638-2642.
[11] Van Rossum PSN, Van Lier ALHMW,van Vulpen M,etal. Diffusion-weighted magnetic resonance imaging for the prediction of pathologic response to neoadjuvant chemoradiotherapy in esophageal cancer[J].Radiother Oncol,2015,115:163-170.
[12] Chen Y, Pan X, Tong L,etal. Can 18F-fluorodeoxyglucose positron emission tomography predict responses to neoadjuvant therapy in oesophageal cancer patients? A meta-analysis[J]. Nucl Med Commun, 2011,32:1005-1010.
[13] Van Olphen SH, Biermann K, Shapiro J,etal. P53 and SOX2 protein expression predicts esophageal adenocarcinoma in response to neoadjuvant chemoradiotherapy[J]. Ann Surg,2016,86:1078-1092.
[14] Chang EY, Li X, Jerosch-Herold M,etal. The evaluation of esophageal adenocarcinoma using dynamic contrast-enhanced magnetic resonance imaging[J]. J Gastrointest Surg, 2008,12:166-175.
[15] Oberholzer K, Pohlmann A, Schreiber W,etal. Assessment of tumor microcirculation with dynamic contrast-enhanced MRI in patients with esophageal cancer: Initial experience[J]. J Magn Reson Imaging,2008,27:1296-1301.
[16] Joo I, Lee JM, Han JK,etal. Dynamic contrast-enhanced MRI of gastric cancer:Correlation of the perfusion parameters with pathological prognostic factors[J]. J Magn Reson Imaging,2014,28:985-998.
[17] Evelhoch JL, LoRusso PM, He Z,etal. Magnetic resonance imaging measurements of the response of murine and human tumors to the vascular-targeting agent ZD6126[J]. Clin Cancer Res, 2004,10:3650-3657.
TheStudyofDynamiccontrast-enhancedMRIfortreatmentresponseassessmentinpatientswithoesophagealcancerreceivingneoadjuvantchemoradiotherapy
Zhang Quan , Cheng Li,Zhang Hui ,et alDepartment of Radiation Oncology,
Huai’an First People’ s Hospital ,Nanjing Medical University(Huai’an 223300)
To explore and evaluate the potential value of dynamic contrast-enhanced (DCE) magnetic resonance imaging (MRI) for the prediction of pathologic response to neoadjuvant chemoradiotherapy(nCRT) in oesophageal cancer. Methods: Twenty-seven patients underwent DCE-MRI before, during (week 2-3) and after nCRT, but before surgery (pre/per/post, respectively). Histopathologic tumour regression grade (TRG) was assessed after oesophagectomy. Tumour area-under-the-concentration time curve (AUC), time-to-peak (TTP) and slope were calculated. The ability of these DCE-parameters to distinguish good responders(GR, TRG 1-2) from poor responders (noGR, TRG P 3), and pathologic complete responders (pCR) from no-pCR was assessed. Results: Thirteen patients (48.1%) showed GR of which eight patients (33.3%) pCR. Analysis of AUC change throughout treatment, AUCper-pre, was most predictive for GR, at a threshold of 22.7% resulting in a sensitivity of 92%, specificity of 77%, PPV of 79%, and a NPV of 91%. AUCpost-pre was most predictive for pCR, at a threshold of -24.6% resulting in a sensitivity of 83%, specificity of 88%, PPV of 71%, and a NPV of 93%.TTP and slope were not associated with pathologic response. Conclusions: This study demonstrates that changes in AUC throughout treatment are promising for prediction of histopathologic response to nCRT for oesophageal cancer.
Esophageal Neoplasms/radionuclide imaging Magnetic resonance imaging Chemoradiotherapy, adjuvant
*南京医科大学科技发展基金资助项目(2011 NJMU239)
△通讯作者
食管肿瘤/放射性核素成像 磁共振成像 化学放射疗法,辅助
R735.1
A
10.3969/j.issn.1000-7377.2017.12.044
(收稿:2017-07-27)
