不同干燥方式和酶解对茶褐牛肝菌挥发性风味成分的影响
2017-12-18,,
,,
(昆明理工大学生命科学与技术学院,云南昆明 650500)
不同干燥方式和酶解对茶褐牛肝菌挥发性风味成分的影响
周超,黄裕怡,胡旭佳*
(昆明理工大学生命科学与技术学院,云南昆明 650500)
为研究不同干燥方式和酶解对茶褐牛肝菌挥发性风味成分的影响,采用有机溶剂超声萃取新鲜、真空干燥、冷冻干燥、微波干燥、热风干燥和酶解的茶褐牛肝菌挥发性成分,用气质联用分析(GC-MS)鉴定其风味化合物。结果显示新鲜、真空、冷冻、微波、热风干燥和酶解的茶褐牛肝菌分别检出51、47、49、19、18和44种风味化合物,通过聚类分析可以反映出不同干燥方式和酶解的茶褐牛肝菌挥发性成分的相似程度,干燥方式和酶解对茶褐牛肝菌中醇类、酸类、酯类和烃类挥发性风味成分影响较明显。除了冷冻干燥,醇类和烃类化合物含量均减少。除了微波干燥和酶解,酯类化合物含量减少。冷冻干燥的茶褐牛肝菌与鲜茶褐牛肝菌在整体风味成分上较为接近,相似度较高,说明冷冻干燥能较好的保持茶褐牛肝菌的原有风味。
茶褐牛肝菌,干燥方式,酶解,风味成分,气相色谱-质谱联用技术,聚类分析
茶褐牛肝菌(Neoboletusbrunneissimus)又名黑牛肝,见手青,属伞菌目,牛肝菌科,牛肝菌属高等真菌,是云南一种独特的野生牛肝菌[1-2]。野生牛肝菌子实体肥嫩、味道鲜美、香气独特,含有丰富的蛋白质、氨基酸、维生素和矿物质元素等,具有抗肿瘤、降血糖、保肝利胆、清热解毒及提高人体免疫力、调节内分泌等功能,有很高的食用价值和药用价值[3-5]。茶褐牛肝菌因其产量巨大,味道鲜甜,香气较其他食用菌独特,在市场上深受消费者青睐[6],若将牛肝菌资源充分利用,将带来较高的经济价值。
茶褐牛肝菌具有独特的浓烈香气,研究表明食用菌香气能使人感到愉快,增强食欲,促进消化,同时也是评价食用菌品质的重要指标,这些香气物质主要是八碳化合物、酯类、酸类、烃类以及含硫含氮化合物等物质[7]。目前茶褐牛肝菌以鲜食为主,不易保存且香气成分损失较快,而现常对食用菌干燥后进行保存,研究表明不同的干燥方式对食用菌挥发性成分的种类和含量有较大影响,在干燥过程中会发生化学反应引起一些物质的损失和一些新物质的生成,影响了食用菌的营养成分、质地、活性、滋味和香气物质,从而影响其品质[8-11]。目前对牛肝菌挥发性成分的研究主要集中在美味牛肝菌[12]、黄牛肝菌[13]和褐黄牛肝菌上[14],对茶褐牛肝菌的研究还很少,对其的研究主要集中在其营养成分和鲜味物质上[4,15]。随着生活水平的提高,人们对风味的要求越来越高,酶解作为提升风味的方法受到越来越多的关注,唐秋实等[16]和张玉玉等[17]分别对金针菇和牛肝菌进行酶解发现风味增强且赋予了特殊风味。
本研究利用有机溶剂超声萃取法结合GC-MS对不同干燥方式和酶解处理的茶褐牛肝菌中挥发性成分进行分析与比较,探讨真空干燥、冷冻干燥、微波干燥、热风干燥和酶解对茶褐牛肝菌挥发性风味成分的影响,研究其特征香气的组成,旨在为茶褐牛肝菌的深加工和储藏保鲜提供理论依据,对茶褐牛肝菌资源的开发利用和野生菌调味料产品的开发具有一定参考价值。
1 材料与方法
1.1 材料与仪器
茶褐牛肝菌 于2016年7月购买于昆明木水花野生菌市场,由中科院昆明植物研究所杨祝良教授鉴定;无水乙醚、乙醇和无水硫酸钠 分析纯,广东光华科技股份有限公司;风味蛋白酶(酶活1.5×104U/g)和碱性蛋白酶(酶活2×105U/g) 食品级,江苏锐阳生物科技有限公司。
GZX-9140MBE电热鼓风干燥箱、CS501恒温水浴锅 上海博讯仪器有限公司;M1-L202B微波炉 广东美的微波炉制造有限公司;BPZ-6033真空干燥箱 上海一恒科技有限公司;Coolsafe 55-4真空冷冻干燥机 丹麦Labogene公司;HC-3018R高速冷冻离心机 安徽器械有限公司;LB-180C超声清洗仪 上海比朗科学仪器有限公司;Agilent 7890A-5975C气质联用仪、HP-5 MS色谱柱 美国安捷伦公司。
1.2 样品处理
1.2.1 热风干燥(hot air drying,AD) 将新鲜茶褐牛肝菌洗净,切成约5 mm薄片,放入电热鼓风干燥箱中进行热风干燥,干燥温度约为70 ℃,直至干燥水分含量约为5%停止干燥,干燥时间约为24 h。
1.2.2 微波干燥(microwave drying,MD) 将新鲜茶褐牛肝菌洗净,切成约5 mm薄片,放入内室为315 mm×181 mm×325 mm的实验室微波炉中进行微波干燥,微波功率为350 W,直至干燥水分含量约为5%停止干燥,干燥时间约为30 min。
1.2.3 真空干燥(vacuum drying,VD) 将新鲜茶褐牛肝菌洗净,切成约5 mm薄片,放入真空干燥箱中进行真空干燥,真空度为-80 kPa,干燥温度为60 ℃,直至干燥水分含量约为5%停止干燥,干燥时间约为20 h。
1.2.4 冷冻干燥(freeze drying,FD) 将新鲜牛肝菌洗净,切成约5 mm薄片,先放入-20 ℃冰箱中预冻24 h,再放入冷冻干燥机中进行冷冻干燥处理,加热板温度为30 ℃,冷阱温度-55 ℃,真空压力为100 Pa,直至干燥水分含量约为5%停止干燥,干燥时间约为24 h。
1.2.5 酶解(enzymatic hydrolysis,EH) 取新鲜茶褐牛肝菌20 g,洗净,加入100 mL去离子水,研磨成浆液,加入风味蛋白酶和碱性蛋白酶,在温度50 ℃,初始pH为7的条件下酶解1 h,加酶量分别为3000 U/g和1500 U/g,待酶解结束,沸水浴灭酶活10 min,4 ℃保存。
1.3 挥发性风味化合物的检测
1.3.1 挥发性成分的萃取 茶褐牛肝菌挥发性成分的萃取参照Li等[18]采用的溶剂萃取法进行萃取,并进行如下改进,取上述不同干燥方式的茶褐牛肝菌各10 g,研磨成粉,放入封口塑胶瓶中,加入20 mL重蒸乙醚,封紧瓶口,超声提取3 h,取出4 ℃冷却30 min,分离上层萃取液转入一个新的塑胶瓶中,加入新的乙醚,重复上述操作4次,合并上层萃取液体,4 ℃保存。待乙醚萃取完成后,剩余牛肝菌残渣加入20 mL无水乙醇,按照上述操作重复提取4次,合并上层萃取液体,再用旋转蒸发仪将上层乙醇萃取液浓缩成浸膏,将上述乙醚萃取液加入乙醇萃取浸膏中密封超声溶解1 h,4 ℃冷却过滤,收集滤液,加入过量活化无水硫酸钠(活化条件:马弗炉450 ℃,4 h),4 ℃过夜浓缩后定容至1 mL,待GC-MS进样分析。
1.3.2 GC-MS检测条件 色谱条件:HP-5 MS石英弹性毛细管柱(30 m×0.25 mm,0.25 μm);升温程序:初始温度40 ℃,保持3 min,以13 ℃/min的速度升温至150 ℃,保持2 min,再以4 ℃/min的速度升温至200 ℃,保持1.5 min,最后以2 ℃/min的速度升温至250 ℃,保持5 min。载气为高纯He;进样量为1 μL;流速为1 mL/min;分流比为40∶1。质谱条件:离子源EI,电子能量70 eV,离子源温度230 ℃,四级杆温度150 ℃,检测电压350 V,质谱接口温度250 ℃,质量扫描范围35~550 u,溶剂延迟为4 min。
1.3.3 定性与定量分析 对质谱图进行人工解析及检索NIST14数据库(包括Wiley和Mainlib),匹配每个色谱峰所相对应的化学物质,再结合相关的文献进行人工图谱解析确认,我们只选择匹配度大于85(最大匹配度为100)的化合物进行报道。采用峰面积归一化法用于定量分析,求得各挥发性成分的相对含量。
1.4 数据处理
采用SPSS 19.0软件对挥发性风味成分进行聚类分析,表明不同样品之间的相似度。
2 结果与分析
2.1 不同干燥方式和酶解对茶褐牛肝菌挥发性风味成分的分析
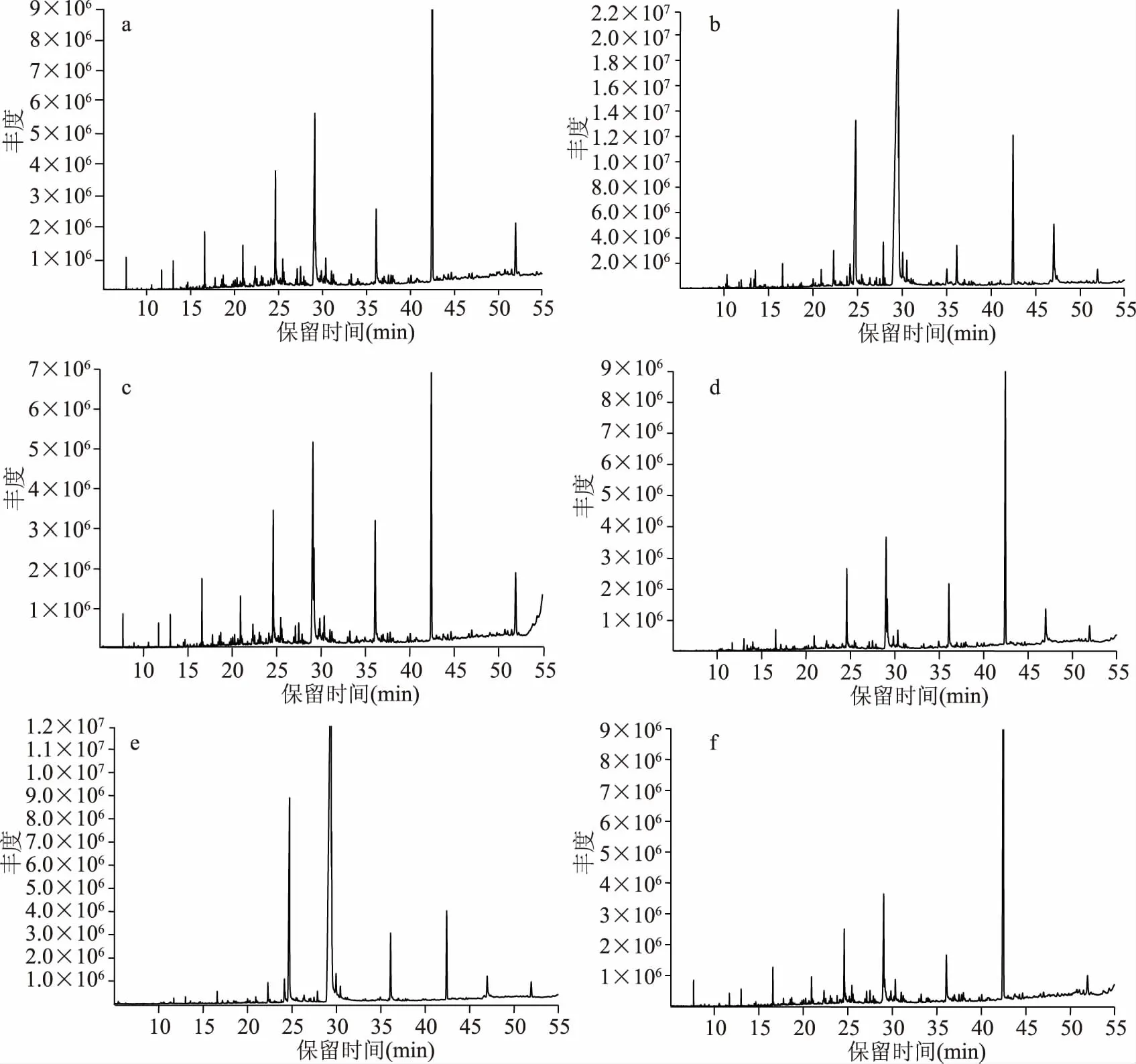
图1 不同干燥方法和酶解处理茶褐牛肝菌挥发性风味成分的总离子色谱图 Fig.1 The total ion chromatogram of flavor compounds in N. brunneissimus by different drying method and enzymolysis注:a:新鲜茶褐牛肝菌;b:真空干燥;c:冷冻干燥;d:微波干燥;e:热风干燥;f:酶解。
通过不同干燥方式和酶解处理茶褐牛肝菌,利用超声有机溶剂萃取法萃取其中挥发性风味成分,再通过GC-MS进行分离与鉴定,得到6个样品的总离子色谱图如图1所示,定性和定量分析结果如表1所示,挥发性成分分类比较结果如表2所示。共鉴定57种挥发性化合物,主要包括酸类(10种)、烃类(29种)、酯类(5种)、醇类(4种)、含氮化合物(7种)和其他类化合物(2种),新鲜茶褐牛肝菌中共鉴定51种挥发性成分,其中酯类化合物相对含量最高,为35.06%,其次是酸类化合物,真空干燥共鉴定47种挥发性成分,酸类化合物相对含量高达76%,冷冻干燥共鉴定49种挥发性成分,以酸类化合物相对含量最高,为37.64%,微波干燥共鉴定19种挥发性成分,以酯类化合物相对含量最高,为46.06%,热风干燥共鉴定18种挥发性成分,酸类化合物相对含量高达84.64%,酶解样品共鉴定44种挥发性成分,以酯类化合物相对含量最高,为48.76%,其中共有挥发性成分15种,分别是正十五烷酸、棕榈酸、亚油酸、反油酸、硬脂酸、邻苯二甲酸二(2-乙基己基)酯、(Z,Z)-9,12-十八二烯酸-2-羟基-1-(羟甲基)乙酯、正十三烷、正十四烷、正十六烷、正十八烷、角鲨烯、齐墩果腈、棕榈酰胺和(Z)-9-十八烯酰胺,其中亚油酸的含量最高,这与李巍巍等[14]结果一致。
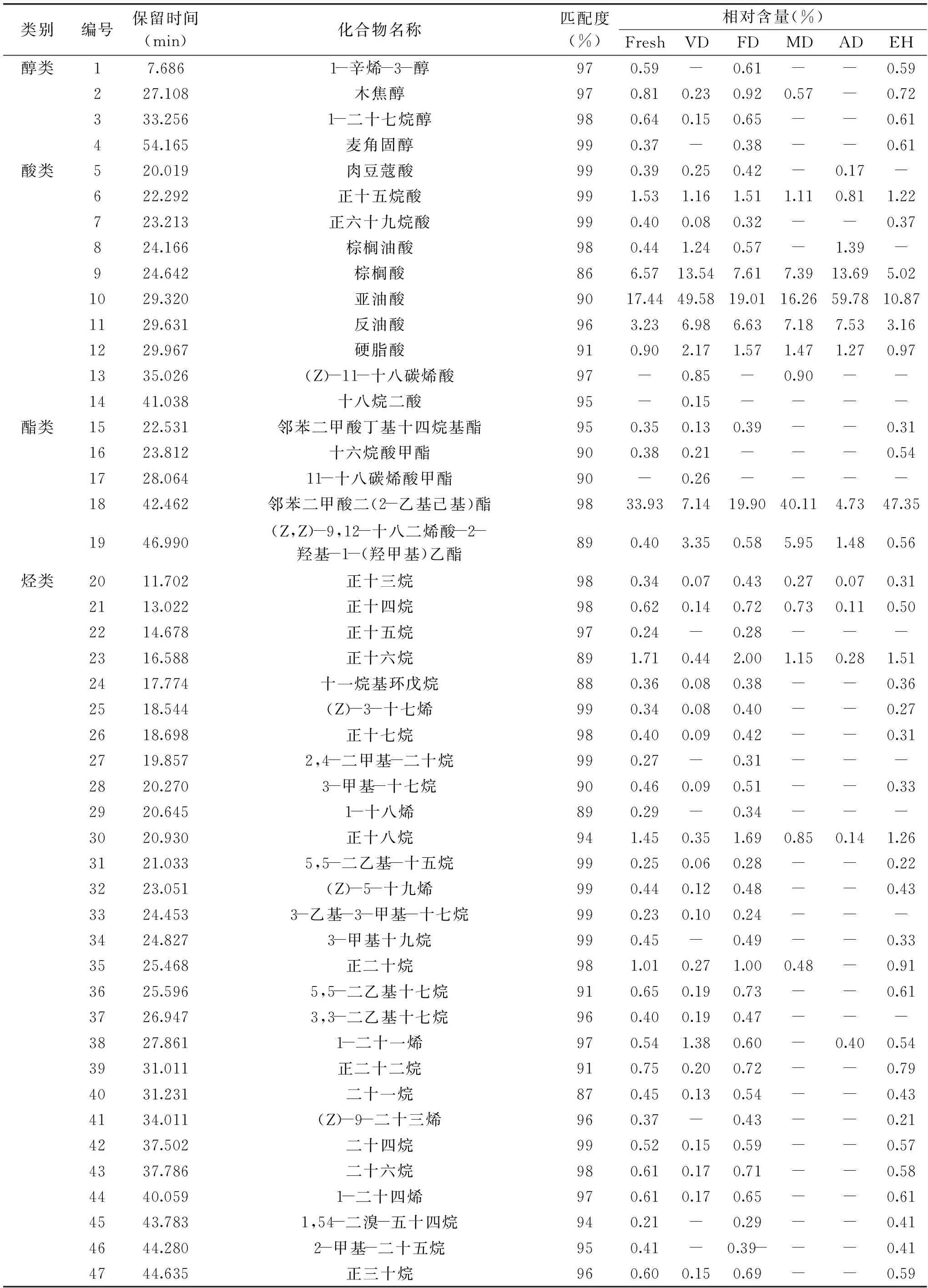
表1 不同干燥方法和酶解对茶褐牛肝菌挥发性化合物的分析结果Table 1 The analysis results of flavor compounds in N. brunneissimus by the different drying method and enzymolysis

续表
注:“-”表示未检出;Fresh:新鲜样品;VD:真空干燥;FD:冷冻干燥;MD:微波干燥;AD:热风干燥;EH:酶解;表2、图2同。
2.2 不同干燥方式和酶解对茶褐牛肝菌挥发性风味成分的影响
2.2.1 不同干燥方式和酶解对醇类化合物的影响 醇类物质一般是由脂质发生氧化反应而产生,会产生清香、木香和脂肪香的气味。在新鲜茶褐牛肝菌检出4种醇类化合物,含量最高是木焦醇(0.81%),最低是麦角固醇(0.37%),醇类化合物总量为2.41%,真空、冷冻、微波干燥和酶解样品中分别检出2、4、1、4种醇类化合物,相对含量分别为0.38%、2.56%、0.57%和2.20%,微波干燥中则仅含木焦醇(0.57%),而热风干燥没有检测到醇类化合物,可以看出冷冻干燥和酶解对醇类化合物影响较小,而真空、微波和热风干燥使醇类挥发性风味物质相对含量和数量降低,这可能是由于在干燥过程中随着温度的升高,醇类化合物会被氧化成醛类或酮类物质,也可能是发生酯化反应转化成酯类物质,导致含量降低以致未被检出[10]。冷冻干燥和酶解使茶褐牛肝菌含有1-辛烯-3-醇和麦角固醇,与新鲜样品相比1-辛烯-3-醇含量略微增加,它具有浓郁的蘑菇风味,被称为“蘑菇醇”,香气阈值较低[12],对茶褐牛肝菌的香气有重要贡献;麦角固醇的含量增加,且酶解大于冷冻干燥,说明酶解能提高麦角固醇的含量,它的存在可能是食用菌具有抗肿瘤、抗炎活性的原因之一[19],而真空、微波和热风干燥中均没有检测到,不同处理方式导致茶褐牛肝菌呈现不同的风味。
2.2.2 不同干燥方式和酶解对酯类化合物的影响 脂肪酸酯类物质挥发性较强,风味阈值低,具有类似水果的香气和酒的醇香[20]。新鲜、微波干燥和酶解的茶褐牛肝菌中分别检出4、2和4种酯类化合物,相对含量分别为35.06%、46.06%和48.76%,而在真空、冷冻和热风干燥中分别检测出5、3和2种酯类化合物,相对含量分别为11.09%、20.87%和6.21%,可以看出微波干燥和酶解能增加酯类化合物的含量,而真空、冷冻和热风干燥使酯类化合物含量降低,这可能是由于干燥时间延长和温度的升高,导致酯类化合物水解为醇类或酚类以及羧基化合物,然而微波干燥由于干燥时间短,水解反应发生较缓慢,从而较大程度的保留酯类物质,从化合物数量看,微波和热风干燥中酯类化合物数量显著降低(p<0.05),可能是由于热风流动和温度较高易带走小分子挥发性成分并造成热敏性化合物的分解[21],在所有样品中共有酯类化合物为邻苯二甲酸二(2-乙基己基)酯和(Z,Z)-9,12-十八二烯酸-2-羟基-1-(羟甲基)乙酯,且相对含量较高,在真空干燥中还检出一种新的酯类化合物11-十八碳烯酸甲酯。与新鲜样品相比,酶解样品酯类化合物含量增加,说明酶解对于茶褐牛肝菌风味感受的提升可能与酯类化合物增多有关。
2.2.3 不同干燥方式和酶解对酸类化合物的影响 新鲜、真空、冷冻、微波、热风干燥和酶解茶褐牛肝菌中检出酸类化合物数量分别为8、10、8、6、7和6种,相对含量分别为30.90%、76.00%、37.64%、34.31%、84.64%和21.61%,其中以亚油酸和棕榈酸相对含量较高,可以看出除了酶解样品,其他干燥样品中酸类化合物含量均升高,其中热风和真空干燥较为剧烈,这可能是由于温度较高导致一些酯类化合物分解转化和一些小分子化合物发生化学反应所致[10],这些化合物中亚油酸的相对含量最高,被认为是牛肝菌的主要香气,作为风味前物质可以转化为1-辛烯-3-醇和一些呋喃类的风味成分,对香气有重要贡献[14]。有研究表明一些挥发性酸类化合物具有刺鼻酸味和腥臭味,对食用菌香气有负的影响[22],与新鲜样品相比,酶解样品中酸类化合物含量降低,酯类化合物增加,这有可能是导致酶解提升食用菌风味和赋予特征香气的主要原因之一。
2.2.4 不同干燥方式和酶解对烷烃和烯烃类化合物的影响 烃类化合物是茶褐牛肝菌中种类最多的一类化合物,烷烃的香味阈值较高,对香气贡献作用不大,但是烷烃能提升牛肝菌中其他香气化合物对香气的贡献,而烯烃则有重要的香气贡献作用。在新鲜、真空、冷冻、微波、热风干燥和酶解茶褐牛肝菌中检出烃类化合物物数量分别为29、22、29、6、6和24种,相对含量分别为19.47%、5.38%、23.05%、6.23%、1.97%和15.24%,可以看出真空、微波和热风干燥中烃类化合物相对含量与数量均比其他三个样品大幅降低,其中热风干燥降低幅度最大,主要含有十六烷(0.28%)、二十一烯(0.40%)和角鲨烯(0.97%),与新鲜样品相比,冷冻干燥烃类化合物含量增加,主要含有角鲨烯(6.27%)、十六烷(2.0%)和十八烷(1.69%),这与姬松茸烃类挥发性成分变化一致[23],烃类物质是由于胡萝卜素分解和烷基自由基的脂质过氧化产生,出现这种现象的原因可能是随着温度的升高水分散失,烃类挥发性风味成分发生变化,空间结构发生改变,而真空和低温有利于脂肪酸烷氧自由基的裂解反应和其他的化学反应,易形成其他烃类物质。在所有样品均检到含量较高的角鲨烯,它具有抗氧化和抗衰老的功效,与新鲜样品相比冷冻干燥样品含量增加,其他样品含量均降低。
2.2.5 不同干燥方式和酶解对含N类化合物的影响 在新鲜茶褐牛肝菌、真空、冷冻、微波、热风干燥和酶解中检出含N类化合物数量分别为4、7、4、3、3和4种,相对含量分别为9.72%、3.65%、13.87%、11.06%、3.89%和8.55%,这些含N的化合主要来源是氨基酸和还原糖之间发生美拉德反应产生的产物或者副产物,还有蛋白质的降解和氨基酸的热解[24],其中共有成分是(Z)-9-十八烯酰胺、棕榈酰胺和齐墩果腈,(Z)-9-十八烯酰胺含量最高。可以看出,与新鲜样品相比,冷冻、微波干燥使含N化合物含量增加,其他干燥样品均降低,有可能是因为冷冻干燥适宜的温度和干燥时间使美拉德反应和蛋白质的降解反应持续进行,在真空干燥中检测到1-苯甲酰基-2-(吡咯烷基甲基)哌啶、N-(3-甲基亚丁基)-苯乙胺和4-苄基吡啶三种新的物质,可能是由于发生美拉德反应所产生的。与新鲜样品相比,酶解样品中含N类化合物种类和含量变化较小,说明酶解对于茶褐牛肝菌风味感受的提升与含N类物质无关。
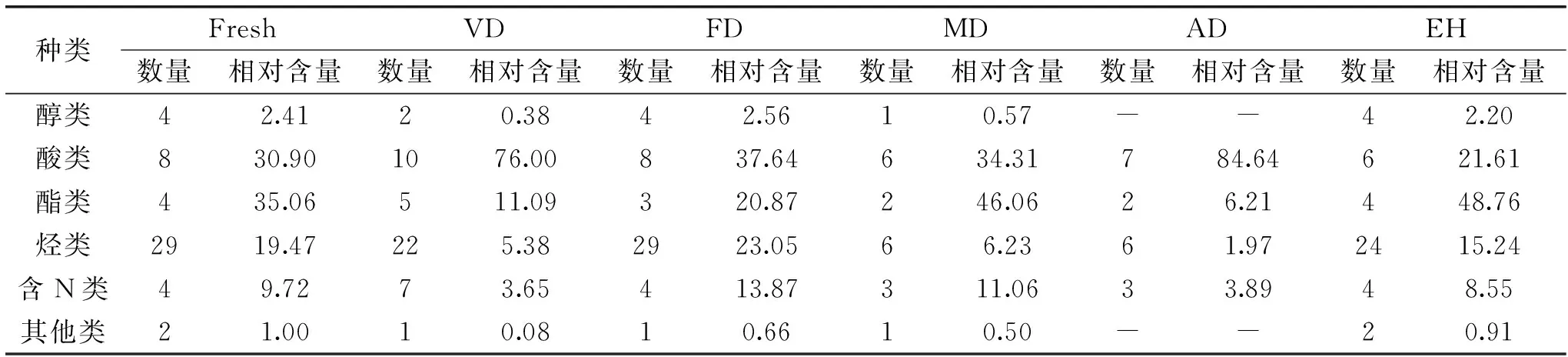
表2 不同干燥方法和酶解对茶褐牛肝菌挥发性化合物的分类比较(%)Table 2 The comparison of flavor compounds in N. brunneissimus by the different drying method and enzymolysis(%)
2.2.6 不同干燥方式和酶解对其他类化合物的影响 检测到两种其他类挥发性化合物分别是3-(2-氧代丙基)-环戊酮和2,2′-亚甲基-二(4-甲基-6-叔丁基)苯酚,在热风干燥中未检出这两个物质,大多数酮类和酚类物质阈值较高,在所有样品中相对含量较低,对茶褐牛肝菌的风味贡献不大,但有助于提升整体风味。在褐黄牛肝菌[14]和美味牛肝菌[12]均检测到吡嗪类化合物,这类化合物是氨基酸和还原性糖发生美拉德反应的产物,具有坚果、烧烤的气味,对食用菌风味的形成有很大的贡献[25],而在此研究中并未检测到吡嗪类化合物,原因可能是吡嗪类化合物生成的温度较高,约为120~150 ℃之间,而所采用的干燥方式和酶解的温度达不到吡嗪类化合物生成的温度导致吡嗪类化合物未检出[26],在所有样品中均未检出醛类、含硫类和醚类化合物,说明这些化合物对茶褐牛肝菌的风味形成贡献不大,也可能是挥发性成分萃取方法有所欠缺,还有待进一步改进研究。
2.3 不同干燥方式和酶解对茶褐牛肝菌挥发性风味成分的聚类分析
运用SPSS 19.0软件对不同干燥方式和酶解茶褐牛肝菌中的挥发性成分进行聚类分析,探讨不同样品之间的相似性和差异性。采用离差平方和法,用欧氏距离的平方作为样品之间相似度的度量标准,进行系统聚类分析,所得树状图结果见图2,可以看出所有样品最终聚合在一起,说明不同干燥方式和酶解的茶褐牛肝菌中挥发性化合物化学特征有一定的相似性,从最小欧氏距离来看,主要可以分为两小类,新鲜和冷冻干燥首先聚合成第一小类,其欧氏距离为1,说明二者相似性很高,从表2可知,二者各类挥发性化合物种类和含量差异不大。真空和热风干燥样品聚合成第二小类,其欧氏距离为3,说明二者也存在一定的相似性,主要表现在酸类化合物种类和含量上。随着欧式距离增加到3时,酶解样品与第一小类聚合组成第一大类,存在一定的相似性,主要表现在烃类化合物上;当欧式距离增加到4时,微波干燥样品与第二小类聚合组成第二大类,存在较小相似性。但当欧氏距离增加到25时,第一大类和第二大类才聚合到一起,说明它们相似度很低,挥发性化合物种类和含量差异较大,表明不同干燥方法和酶解对茶褐牛肝菌风味成分有较大影响,真空、微波和热风干燥在干燥过程中易造成挥发性化合物的损失,其中干燥时间和温度是主要因素,而冷冻干燥样品与新鲜样品相似度较高,能较大程度上保留新鲜茶褐牛肝菌的原始香气成分。
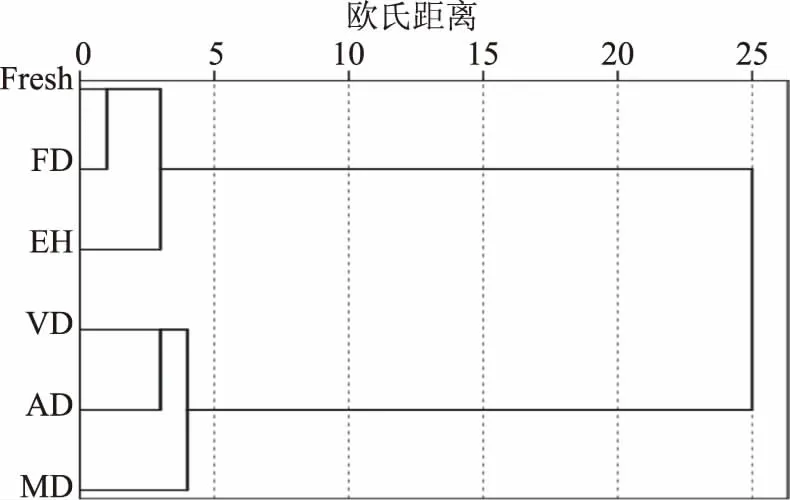
图2 不同干燥方式和酶解的茶褐牛肝菌挥发性成分数据聚类分析结果Fig.2 Clustering results of flavor components of N. brunneissimus by different drying method and enzymolysis
3 结论
通过对不同干燥方式和酶解处理的茶褐牛肝菌进行有机溶剂超声萃取后利用GC-MS分析其挥发性风味物质,新鲜茶褐牛肝菌主要香气成分为亚油酸、棕榈酸、邻苯二甲酸二(2-乙基己基)酯、角鲨烯和(Z)-9-十八烯酰胺,与鲜样相比,真空和热风干燥导致酸类化合物含量增加,主要香气成分为亚油酸、棕榈酸、反油酸和邻苯二甲酸二(2-乙基己基)酯。微波干燥导致酯类和酸类化合物含量增加,主要香气成分为邻苯二甲酸二(2-乙基己基)酯、(Z,Z)-9,12-十八二烯酸-2-羟基-1-(羟甲基)乙酯、亚油酸和棕榈酸。酶解导致酯类化合物增加,主要香气成分为邻苯二甲酸二(2-乙基己基)酯、亚油酸、棕榈酸和(Z)-9-十八烯酰胺。冷冻干燥样品中各类风味成分变化较小,主要香气成分为亚油酸、棕榈酸、反油酸、邻苯二甲酸二(2-乙基己基)酯、角鲨烯和(Z)-9-十八烯酰胺。聚类分析反映出冷冻干燥样品与新鲜样品具有较高的相似度,说明冷冻干燥处理后的茶褐牛肝菌与鲜茶褐牛肝菌在整体风味成分上较为接近,冷冻干燥能够较好的保持茶褐牛肝菌的原有风味,有利于加工保存,对云南茶褐牛肝菌的加工保存和开发利用提供了一定的理论依据和参考价值。
[1]Wu G,Zhao K,Li Y C,et al. Four new genera of the fungal family Boletaceae[J]. Fungal Diversity,2016,81(1):1-24.
[2]戴玉成,周丽伟,杨祝良,等. 中国食用菌名录[J]. 菌物学报,2010,29(1):1-21.
[3]刘佳,高敏,吴克枫,等. 野生牛肝菌保健功能研究[J]. 中国卫生工程学,2011,10(3):224-226.
[4]孙丽平,常惟丹,鲍长俊,等. 云南产6种野生食用牛肝菌的营养成分及抗氧化特性研究[J]. 现代食品科技,2016,32(12):279-286.
[5]朱萍,郭永红,丁晓雯,等. 四种鲜牛肝菌成分分析[J]. 中国食用菌,2006,25(4):44-46.
[6]苏尔广. 云南野生食用菌资源状况及产业发展分析[J]. 农村经济与科技,2011,22(5):26-27.
[9]Li X,Feng T,Zhou F,et al. Effects of drying methods on the tasty compounds of Pleurotus eryngii[J]. Food Chemistry,2015,166:358-364.
[10]Tian Y,Zhao Y,Huang J,et al. Effects of different drying methods on the product quality and volatile compounds of whole shiitake mushrooms[J]. Food Chemistry,2016,197(Pt A):714-722.
[11]唐秋实,刘学铭,池建伟,等. 不同干燥工艺对杏鲍菇品质和挥发性风味成分的影响[J]. 食品科学,2016,37(4):25-30.
[12]曹蓓,齐玉刚,张春霞,等. 固相微萃取-气相色谱-质谱及气相色谱-嗅闻技术分析美味牛肝菌风味活性物质[J]. 食品工业科技,2013,34(10):133-137.
[13]李文,谷镇,杨焱,等. 黄牛肝菌中挥发性成分的GC-MS
分析[J]. 食品与生物技术学报,2012,31(8):871-878.
[14]李巍巍,吴时敏,徐婷. 褐黄牛肝菌挥发性风味物质组成研究[J]. 上海交通大学学报:农业科学版,2009,27(3):300-304.
[15]王肖肖. 云南五种野生食用菌呈味物质研究[D]. 昆明:昆明理工大学,2015:15-50.
[16]唐秋实,刘学铭,陈智毅,等. 金针菇的酶解工艺及热反应风味成分分析[J]. 中国食品学报,2016,16(2):91-97.
[17]张玉玉,陈怡颖,孙颖,等. 牛肝菌及其酶解液挥发性风味成分的对比分析[J]. 中国食品学报,2016,16(11):233-239.
[18]Li S,Li X,Lamikanra O,et al. Effect of cooking on physicochemical properties and volatile compounds in lotus root(Nelumbo nucifera Gaertn)[J]. Food Chemistry,2017,216:316-323.
[19]Ana V,Laura M V,Ana G L,et al. Storage temperature and UV-irradiation influence on the ergosterol content in edible mushrooms[J]. Food Chemistry,2014,147(4):252-256.
[20]Sun W,Zhao Q,Zhao H,et al. Volatile compounds of Cantonese sausage released at different stages of processing and storage[J]. Food Chemistry,2010,121(2):319-325.
[21]刘春菊,李大婧,刘春泉. 不同干燥方式对慈姑挥发性风味成分影响[J]. 食品工业科技,2015,36(21):102-106
[22]王成忠,任慧贤. 食品风味化学进展[J]. 中国调味品,2011,36(5):8-11.
[23]张艳荣,吕呈蔚,刘通,等. 不同干燥方式对姬松茸挥发性风味成分分析[J]. 食品科学,2016,37(10):116-121.
[24]Sadeghi A A,Shawrang P. Effects of microwave irradiation on ruminal dry matter,protein and starch degradation characteristics of barley grain[J]. Animal Feed Science & Technology,2008,141(1):184-194.
[25]Alasalvar C,Shahidi F,Cadwallader K R. Comparison of natural and roasted turkish tombul hazelnut(corylus avellana L.)volatiles and flavor by DHA/GC/MS and descriptive sensory analysis[J]. Journal of Agricultural & Food Chemistry,2003,51(17):5067-5072.
[26]Pei F,Yang W,Ma N,et al. Effect of the two drying approaches on the volatile profiles of button mushroom(Agaricus bisporus)by headspace GC-MS and electronic nose[J]. LWT-Food Science and Technology,2016,72:343-350.
EffectsofdifferentdryingmethodsandenzymolysisonvolatileflavorcompoundsinNeoboletusbrunneissimus
ZHOUChao,HUANGYu-yi,HUXu-jia*
(Faculty of Life Science and Technology,Kunming University of Science and Technology,Kunming 650500,China)
In order to study the effects of volatile flavor compounds ofNeoboletusbrunneissimusby different drying methods and enzymolysis,the volatile flavor compounds ofN.brunneissimusin fresh,vacuum drying,freeze drying,microwave drying,hot air drying and enzymolysis were extracted by ultrasonic solvent extraction and determined by gas chromatography mass spectrometry(GC-MS). The results showed that a total of 51,47,49,19,18,44 compounds were detected under different drying methods and enzymolysis. The similarity of volatile components of theN.brunneissimusprocessed by different drying methods and enzymolysis could be reflected by cluster analysis. Alcohol,acids,esters,and hydrocarbon were changed remarkably after four dehydrations and enzymolysis. The contents of alcohol and hydrocarbon were reduced,except those processed with freeze drying. The contents of esters were reduced,except those in microwave drying and enzymolysis. The volatile flavor components ofN.brunneissimusby freeze drying were close to those of the fresh sample on the whole and have high similarity with it,suggesting that freeze drying method can protect the volatile flavor components ofN.brunneissimusbetter.
Neoboletusbrunneissimus;drying methods;enzymolysis;flavor compounds;GC-MS;cluster analysis
2017-04-18
周超(1991-),男,在读硕士研究生,研究方向:食品药品分析检测和质量控制,E-mail:zhouchao0871@163.com。
*通讯作者:胡旭佳(1968-),女,博士,教授,研究方向:食品药品分析检测和质量控制,E-mail:huxjia@gmail.com。
国家自然科学基金资助项目(31460430,31660437)。
TS201.1
A
1002-0306(2017)23-0203-07
10.13386/j.issn1002-0306.2017.23.038
