miR-124对皮层神经细胞活力的影响
2017-12-18刘得水赵阿勐赵丽晖何志磊梁雪梅
刘得水,赵阿勐,赵丽晖,王 娜,,何志磊,梁雪梅⋆
(1.齐齐哈尔医学院附属第二医院,黑龙江 齐齐哈尔 161006;2.齐齐哈尔医学院,黑龙江 齐齐哈尔 161006)
·基础研究·
miR-124对皮层神经细胞活力的影响
刘得水2,赵阿勐2,赵丽晖1,王 娜1,2,何志磊2,梁雪梅1⋆
(1.齐齐哈尔医学院附属第二医院,黑龙江 齐齐哈尔 161006;2.齐齐哈尔医学院,黑龙江 齐齐哈尔 161006)
目的探讨miR-124对原代培养乳鼠的皮层神经细胞活力的影响。方法原代培养乳鼠皮质神经细胞,转染miR-124或anti-miR-124并设定对照实验,采用LDH试剂盒分别测定1 h,3 h,6 h,12 h,24 h的LDH释放率和神经活力。结果过表达miR-124后的神经细胞LDH释放率显著低于对照组,而且神经细胞活力显著高于对照组神经细胞,差异有统计学意义(P<0.05)。结论miR-124可以减少神经细胞损伤,发挥神经保护作用。
MiR-124;神经细胞;神经保护
microRNA(miRNA)是一类长度约为21~23个核苷酸构成的调控性小RNA分子,它可以通过碱基配对的方式结合到靶基因mRNA 3'非翻译区(3'UTR),从而对靶基因进行负性调控[1]。miRNA不仅影响着机体的正常生命活动,而且参与疾病发生的病理过程[2-3]。miRNA在机体的表达具有组织特异性,因此对靶基因的转录后水平调控也具有针对性[4]。神经组织当中也具有丰富miRNA,并对神经突触可塑性发挥着重要的作用。大脑miR-124表达异常与多种神经精神系统疾病相关[5]。本项目为揭示miR-124在神经系统中所发挥作用,采用原代培养脑皮质神经细胞并通过miR-124和其抑制剂anti-miR-124进行干扰,观察其对皮层神经细胞活力的影响。
1 材料与仪器
1.1 材料
购买于大连医科大学实验动物医学部的9周龄SPF级Sprague-Dawley(SD)大鼠,经雌雄合笼获得子代新生24 h的SD乳鼠。
1.1.1 试剂
DMEM/F12培养基(Hyclone公司);灭活胎牛血清(Hyclone);miR-124 mimics,mimics control,anti-miR-124 inhibitor,anti-miRNA control(Ambion公司);LDH试剂盒(Andy Bio公司)。
1.1.2 仪器
酶标仪(Thermo公司)。
1.2 方法
1.2.1 原代培养皮质神经细胞及鉴定
新生24 h SD乳鼠,剥离皮质,剪碎,800转/min*3离心弃上清,消化。加入含胎牛血清的DMEM/F12培养基终止消化,过滤,离心弃上清。加入培液混匀,置于37℃含5% CO2的培养箱内培养。培养24 h后,换成含神经营养因子的培养液进行培养。72 h后,加入阿糖胞苷,选取对数生长期细胞进行实验。
1.2.2 分组
按照不同的处理分为pre-miRNA control,premiR-124,anti-miRNA control,anti-miR-124,共4组,同时设三组平行对照。
1.2.3 转染
接种2×105/mL个神经细胞接种至6孔板中。细胞密度长至60~70%融合度时进行转染。配置溶液Opti-MEM培养基+ Lipofectamine 2000溶液,Opti-MEM培养基稀释pre-miRNA control/pre-miR-124或anti-miRNA control/anti-miR-124,二者轻轻混匀,室温放置20 min。弃培液,加入Opti-MEM培养基,并将上述混合液加入培养液中。6 h后换液,置37℃含5% CO2的培养箱内培养。
采用LDH试剂盒检测LDH释放率转染24 h后,重新铺96孔板,于1 h,3 h,6 h,12 h,24 h检测神经细胞LDH释放率。
1.3 统计学方法
采用SPSS 16.0统计学软件对数据进行分析,计量资料以“±s”表示,采用t检验;计数资料采用x2检验;以P<0.05为差异有统计学意义。
2 结 果
2.1 miR-124及其抑制剂anti-miR-124对神经细胞LDH释放率的影响
结果显示,与对照组比较,体外转染miR-124的神经细胞LDH释放率降低,而转染anti-miR-124显著提高了神经细胞的LDH释放率,差异有统计学意义(P<0.05)。(见图1)。
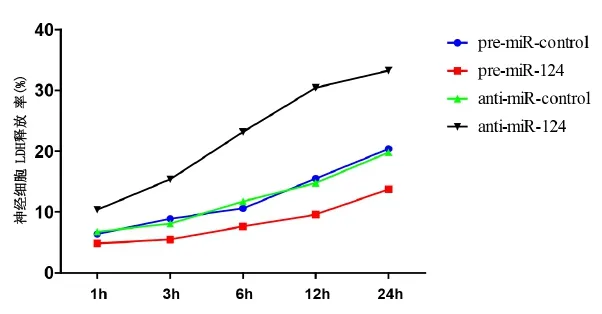
图1 miR-124和anti-miR-24对神经细胞LDH释放率的影响(n=3,±s)
3 讨 论
miRNA是普遍存在于生物体内一类小RNA,它具有非常广的调控作用[2]。在哺乳动物的神经细胞中也存在大量的miRNAs,它们对于神经分化和神经突触可塑性具有相当重要的作用,从而影响机体的学习与记忆等神经系统功能[3]。
在颞叶癫痫患者和动物模型脑组织中miR-124的表达均降低,这些改变提示miR-124可能参与癫痫的发生和形成过程[6]。在帕金森病中,多巴胺能神经元的miR-124通过调控AMPK/mTOR通路调节神经的细胞凋亡和自噬和保护[7],提高脑的修复功能[8]。
本项目采用LDH试剂盒检测经miR-124及其抑制剂anti-miR-124对神经细胞LDH释放率的影响。LDH释放率越高,表明细胞损伤越重。随着转染时间的延长,miR-124能够延缓神经细胞的LDH的释放率上升,提示其可能对神经细胞具有保护作用。而给予miR-124抑制剂anti-miR-124显著提高了LDH的释放率,提示其可能对神经细胞具有损伤作用。本研究进一步解释了miR-124在神经系统的功能中可能发挥重要的作用。但是miR-124表达异常在疾病发生中的作用还有待今后通过不同的动物和细胞模型及不同的分子生物学方法进一步验证。
[1] Bartel DP.MicroRNAs: target recognition and regulatory functions[J].Cell,2009,136(2):215-233.
[2] Papadopoulos T,Casemayou A,Neau E,et al.Systems biology combining human and animal-data miRNA and mRNA data identi fi es new targets in ureteropelvic junction obstruction[J].BMC Syst Biol,2017,11(1):31.
[3] Lampe L,Levashina EA.The role of microRNAs in Anopheles biology-an emerging research field[J].Parasite immunology,2017,39.
[4] Oliveto S,Mancino M,Manfrini N,Biffo S.Role of microRNAs in translation regulation and cancer[J].World journal of biological chemistry,2017,8:45-56.
[5] Higuchi F,Uchida S,Yamagata H,Abe-Higuchi N,et al.Hippocampal MicroRNA-124 Enhances Chronic Stress Resilience in Mice[J].The Journal of neuroscience:the official journal of the Society for Neuroscience,2017,36:7253-7267.
[6] Wang W,Wang X,Chen L,et al.The microRNA miR-124 suppresses seizure activity and regulates CREB1 activity[J].Expert Rev Mol Med,2016,21,18:e4.
[7] Gong X,Wang H,Ye Y,et al.miR-124 regulates cell apoptosis and autophagy in dopaminergic neurons and protects them by regulating AMPK/mTOR pathway in Parkinson's disease[J].Am J Transl Res,2016,8(5):2127-2137.
[8] Saraiva C,Paiva J,Santos T,et al.MicroRNA-124 loaded nanoparticles enhance brain repair in Parkinson's disease[J].J Control Release,2016,235:291-305.
R749.94
B
ISSN.2095-8242.2017.067.13092.02
齐齐哈尔市科学技术计划项目(No.SFGG-201529)
梁雪梅
本文编辑:赵小龙
