慢性阻塞性肺疾病合并肺癌的临床特点分析
2017-12-18蔡静静苗健龙周金花张影影刘瑞娟
蔡静静, 苗健龙, 周金花, 张影影, 刘瑞娟
(1.山东省医学科学院附属济宁市第一人民医院 呼吸内科,山东 济宁 272100;2.济南大学 山东省医学科学院医学与生命科学学院,山东 济南 250022)
·论著·
慢性阻塞性肺疾病合并肺癌的临床特点分析
蔡静静1,2, 苗健龙1, 周金花1, 张影影1,2, 刘瑞娟1
(1.山东省医学科学院附属济宁市第一人民医院 呼吸内科,山东 济宁 272100;2.济南大学 山东省医学科学院医学与生命科学学院,山东 济南 250022)
目的分析慢性阻塞性肺疾病(COPD)合并肺癌患者的临床特点,提高临床对COPD合并肺癌的认识。方法回顾性分析COPD合并肺癌患者98例和同期住院单纯COPD患者108例,对两组患者临床资料进行统计学分析。结果COPD合并肺癌组患者的咯血或痰中带血、胸痛、肺不张、声音嘶哑、胸腔积液、消瘦均显著高于单纯COPD组患者 (P<0.05);COPD合并肺癌组男性患者显著多于单纯COPD组(86.7% vs 71.3%,P<0.05);单纯COPD组患者年龄高于COPD合并肺癌组(P<0.01);COPD合并肺癌组吸烟指数显著高于单纯COPD组(P<0.01);COPD合并肺癌组患者肺功能分级在Ⅰ 级、Ⅱ级的人数显著多于单纯COPD组(62.9% vs 54.3%,P=0.047;78.7% vs 21.3%,P<0.01);COPD合并肺癌组的患者,肺鳞癌比例最高(43.9%),男性以肺鳞癌常见(48.2%),女性以肺腺癌多见(53.8%)。结论当具有COPD病史的患者出现咯血或痰中带血、胸痛、肺不张、声音嘶哑、胸腔积液、消瘦的临床表现及体征时,要注意警惕合并肺癌的可能。COPD合并肺癌好发于男性大量吸烟的患者,气道阻塞较轻的COPD患者容易发生肺癌,病理类型以肺鳞癌最常见。
肺疾病,阻塞性;肺肿瘤;体征和症状
慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)是一种常见的、可以预防和治疗的疾病,以持续呼吸症状和气流受限为特征,通常是由于明显暴露于有毒颗粒或气体引起的气道和(或)肺泡异常所致[1]。COPD在我国40岁以上人群中发病率约为8.2%,COPD致死率及致残率高,是全球第4位致死疾病及第2位致残疾病。肺癌是主要发生于支气管黏膜上皮及腺体的常见恶性肿瘤,肺癌的严重程度是众所周知的,肺癌是全世界癌症相关死亡的主要原因[2]。二者均与肺部对香烟烟雾等有害气体或气道慢性炎症反应有关,且COPD患者发生肺癌的风险增加。COPD和肺癌都是可以对肺组织造成破坏的疾病[3]。肺癌是COPD的常见并发症之一,Sin等[4]对COPD患者死亡的原因进行分析,发现轻中度COPD患者死亡的主要原因是肺癌。慢性呼吸系统疾病患者罹患肺癌的风险较高,COPD是一种慢性炎症性肺病,与肺癌易感性密切相关,并且是吸烟人群发生肺癌最重要的危险因素[5]。肺功能分级为中度至重度COPD患者发生肺癌的风险是吸烟者不合并COPD患者5倍[6]。在临床上时常遇到COPD合并肺癌的患者,二者早期的临床症状相似,如均表现为咳嗽、咳痰、呼吸困难等症状,往往认为是单纯COPD急性加重,容易造成漏诊误诊,从而延误治疗时机,导致预后不良。为了减少误诊、漏诊的发生,进一步提高COPD合并肺癌的早期诊断率,我们对COPD合并肺癌的高危因素、临床症状、病理类型、肺功能等临床资料进行回顾性分析,探讨其临床特点,为临床工作提供支持。
1 资料与方法
1.1病例选择 选择2015年1月至2017年1月济宁市第一人民医院呼吸内科住院治疗的COPD合并肺癌患者和同期住院的单纯COPD患者。COPD合并肺癌患者98例,男85例,女13例,年龄39~86岁,平均(66.48±1.14)岁,吸烟指数(1 426.53±380.60)支/年,咳嗽90例,咳痰89例,咯血或痰血41例,呼吸困难60例,胸痛26例,发热24例,肺不张28例,声音嘶哑6例,胸腔积液14例,消瘦34例,肺功能分级:Ⅰ级22例,Ⅱ级59例,Ⅲ级14例,Ⅳ级3例,病理类型:肺鳞癌41例,肺腺癌20例,小细胞肺癌23例,其他1例;单纯COPD患者108例,男77例,女31例,年龄46~91岁,平均(73.74±7.03)岁,吸烟指数(722.22±752.98)支/年,咳嗽100例,咳痰102例,咯血或痰血5例,呼吸困难105例,胸痛2例,发热21例,肺不张3例,声音嘶哑0例,胸腔积液4例,消瘦6例,肺功能分级:Ⅰ级13例,Ⅱ级16例,Ⅲ级48例,Ⅳ级31例,病理类型:肺鳞癌2例,肺腺癌7例,小细胞肺癌3例,其他1例。 所有入选患者符合以下纳入及剔除标准。
1.2纳入标准 ①经无痛支气管镜、超声或CT引导下肺穿刺、锁骨上淋巴结穿刺、胸水或痰找瘤细胞取得组织标本或细胞学标本,由两名病理学家使用苏木精及伊红染色证实了肺癌的诊断;②TNM分期采用国际肺癌研究协会(IASLC)2009年第7版分期标准(IASLC 2009);③COPD患者的诊断符合以下标准:根据2017年《慢性阻塞性肺疾病防治全球创议》(Global Initiative for Chronic Obstructive Lung Disease, GOLD)[1],即当患者存在憋喘、慢性咳嗽、咳痰的呼吸症状,以及宿主因素、职业、室内/外污染的危险因素时,吸入支气管舒张剂后第一秒用力呼气容积(forced expiratory volume in one second, FEV1)/用力肺活量(forced vital capacity, FVC)<70%,即明确存在持续气流受限,除外支气管扩张、支气管哮喘、 闭塞性支气管炎等引起气流受限的疾病,可确诊为COPD;④COPD肺功能分级[7]:根据吸入支气管舒张剂后FEV1占预计值的百分比将气流受限程度分为4级:Ⅰ级(轻度):FEV1占预计值%≥80%,Ⅱ级(中度):50%≤FEV1占预计值%<80%,Ⅲ级(重度):30%≤FEV1占预计值%<50%,Ⅳ级(极重度):FEV1占预计值%<30%或FEV1占预计值%<50%并伴有慢性呼吸衰竭;⑤性别、年龄、吸烟指数、肺癌标志物、临床表现、病理类型、肺功能等临床资料详细完整。
1.3剔除标准 有严重心、肝、肾等疾病者;具有肺结核、支气管扩张、肺间质纤维化病史的病例。
1.4资料收集 通过电子病历系统,调阅患者病历,获取患者的临床基线资料及检查治疗信息。本研究收集患者性别、年龄、吸烟指数、临床症状、胸部CT、病理类型、肺功能等信息。
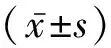
2 结 果
2.1临床症状、体征比较 两组主要临床症状均为咳嗽、咳痰、憋喘,其中COPD合并肺癌组咯血或痰中带血、胸痛、肺不张、声音嘶哑、胸腔积液、消瘦患者所占比例均显著高于单纯COPD组,两组比较差异有统计学意义(P<0.05)。见表1。
2.2性别、年龄、吸烟指数比较 单纯COPD组年龄高于COPD合并肺癌组(P<0.05);COPD合并肺癌组男性患者所占比例显著多于单纯COPD组(P<0.01);COPD合并肺癌组吸烟指数显著高于单纯COPD组(P<0.01)。见表2。
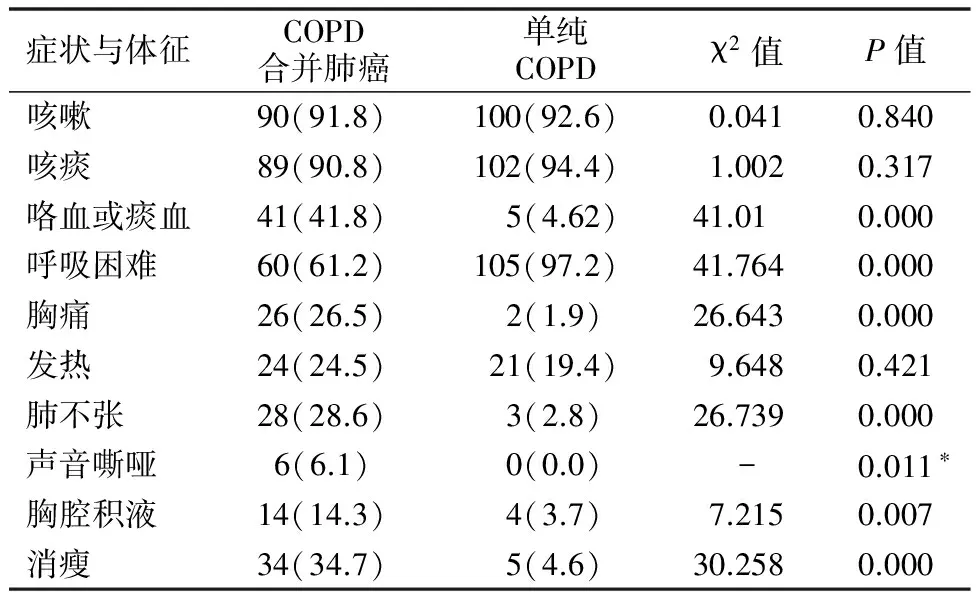
表1 COPD合并肺癌组与单纯COPD组临床症状、体征比较[例(%)]
注:*采用Fisher精确概率检验法
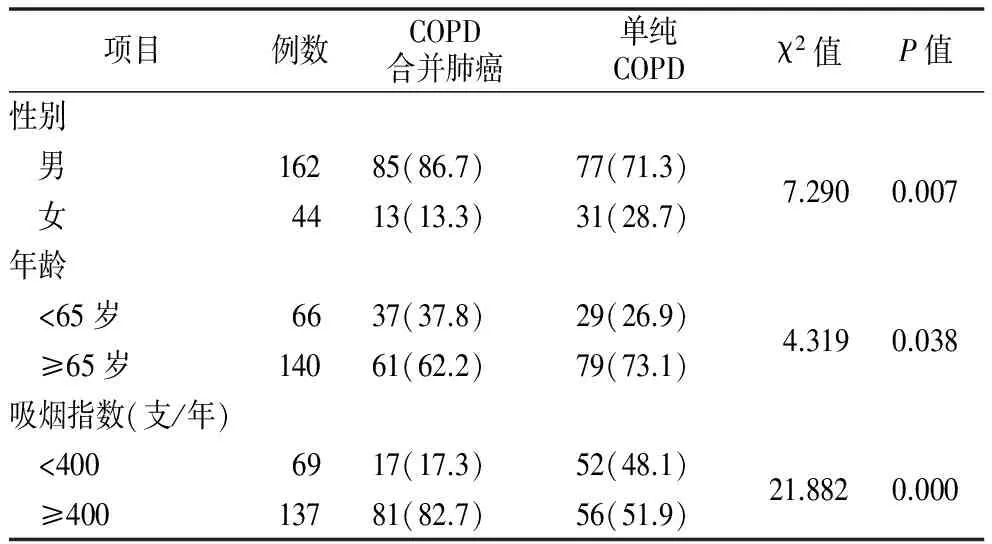
表2 COPD合并肺癌组与单纯COPD组性别、年龄、吸烟指数比较[例(%)]
注:吸烟指数=每天吸烟支数×吸烟年数
2.3肺功能分级比较 COPD合并肺癌组肺功能分级在Ⅰ 级、Ⅱ级的人数比例显著多于单纯COPD组;单纯COPD组肺功能在Ⅲ级、Ⅳ级的人数比例显著多于COPD合并肺癌组。见表3。
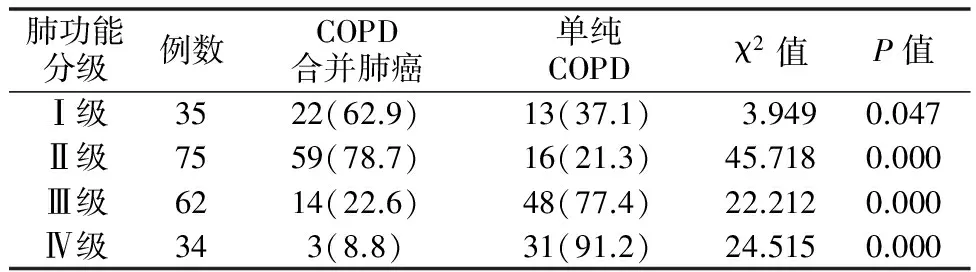
表3 COPD合并肺癌组与单纯COPD组肺功能分级比较[例(%)]
2.4COPD合并肺癌患者病理类型 COPD合并肺癌组肺鳞癌比例最高(43.9%),男性肺腺癌及肺鳞癌所占比例显著高于女性,小细胞肺癌在不同性别患者中,差异无统计学意义。见表4。
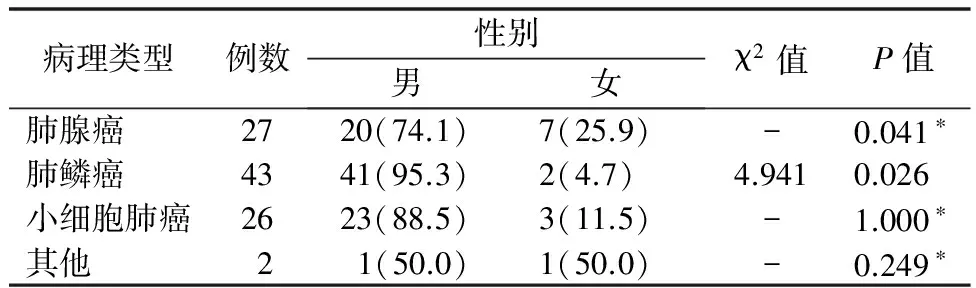
表4 COPD合并肺癌患者在男、女患者中病理类型比较[例(%)]
注:*采用Fisher精确概率检验法
3 讨 论
COPD合并肺癌组和单纯COPD组比较,两组主要临床症状均为咳嗽、咳痰、憋喘,当COPD患者出现咯血或痰中带血、呼吸困难、胸痛、声音嘶哑、胸腔积液、消瘦等临床表现时,需要警惕合并肺癌的可能。对COPD患者要定期复查影像,如每半年给患者检查1次胸部正位片是发现早期肺癌的一种筛查方法。国外学者研究表明,对于大量吸烟,年龄大于45岁的COPD患者,1次/年胸片筛查可能使病死率降低10%[8]。在肺癌筛查中,美国预防服务专案组(USPSTF) 推荐低剂量CT(LDCT)[9]。LDCT可以在较短的扫描时间内,取得良好的空间分辨率,能清楚地显示肺组织的细微结构,几乎达到能显示与大体标本相似的形态学改变[10]。肖瑶等[11]对22例COPD合并肺癌的患者进行临床分析,发现77%患者有吸烟史。曾茄等[12]也发现相似的结果,COPD合并肺癌患者中吸烟者占77.8%,并且全为男性。本研究发现COPD合并肺癌组吸烟指数显著高于单纯COPD组,进一步说明吸烟是COPD及肺癌患者的危险因素。Jemal等[13]发现,吸烟者中有15%会发生肺癌,肺癌患者中90%以上都与吸烟有关。De-Torres等[14]研究发现长久大量的吸烟会额外增高COPD患者发生肺癌的风险。Calabro等[15]研究表明,COPD吸烟者发生肺癌的风险比无COPD吸烟者增高2~5倍,且肺癌发生风险随肺功能受损严重程度的增加而增加。因此,应该建议COPD患者及时戒烟。本研究中,COPD合并肺癌患者在肺功能分级Ⅱ级患者中高达60.2%,COPD合并肺癌组患者在肺功能分级Ⅰ级、Ⅱ级的人数显著多于单纯COPD组患者。de Torres等[16]研究发现,轻中度(GOLDⅠ-Ⅱ)COPD 患者肺癌发生率显著高于(GOLDⅢ-Ⅳ) COPD患者,即在气道阻塞较轻的老年COPD患者,肺癌发病率高,这与我们研究结果一致。但是,一项具有高风险吸烟者的大型前瞻性研究表明气流受限的严重程度与肺癌风险之间存在强烈的线性关系[17]。因此,对于COPD患者要定期复查肺功能,动态观察肺功能变化。
本研究对98例COPD合并肺癌患者的病理类型进行分析,发现肺鳞癌患者最多,比例高达43.9%(43/98),男性患者以肺鳞癌常见,女性患者以肺腺癌多见。杨鹏等[18]对793例云南籍肺癌患者的临床特征进行分析,发现了同样的结果。聂晓红等[19]对COPD合并肺癌患者的病理类型进行临床分析,发现肺鳞癌在总体中占46%(69/150),也认为男性以鳞癌为主,女性以腺癌为主。
COPD和肺癌是一类通常共存并且存在许多临床挑战的肺部破坏性疾病,COPD合并肺癌的治疗是具有挑战性的,因为COPD可增加手术风险、术后发病率及降低存活率[20]。最近De-Torres等[21]设计了一种预后模型(COPD-LUCSSDLCO)进一步证明了COPD合并肺癌的患者有更高的死亡风险。Kurishima等[22]研究表明最大可能减轻COPD合并肺癌患者的临床症状,改善及提高生存质量是治疗的主要目标。
由于本研究是回顾性分析,资料来源于呼吸科出院病历,使纳入组的COPD合并肺癌、单纯COPD组的患者数量和影响因素受到了一定限制,仅对患者的性别、年龄、吸烟指数、临床症状、病理类型、肺功能等进行了分析,没有对COPD合并肺癌患者的生存期进行随访。总之,COPD与肺癌的发病之间存在很多共同危险因素,这些危险因素可以单一或混合促进COPD向肺癌发展。我们应该对COPD或CT检测到肺气肿患者尽早实施肺癌预防及筛查策略,比如说戒烟及减少二手烟的暴露;给予COPD患者长效支气管扩张剂及糖皮质激素联合制剂吸入来改善临床症状,研究表明吸入糖皮质激素对肺癌有预防作用,Kiri等[23]的病例对照研究表明,COPD者长期规律吸入布地奈德,将显著减少肺癌发生的风险;半年行1次胸部影像学检查;动态观察肺功能变化。若影像异常或肺功能为中度,要注意警惕合并肺癌的可能。
[1] Global Initiative for Chronic Obstructive Lung Disease.Global Strategy for the Diagnosis,Management and Prevention of COPD(2017 Report)[S/OL].[2016-11-16] [2016-12-9].http://goldcopd.org.html.
[2] Ferlay J, Soerjomataram I, Dikshit R, et al.Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012[J]. Int J Cancer,2015,136(5):E359-E386.
[3] GBD 2013 Mortality and Causes of Death Collaborators.Global.regional, and national age-sex specific all-cause and cause-specific mortality for 240 causes of death, 1990-2013:a systematic analysis for the Global Burden of Disease Study 2013[J]. Lancet,2015,385(9963):117-171.
[4] Sin DD, Anthonisen NR, Soriano JB,et al.Mortality in COPD: role of comorbidities[J].Eur Respir J,2006,28(6):1245-1257.
[5] Wang X. New biomarkers and therapeutics can be discovered during COPD-lung cancer transition[J]. Cell Biol Toxicol,2016,32(5):359-361.
[6] Barreiro E, Bustamante V, Curull V,et al.Relationships between chronic obstructive pulmonary disease and lung cancer: biological insights[J].J Thorac Dis,2016,8(10):E1122-E1135.
[7] 朱蕾,周营营.回复“对阻塞性通气功能障碍严重程度与慢性阻塞性肺疾病严重程度标准的疑惑”[J].中华结核和呼吸杂志,2009,32(4):319-320.
[8] Wang J,Spitz MR,Amos CI,et al.Mediating effects of smoking and chronic obstructive pulmonary disease on the relation between the CHRNA5-A3 genetic locus and lung canccr risk[J].Cancer,2010,116(14):3458-3462.
[9] Moyer VA. Screening for lung cancer:U.S.Preventive Services Task Force recommendation statement[J]. Ann Intern Med,2014,160(5):330-338.
[10] Liu S,Zhou Y,Wang X,et al.Biomass fuels are the probable risk factor for chronic obstructive pulmonary disease in rural South China[J]. Thorax,2007,62(10): 889-897.
[11] 肖瑶,杨京华,张蔚,等.慢性阻塞性肺疾病合并肺癌的临床分析[J].临床荟萃,2002,17(24):1434.
[12] 曾茄,马兵,石平.慢性阻塞性肺疾病合并肺癌的临床研究[J].实用心脑肺血管病杂志,2010,18(12):1819-1820.
[13] Jemal A, Siegel R, Ward E, et al. Cancer stasistics,2009[J].Ca Cancer J Clin,2009,59(4):225-249.
[14] De-Torres JP, Wilson DO, Sanchez-Salcedo P, et al. Lung cancer in patients with chronic obstructive pulmonary disease. Development and validation of the COPD Lung Cancer Screening Score[J]. Am J Respir Crit Care Med,2015,191(3):285-291.
[15] Calabro E,Randi G,La Vecchia C, et al. Lung function predicts lung cancer risk in smokers:a tool for targeting screening programmes[J].Eur Respir J,2010,35(1):146-151.
[16] de Torres JP,Marin JM,Casanova C,et al.Lung cancer in patients with chronic obstructive pulmonary disease-incidence and predicting factors[J].Am J Respir Crit Care Med,2011,184(8):913-919.
[17] Hopkins RJ,Duan F,Chiles C, et al. Reduced Expiratory Flow Rate among Heavy Smokers Increases Lung Cancer Risk. Results from the National Lung Screening Trial-American College of Radiology Imaging Network Cohort.[J].Ann Am Thorac Soc, 2017,14(3):392-402.
[18] 杨鹏,谢琳,杨鑫,等.793例云南籍肺癌患者特征分析[J].昆明医科大学学报,2013,34(1):65-67.
[19] 聂晓红,张剑,罗立.慢性阻塞性肺疾病合并肺癌临床特点及肺功能分析[J].临床肺科杂志,2016,21(8):1478-1481.
[20] Dai J,Yang P, Cox A, et al.Lung cancer and chronic obstructive pulmonary disease: From a clinical perspective[J].Oncotarget,2017,8(11):18513-18524.
[21] De-Torres JP, Marin JM, Casanova C, et al. Identification of COPD patients at high risk for lung cancer mortality using the COPD-LUCSS-DLCO[J].Chest,2016,149(4):936-942.
[22] Kurishima K,Satoh H,Ishikawa H,et al.Lung cancer patients with chronic obstructive pulmonary disease[J].Oncol Rep,2001,8(1):63-65.
[23] Kiri VA, Fabbri LM, Davis KJ, et al. Inhaled corticosteroids and risk of lung cancer among COPD patients who quit smoking[J]. Respir Med,2009, 103(1):85-90.
Clinicalfeaturesofchronicobstructivepulmonarydiseasewithlungcancer
Cai Jingjing1,2, Miao Jianlong1, Zhou Jinhua1, Zhang Yingying1,2, Liu Ruijuan1
1.DepartmentofRespiratoryMedicine,JiningFirstPeople'sHospitalaffiliatedtoShandongAcademyofMedicalSciences,Jining272100,China; 2.SchoolofMedicineandLifeSciences,UniversityofJinan,ShandongAcademyofMedicalSciences,Jinan250022,China
LiuRuijuan,Email:mqb_6@163.com
ObjectiveIn order to analyze the clinical characteristics of patients with chronic obstructive pulmonary disease (COPD) and lung cancer, to improve the clinical understanding of COPD with lung cancer.MethodsRetrospective analysis was performed in 98 patients of COPD with lung cancer and the same pospitalized period 108 patients with simple COPD. The clinical data of two groups were analyzed with statistics.ResultsCOPD combined with lung cancer patients were significantly higher in hemoptysis or sputum bloody, chest pain, atelectasis, hoarseness, pleural effusion, weight loss than patients with COPD alone (P<0.05);The male patients with COPD combined with lung cancer were significantly more than COPD alone(86.7% vs 71.3%,P<0.05);Patients with COPD were older than COPD with lung cancer (P<0.01);The smoking index of COPD with lung cancer group was significantly higher than that of COPD alone (P<0.01);The lung function classification of COPD patients with lung cancer group in the first and second grade were significantly more than those of COPD alone(62.9% vs 54.3%,P=0.047;78.7% vs 21.3%,P<0.01);COPD patients with lung cancer group, the highest proportion of lung squamous cell carcinoma (43.9%), men with lung squamous cell carcinoma was common (48.2%), women with lung adenocarcinoma was more common (53.8%).ConclusionWhen patients with a history of COPD had hemoptysis or sputum bloody, chest pain, atelectasis, hoarseness, pleural effusion, weight loss of clinical manifestations and signs, the possibility of lung cancer should be alerted. COPD combined with lung cancer occurs in a large number of male patients with smoking, airway obstruction in patients with COPD prone to lung cancer, lung squamous cell carcinoma is the most common pathological type.
pulmonary disease,obstructive;lung neoplasms;signs and symptoms
刘瑞娟, Email: mqb_6@163.com
R734.2
A
1004-583X(2017)12-1065-04
10.3969/j.issn.1004-583X.2017.12.012
2017-09-05 编辑:武峪峰
