VerifyNow和Multiplate两种血小板功能检测方法对急性冠脉综合征患者的预测价值
2017-12-18胡智玲王晓微
胡智玲, 李 芳,李 香,王晓微,杨 爽
(1.唐山南堡开发区医院 检验科,河北 唐山 063305;2. 河北省人民医院 老年病二科,河北 石家庄 050051;3. 河北医科大学,河北 石家庄 050017)
·论著·
VerifyNow和Multiplate两种血小板功能检测方法对急性冠脉综合征患者的预测价值
胡智玲1, 李 芳2,李 香2,王晓微3,杨 爽2
(1.唐山南堡开发区医院 检验科,河北 唐山 063305;2. 河北省人民医院 老年病二科,河北 石家庄 050051;3. 河北医科大学,河北 石家庄 050017)
目的探讨两种快速床旁检测血小板功能的方法Multiplate和VerifyNow技术对急性冠脉综合征(ACS)患者不良心血管事件的预测价值。方法分别应用VerifyNow和Multiplate技术检测ACS患者的血小板反应性,探讨血小板反应性与主要不良心血管事件(MACE,由全因死亡、非致死性心肌梗死、非致死性卒中、支架内血栓形成和血运重建组成的复合终点)之间的关系。结果对120例ACS患者随访1年后,MACE 18例(15%)。两种方法检测的血小板反应性均与MACE相关。Logistic回归分析发现,只有VerifyNow可以预测MACE 的发生(P=0.01)。VerifyNow检测显示为血小板高反应(HPR)的患者MACE发生率为16%,没有HPR的患者MACE发生率为7%(OR=2.6,95%CI=1.5~4.4,P=0.001)。Multiplate检测显示为HPR的患者MACE发生率为13%,没有HPR的MACE发生率为9%(OR=1.5,95%CI=0.9~2.5,P=0.11)。结论VerifyNow技术检测血小板功能比Multiplate技术可以更好地预测ACS患者的不良预后。
急性冠状动脉综合征;血小板
目前,阿司匹林联合氯吡格雷是冠心病介入治疗(PCI)围术期和急性冠状动脉综合征(ACS)患者的标准抗血小板治疗方案。研究发现,在同样的治疗方案基础上,血小板抑制水平存在相当大的可变性[1-2]。部分ACS患者PCI术后接受标准的抗血小板药物治疗后,血小板的活性不能得到充分地抑制,导致临床缺血事件的发生,称之为血小板高反应(HPR)。接受氯吡格雷治疗的HPR患者有增加死亡、心肌梗死和支架血栓形成的风险[3]。现有研究显示,应用替卡格雷或普拉格雷治疗有助于降低氯吡格雷抵抗患者的不良心血管事件风险[4-5]。
目前临床应用的血小板反应性检测技术有很多种[6-7],其中VerifyNow技术与Multiplate技术应用较为广泛[8-9]。但关于这些检测方法在ACS患者中的临床价值,迄今尚缺乏直接比较。本研究旨在比较两种不同的检测方法,探讨哪种检测方法可以更好地预测接受氯吡格雷治疗的ACS患者的预后。
1 资料与方法
1.1病例选择 2014年6月至2016年1月在河北省人民医院住院治疗的ACS患者,均接受阿司匹林(≥75 mg)和氯吡格雷(≥75 mg)治疗。排除标准:血小板计数<100×109/L,24小时内接受溶栓药物治疗,7天内曾使用糖蛋白Ⅱb/Ⅲa受体拮抗剂,或2周内曾口服阿司匹林或氯吡格雷以外的其他抗血小板药物。本研究经我院医学伦理委员会批准同意,所有患者均签署书面知情同意书。
1.2方法 应用VerifyNow P2Y12分析仪(Accumetrics,美国)和Multiplate分析仪(Roche,瑞士)检测血小板反应性。VerifyNow P2Y12检测仪检测结果以P2Y12反应单位PRU表示[10]。Multiplate分析仪检测结果以聚合单位×分钟(AU)表示[11]。治疗HPR的阈值分别为VerifyNow>208 PRU、Multiplate>46 AU[12]。为避免肾功能下降对检测结果的影响,本研究除外了肾小球滤过率(GFR)<45 ml/(min·1.73 m2)的患者。
1.3统计学方法 应用SPSS 21.0软件进行数据处理。符合正态分布的连续变量之间的比较采用t检验,不符合正态分布者应用Mann-WhitneyU检验。分类变量采用卡方检验。主要不良心血管事件(MACE)和血小板反应性之间的关系用工作特征曲线(ROC)和Logistic线性回归检测。P<0.05为差异有统计学意义。
2 结 果
2.1基线特征 在所纳入的136例疑诊ACS患者中,经过冠状动脉造影证实该诊断的有120例,其基线特征见表1。
120例ACS患者中NSTEMI占78.3%,STEMI占19.2%,其余患者为不稳定性心绞痛。男性占70.0%,平均年龄为(65±10)岁。合并高血压与血脂异常者分别占63.3%与66.7%,22.5%合并糖尿病,23.3%目前吸烟。接受冠状动脉介入治疗者73例(60.8%),接受冠状动脉旁路移植术者16例(13.3%),仅应用药物治疗者31例(25.8%)。
2.2MACE 在为期2年的随访期间,18例患者(15.0%)发生MACE,其中6例死亡,5例心肌梗死,3例支架内血栓形成,2例卒中,2例非计划血运重建。应用Multiplate法和VerifyNow法检测均显示,血小板反应性增高者更易发生MACE。
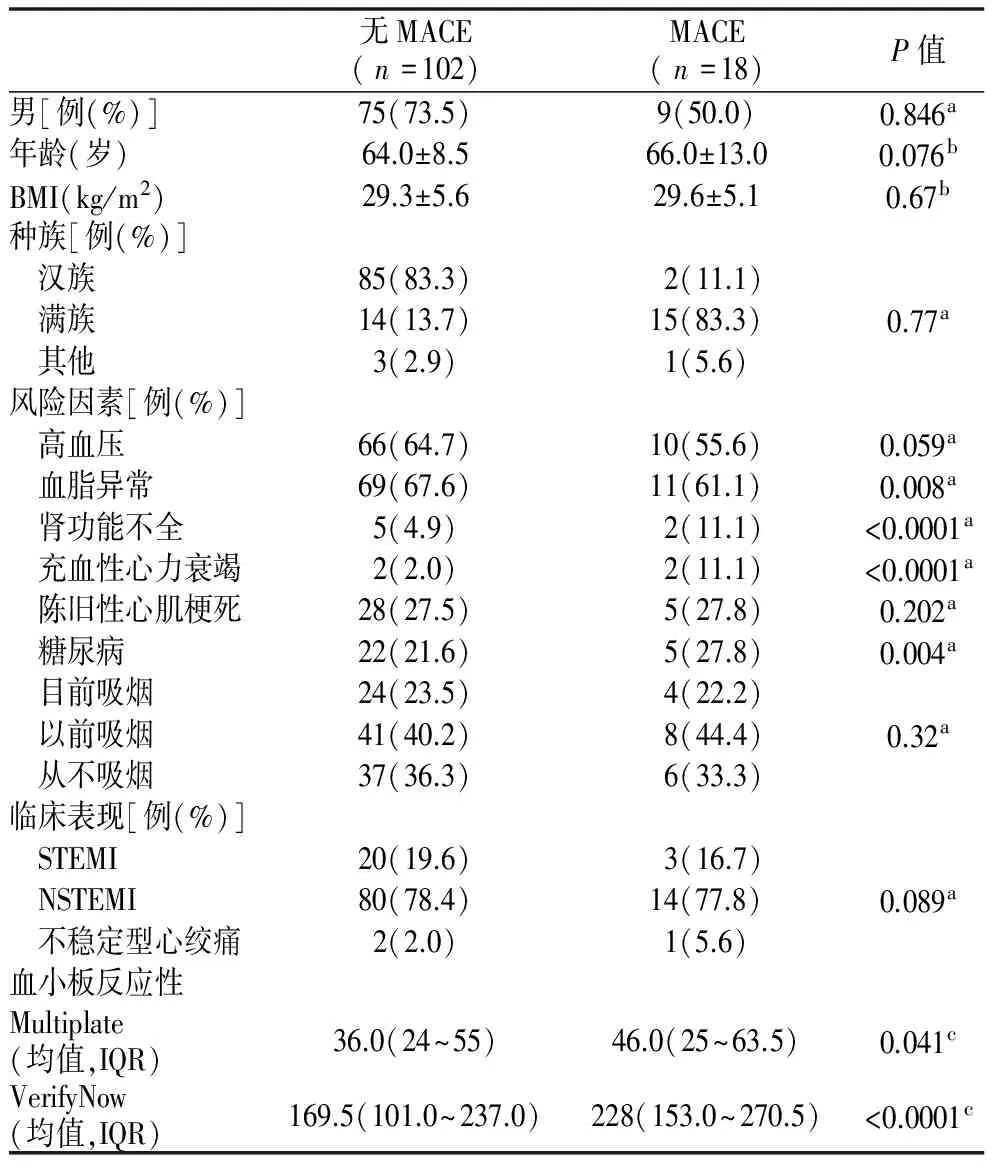
表1 MACE与无MACE患者的人口统计学和临床变量
注:a. 卡方检验,分类数据;b.t检验,连续数据;c.Mann WhitneyU检验,连续数据。ST抬高型心肌梗死(STEMI);非ST抬高型心肌梗死(NSTEMI)
2.3血小板反应性与MACE的关系 VerifyNow法检测的血小板反应性与是否发生MACE的ROC曲线下面积0.935(P=0.001),Multiplate法检测的血小板反应性与是否发生MACE的ROC曲线下面积0.812(P=0.004)。Logistic回归分析显示,VerifyNow法检测结果可以预测发生MACE的风险(P=0.01),而 Multiplate法检测结果对MACE的风险无预测价值(P=0.09)。见图1。
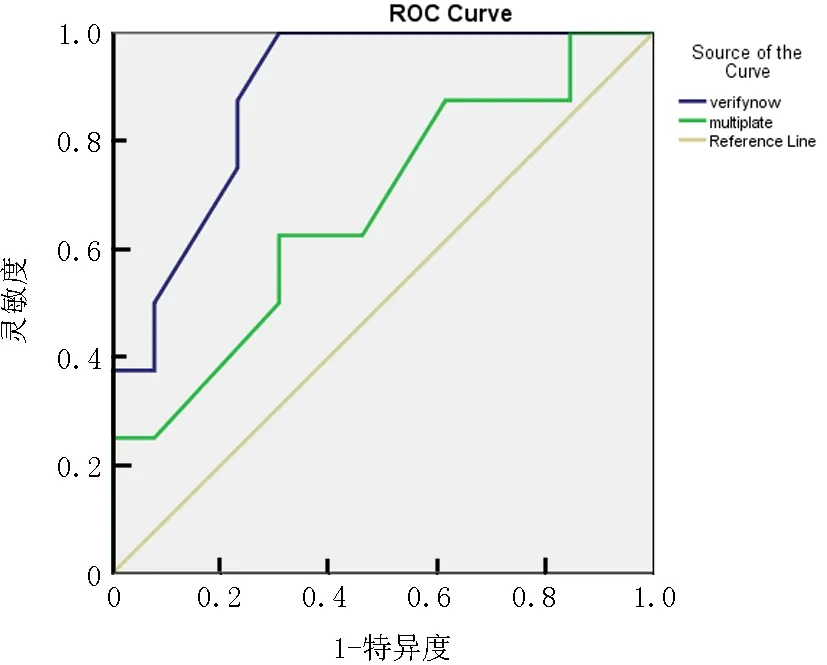
图1Multiplate和Verifynow法检测血小板反应性与是否发生MACE的ROC曲线
注:整体MACE事件概率是10.5%,VerifyNow法的ROC曲线下面积是0.935,Multiplate法ROC曲线下面积是0.812
2.4HPR与MACE 用VerifyNow法检测,有HPR患者MACE的发生率为16%,没有HPR的MACE的发生率为7%(OR=2.6,95%CI=1.5~4.4,P=0.001)。用Multiplate法检测,有HPR的患者MACE的发生率为13%,没有HPR的MACE的发生率为9%(OR=1.5,95%CI=0.9~2.5,P=0.11)(图2)。
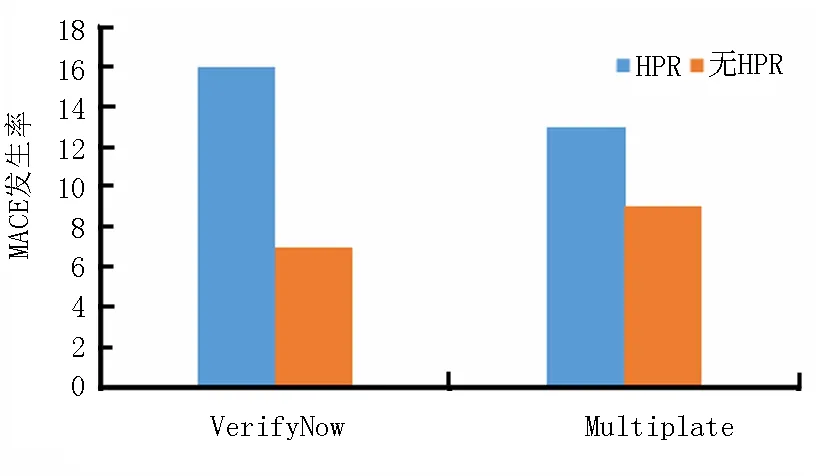
图2 HPR与MACE
3 讨 论
本研究结果显示,VerifyNow法提示为HPR的患者发生MACE事件的风险显著增高,而Multiplate法则不能预测MACE事件风险。同样,用VerifyNow法测得的血小板反应性与MACE之间的关系强于Multiplate法。多变量模型分析结果表明,只有VerifyNow方法检测结果与MACE统计学相关,提示与Multiplate法检测的血小板反应性相比,用VerifyNow法测得的血小板反应性是ACS患者MACE更好的临床预后指标。
不同的血小板功能检测技术以血小板生物学的不同角度为切入点,因此在方法学上有很大不同。VerifyNow检测法是基于在枸橼酸钠抗凝全血中血小板凝集比浊度的检测,活化的血小板聚集并黏附在检测孔中的原涂层珠子的表面。当发生血小板聚集时,系统可转换光透过率并计算出血小板反应性[16-18]。Multiplate方法是在水蛭素抗凝全血中利用多电极阻抗法,由于每个传感器单元分别检测到由于血小板聚集而引起的阻抗增加,并转化为随时间变化的任意聚合单元。每种方法均使用公认的阈值水平来定义HPR。本研究结果显示,两种方法所确定的HPR患者有显著的不一致性,其中38例患者(32%)因检测方法不同而归为不同的类别,这两种方法在HPR检测方面只是中等程度的相关性(Rho=0.43,P=0.0001)。本研究发现,基于VerifyNow法检测的有HPR患者与MACE显著相关,而Multiplate法则没有这种相关性。然而,两种检测方法测得的血小板反应性在MACE患者中均高于无MACE的患者,且ROC曲线分析表明血小板反应性与MACE呈正相关。
有许多研究表明,对于氯吡格雷抵抗的患者,换用替卡格雷或普拉格雷治疗可以显著改善疗效[19]。注册研究表明,应用血小板功能检测结果指导抗血小板药物选择有助于进一步降低缺血事件发生率[20-22]。然而,大型随机化临床试验却未能证实这一发现[23-25]。在使用普拉格雷和替卡格雷的真实世界研究发现,出血和呼吸困难可能是影响氯吡格雷广泛应用的常见原因[26-28]。以血小板功能测试为基础的个体化治疗方案有可能降低出血性并发症的风险,并可降低治疗成本[29-30]。
综上所述,应用VerifyNow法检测血小板反应性与MACE的关系更密切,经VerifyNow法确定的HPR患者发生MACE风险增加,而Multiplate法确定的HPR患者中MACE事件发生风险并无显著增高。此外,VerifyNow检测技术具有全自动检测的优势,是一种更为简便易行的快速床旁检测方法。
[1] Johnston LR, Larsen PD, La Flamme AC, et al. Suboptimal response to clopidogrel and the effect of prasugrel in acute coronary syndromes[J]. Int J Cardiol, 2013, 167(3): 995-999.
[2] Nagashima Z, Tsukahara K, Morita S, et al. Platelet reactivity in the early and late phases of acute coronary syndromes according to cytochrome P450 2C19 phenotypes[J]. J Cardiol, 2013, 62(3): 158-164.
[3] El Ghannudi S, Ohlmann P, Meyer N, et al. Impact of P2Y12 inhibition by clopidogrel on cardiovascular mortality in unselected patientstreated by percutaneous coronary angioplasty: a prospective registry [J]. JACC Cardiovasc Interv, 2010, 3(6): 648-656.
[4] Bonello L, Laine M, Baumstarck K, et al. A randomized trial of platelet reactivity monitoring-adjusted clopidogrel therapy versus prasugrel therapy to reduce high on-treatment platelet reactivity[J]. Int J Cardiol, 2013, 168(4): 4244-4248.
[5] Aradi D, Komcsi A, Price MJ, et al. Efficacy and safety of intensified antiplatelet therapy on the basis of platelet reactivity testing in patients after percutaneous coronary intervention: systematic review and meta-analysis[J]. Int J Cardiol, 2013, 167(5): 2140-2148.
[6] Aradi D, Sibbing D, Bonello L. Current evidence for monitoring platelet reactivity in acute coronary syndrome: a plea for individualized antiplatelet treatment[J]. Int J Cardiol, 2013, 167(5): 1794-1797.
[7] Freynhofer MK, Brozovic I, Bruno V, et al. Multiple electrode aggregometry and vasodilator stimulated phosphoprotein-phosphorylation assay in clinical routine for prediction of postprocedural major adverse cardiovascular events[J]. Thromb Haemost, 2011, 106(2): 230-239.
[8] Aradi D, Collet J P, Mair J, et al. Platelet function testing in acute cardiac care-is there a role for prediction or prevention of stent thrombosis and bleeding[J]. Thromb Haemost, 2015, 113(2): 221-230.
[9] Gozal YM, Carroll CP, Krueger BM, et al. Point-of-care testing in the acute management of traumatic brain injury: Identifying the coagulopathic patient[J]. Surg Neurol Int, 2017, 8:48.
[10] 任军伟, 陈建魁, 丛玉隆, 等. VerifyNow 抗血小板治疗监测系统检测氯吡格雷抗血小板聚集的应用价值[J]. 中华检验医学杂志, 2013, 36(5): 449-451.
[11] Johnston LR, Larsen PD, La Flamme AC, et al. Methodological considerations for the assessment of ADP induced platelet aggregation using the Multiplate® analyser [J]. Platelets, 2013, 24(4): 303-307.
[12] Tantry US, Bonello L, Aradi D, et al. Consensus and update on the definition of on-treatment platelet reactivity to adenosine diphosphate associated with ischemia and bleeding[J]. J Am Coll Cardiol, 2013, 62(24): 2261-2273.
[13] Guo LZ, Kim MH, Kim TH, et al. Comparison of three tests to distinguish platelet reactivity in patients with renal impairment during dual antiplatelet therapy[J]. Nephron, 2016, 132(3): 191-197.
[14] Guo LZ, Kim MH, Shim CH, et al. Impact of renal impairment on platelet reactivity and clinical outcomes during chronic dual antiplatelet therapy following coronary stenting[J]. Eur Heart J Cardiovasc Pharmacother, 2015, 2(3): 145-151.
[15] Guo LZ, Kim MH, Shim CH, et al. Impact of renal impairment on platelet reactivity and clinical outcomes during chronic dual antiplatelet therapy following coronary stenting[J]. Eur Heart J Cardiovasc Pharmacother, 2015, 2(3): 145-151.
[16] 刘畅, 马依彤, 于子翔, 等. VerifyNow P2Y12 血小板反应性检测对评估冠状动脉血运重建患者的临床疗效的 meta 分析[J]. 心脏杂志, 2015,27 (5): 577-581.
[17] Wu X, Liu G, Lu J, et al. Administration of ticagrelor and double-dose clopidogrel based on platelet reactivity determined by VerifyNow-P2Y12 for Chinese subjects after elective PCI[J]. Int Heart J, 2017, 58(2): 167-173.
[18] Danielak D, Komosa A, Tomczak A, et al. Determinants of high on-treatment platelet reactivity and agreement between VerifyNow and Multiplate assays[J]. Scand J Clin Lab Invest, 2017, 77(3): 190-198.
[19] Christ G, Siller-Matula JM, Francesconi M, et al. Individualising dual antiplatelet therapy after percutaneous coronary intervention: the IDEAL-PCI registry[J]. BMJ Open, 2014, 4(10): e005781.
[20] Mayer K, Schulz S, Bernlochner I, et al. A comparative cohort study on personalised antiplatelet therapy in PCI-treated patients with high on-clopidogrel platelet reactivity. Results of the ISAR-HPR registry[J]. Thromb Haemost, 2014, 112(2): 342-351.
[21] Aradi D, Tornyos A, Pintér T, et al. Optimizing P2Y 12 receptor inhibition in patients with acute coronary syndrome on the basis of platelet function testing: impact of prasugrel and high-dose clopidogrel[J]. J Am Coll Cardiol, 2014, 63(11): 1061-1070.
[22] Aradi D, Kirtane A, Bonello L, et al. Bleeding and stent thrombosis on P2Y12-inhibitors: collaborative analysis on the role of platelet reactivity for risk stratification after percutaneous coronary intervention[J]. Eur Heart J, 2015, 36(27): 1762-1771.
[23] Price MJ, Berger PB, Teirstein PS, et al. Standard-vs high-dose clopidogrel based on platelet function testing after percutaneous coronary intervention: the GRAVITAS randomized trial[J]. JAMA, 2011, 305(11): 1097-1105.
[24] Trenk D, Stone G W, Gawaz M, et al. A randomized trial of prasugrel versus clopidogrel in patients with high platelet reactivity on clopidogrel after elective percutaneous coronary intervention with implantation of drug-eluting stents: results of the TRIGGER-PCI (Testing Platelet Reactivity In Patients Undergoing Elective Stent Placement on Clopidogrel to Guide Alternative Therapy With Prasugrel) study[J]. J Am Coll Cardiol, 2012, 59(24): 2159-2164.
[25] Collet JP, Cuisset T, Rangé G, et al. Bedside monitoring to adjust antiplatelet therapy for coronary stenting[J]. N Engl J Med, 2012, 367(22): 2100-2109.
[26] Alexopoulos D, Xanthopoulou I, Deftereos S, et al. Contemporary antiplatelet treatment in acute coronary syndrome patients undergoing percutaneous coronary intervention: 1‐year outcomes from the GReek AntiPlatElet (GRAPE) Registry[J]. J Thromb Haemost, 2016, 14(6): 1146-1154.
[27] Biscaglia S, Campo G, Pavasini R, et al. Occurrence, causes, and outcome after switching from ticagrelor to clopidogrel in a real-life scenario: data from a prospective registry[J]. Platelets, 2016, 27(5): 484-487.
[28] Harding SA, Van Gaal WJ, Schrale R, et al. Practical experience with ticagrelor: an Australian and New Zealand perspective[J]. Curr Med Res Opin, 2015, 31(8): 1469-1477.
[29] Straub N, Beivers A, Lenk E, et al. A model-based analysis of the clinical and economic impact of personalising P2Y12-receptor inhibition with platelet function testing in acute coronary syndrome patients[J]. Thromb Haemost, 2014, 111(2): 290-299.
[30] Panattoni L, Brown PM, Te Ao B, et al. The cost effectiveness of genetic testing for CYP2C19 variants to guide thienopyridine treatment in patients with acute coronary syndromes[J]. Pharmacoeconomics, 2012, 30(11): 1067-1084.
PredictivevalueoftwomethodsofplateletfunctiondetectionforVerifyNowandMultiplateinpatientswithacutecoronarysyndrome
Hu Zhiling1, Li Fang2, Li Xiang2, Wang Xiaowei3, Yang Shuang2
1.DepartmentofClinicalLaboratory,HospitalofTangshanNanpuDevelopmentZone,Tangshan0633305,China; 2.SecondDepartmentofGeriatrics,HebeiProvincialPeople'sHospital,Shijiazhuang050051,China; 3.HebeiMedicalUniversity,Shijiazhuang050017,China
ObjectiveTo investigate the predictive value of two methods of platelet function detection for VerifyNow and Multiplate in patients with acute coronary syndrome (ACS).MethodsVerify Now and Multiplate were used to detect the platelet reactivity of patients with ACS. The relationship between platelet reactivity and major adverse cardiovascular events (MACE) was explored, including all-cause death, non fatal myocardial infarction, non fatal stroke, stent thrombosis and revascularization.ResultsAfter one year of follow-up for 120 patients with ACS, 18 patients (15%) had MACE. The platelet reactivity detected by the two methods was both associated with MACE. Logistic regression analysis found that only VerifyNow could predict the occurrence of MACE (P=0.01). VerifyNow detection showed that the incidence of MACE in patients with high platelet response (HPR) was 16%, and the incidence of MACE without HPR was 7% (OR=2.6, 95%CI=1.5-4.4,P=0.001). The incidence of MACE in patients with HPR was 13%, and the incidence of MACE without HPR was 9% (OR=1.5, 95%CI=0.9-2.5,P=0.11) without HPR.ConclusionThis study demonstrated VerifyNow could predict the adverse outcomes better in patients with ACS than Multiplate.
acute coronary syndrome; blood platelets
杨爽,Email: yangshuang@medmail.com.cn
R542.2
A
1004-583X(2017)12-1049-04
10.3969/j.issn.1004-583X.2017.12.008
Correspondingauthor:YangShuang,Email:yangshuang@medmail.com.cn
2017-03-15 编辑:张卫国
