FAM213B基因启动子在猪子宫内膜细胞的转录调控
2017-12-18张爱玲孙显月卢孝璋吴琦李加琪张豪
张爱玲,孙显月,卢孝璋,吴琦,李加琪,张豪
FAM213B基因启动子在猪子宫内膜细胞的转录调控
张爱玲1, 2,孙显月2,卢孝璋2,吴琦2,李加琪2,张豪2
(1广东高校应用生态工程技术开发中心/广东第二师范学院生物与食品工程学院广州 510310;2华南农业大学动物科学学院/广东省农业 动物基因组学与分子育种重点实验室,广州510642)
分析猪FAM213B基因启动子转录活性区域,并检测转录因子NFκB对启动子活性及猪FAM213B基因表达影响,为深入了解FAM213B基因的转录调控机制影响前列腺素合成、母猪妊娠等繁殖活动奠定基础。采集卵泡期子宫,分离子宫内膜上皮组织,经胶原酶方法获得猪原代子宫内膜细胞,用于猪FAM213B基因启动子活性检测。参照笔者所在课题组前期研究获得的猪FAM213B基因mRNA全序列(GenBank登录号:KX444503)以及5¢调控区序列(GenBank登录号:100134955),通过PCR扩增猪FAM213B基因较长启动子序列,并进行测序鉴定;在此基础上,PCR扩增带有I和I限制性酶切位点的FAM213B基因启动子7个5'端缺失片段,并通过双荧光素酶报告基因载体系统构建猪FAM213B基因启动子7个不同的5'端缺失载体。将7个载体经无内毒素处理后与pRL-TK质粒用阳离子脂质体法一起转染猪子宫内膜细胞,用双荧光素酶报告基因系统进行Luciferase活性检测,比较各启动子片段转录活性。生物信息学分析FAM213B基因启动子潜在转录因子结合位点,通过ChIP试验验证FAM213B基因启动子与潜在转录因子NFκB的相互作用。构建NFκB1和RelA的超表达载体,化学合成NFκB1和RelA的干扰siRNA片段,分别转染猪子宫内膜细胞,通过双荧光素酶报告基因系统进行Luciferase活性检测和荧光定量PCR分别检测超表达和干扰表达NFκB1和RelA对猪FAM213B基因启动子活性和mRNA表达影响。PCR和测序获得猪FAM213B基因启动子长度为 2 261 bp(-2178/+83)。生物信息学预测结果表明猪FAM213B基因启动子区存在潜在的CREB、CCAAT增强子结合蛋白、E-box因子的结合位点,炎性因子NFκB潜在结合位点分别位于-1143/-1132和-664/-655区间。启动子报告基因活性检测结果表明:重组载体P2(-1352/+30)荧光活性最高,极显著高于P1(-1 760/+30)(<0.01),在-1 760/-1 352区域存在负调控元件;而P2显著高于P3(-919/+30)(<0.05),表明在-1 352/- 919区域存在正调控元件;P3(-919/+30)活性极显著高于P4(-604/+80)(<0.01),表明在-919/-604区域存在正调控元件;P4、P5、P6和P7活性差异不显著,-1352/-919区域为核心启动子区,-1352/-604对于维持该启动子较高转录活性起着重要的作用。ChIP结果表明启动子区-1143/-1132存在NFκB1结合位点,-664/-655存在RelA结合位点。超表达载体pcDNA3.1-NFκB1与P2(-1352/+30)启动子片段重组载体共转染猪子宫内膜细胞后,P2启动子活性极显著高于对照组(<0.01),pcDNA3.1-NFκB1载体单独转染猪子宫内膜细胞后FAM213B基因mRNA表达量显著高于对照组(<0.05);超表达载体pcDNA3.1-RelA与P3(-919/+30)启动子片段重组体共转染猪子宫内膜细胞,P3启动子活性极显著低于对照组(<0.05),pcDNA3.1-RelA载体单独转染猪子宫内膜细胞后,FAM213B基因的mRNA表达量显著低于对照组。转染NFκB1和RelA的siRNA片段干扰片段,FAM213B基因启动子活性和mRNA表达量则表现与超表达相反的结果。获得了猪FAM213B基因启动子核心启动子序列为-1352/-919区域,NFκB是FAM213B基因启动子的转录因子,NFκB成员NFκB1和RelA在猪子宫内膜细胞中对FAM213B基因的表达起调控作用。
猪;FAM213B基因;启动子;NFκB;子宫内膜细胞
0 引言
【研究意义】FAM213B (family with sequence similarity 213, member B,又称为前列腺酰胺合成酶 (prostamide F synthas,PGFS),属于硫氧还蛋白超家族(the thioredoxin-like superfamily)成员[1],能够催化前列腺素PG生成过程中间产物PGH2向花生四烯酸酯或者前列腺素E2(prostaglandin E2,PGE2)的转变;FAM213B也能够直接催化PGH2生成PGF2a[2],因此FAM213B具有双重的催化作用。PGF2α是一种溶解黄体因子[3],而PGE2则能够抑制黄体溶解[4-5],PGE2/PGF2α须受到严格控制,恰当的比例维持着母猪的发情周期和妊娠[6-7]。FAM213B基因表达调控必须受到较精确的调控,才能发挥其生理功能。转录水平是基因表达调控的重要方式,启动子决定了基因表达的时空特异性以及表达量的高低。因此,对猪FAM213B基因启动子进行转录活性研究,并确定其特异转录因子,对于揭示其调控PG合成以及在母猪妊娠、发情等繁殖活动的生理功能具有重要的意义。【前人研究进展】哺乳动物前列腺素PG的合成离不开前列腺酰胺合成酶PGFS。PGFS有三种同工酶,PGFS I、PGFS II属于醛酮还原酶(aldo-keto reductase,AKR)超家族,FAM213B则属于硫氧还蛋白样超家族(Thioredoxin-like,Trx-like superfamily)成员[1]。作为一种氧化还原酶,FAM213B在NADPH作为质子供体情况下,能直接将PGH2作为底物一步合成PGF2α,并且FAM213B合成PGF2α效果优于其他PGFS酶,这种现象较早在小鼠和猪大脑及脊髓中发现,并推测在中枢神经系统起着重要的作用[8]。在PG生成过程中,PGH2、PGE2与PGF2a均是重要的中间产物。在FAM213B的作用下,前列腺素H2(prostaglandin H2,PGH2)可以生成PGE2,也可以由PGH2直接生成PGF2a[2]。虽然PGH2生成PGE2也受到了其他相关酶类催化,如PTGES[9]、PTGS2[10-11]等,但是FAM213B的调控作用研究并不多见。PG成员众多,不同的成员具有不同的生物学功能,在动物繁殖过程中起主要调节作用是PGE2和PGF2α[6]。令人感兴趣的现象是PGE2和PGF2α具有相反的生理功能,如PGF2α是一种溶解黄体因子[3],而PGE2则能够抑制黄体溶解[4-5]。所以,为了避免PGF2α在妊娠建立时对卵巢黄体的溶黄作用,子宫PGF2α的分泌由内分泌转为外分泌,即由分泌至子宫静脉改为直接分泌至子宫腔中[12]。此外,孕体和子宫内膜在附植前能合成大量的PGE2,早期妊娠中子宫分泌的PGE2多于PGF2α[13]。由于PGF2α由PGE2转化而来,在母猪妊娠阶段,具有黄体保护作用的PGE2和溶黄作用的PGF2α维持适当的对妊娠的建立和维持具有重要的作用[14],如较高比例的PGE2:PGF2α有利于母猪妊娠的建立和维持、保持高产仔数等[15]。可以看出,在母猪妊阶段,PGE2、PGF2α的生成量、生成位置受到了严格调控。那么,作为催化PGE2生成PGF2α的酶,以及作为催化PGH2直接生成PGF2α的酶,FAM213B的催化作用在这个过程中起着非常重要的作用,FAM213B也可能受到严谨控制进而控制PGE2/PGF2α的比例,但是目前关于猪FAM213B相关研究还较鲜见。【本研究切入点】可以看出,由于PGE2/PGF2α的比例、生成部位在母猪妊娠阶段均会发生变化,那么是不是FAM213B的时空表达也与此一致。鉴于此,对猪FAM213B基因启动子进行转录活性和结合转录因子的研究,有望揭示FAM213B基因的表达规律,也为深入揭示PG生成的复杂的催化机制提供依据。前期课题组通过高通量测序技术对长大二元杂交母猪和二花脸猪怀孕12 d的子宫内膜转录组进行分析比较,发现FAM213B基因在两者子宫内膜存在表达差异[16],可能是母猪产仔数相关候选基因。并且前期已经通过RACE技术获得猪FAM213B基因mRNA和启动子序列[17],因此在此基础上将开展本研究工作。【拟解决的关键问题】分析猪FAM213B基因启动子在猪子宫内膜中的转录活性及其核心转录区,并确定其特异的结合转录因子及结合位点。
1 材料与方法
试验工作于2013年6月至2015年6月在广东省农业动物基因组学与分子育种重点实验室完成。
1.1 材料
用于提取DNA的耳组织以及转染用猪子宫内膜细胞,来源于长大杂交母猪(LL),样品采自广东阳江某猪场。用于进行ChIP的子宫内膜细胞来源于怀孕12d 母猪子宫内膜。
大肠杆菌DH5α感受态细胞和pMD -20T Vector(含T4 DNA连接酶)购自TaKaRa公司,pGL-3 Basic Vector、pRL-TK Vector以及限制性内切酶购自Promega公司。DL2000分子量标准、DNA凝胶回收试剂盒、DNA聚合酶、dNTPs等购自广东东盛生物技术公司。无内毒素质粒小提试剂盒购自OMEGA公司。
1.2 方法
1.2.1 猪子宫内膜细胞的培养 采集卵泡期子宫,低温状态下迅速带回实验室。剪取子宫内膜上皮组织于含有双抗的PBS中,漂洗数次。用眼科剪将子宫内膜上皮组织剪成1 mm3大小,加入2倍体积的0.1%胶原酶I,37℃水浴摇床消化,每隔半小时混摇一次。2.5 h后加入等体积的的终止液(含10% FBS的DMEM/F12)。把消化液和终止液的混合液用150 μm(100目)细胞筛过滤,吸取滤液至离心管中,500 r/min离心5 min,然后再经过1 000 r/min离心5 min和PBS重悬,计数沉淀细胞,以2×105个细胞/mL接种于细胞培养瓶中,于37℃、5% CO2培养箱中静置培养。
在接种后24 h左右原代细胞贴壁,经过3—5 d达到90%融合。此时,吸出培养液,用PBS漂洗2次后,加入0.25%胰蛋白酶消化3—5 min。待大部分细胞变圆时,加入等体积终止液,轻轻吹打数次。将细胞悬液转移至离心管中,1 000 r/min离心5 min后弃上清,再加入5 mL PBS重悬细胞,1 000 r/min离心5 min后弃上清,接种于新的培养瓶继续培养,备用。
1.2.2 猪FAM213B基因启动子5¢缺失片段报告基因重组载体的构建与双荧光素酶活性检测 基因组DNA提取采用常规的酚-氯仿抽提法。参照本课题组获得的猪FAM213B基因mRNA全序列(GenBank登录号:KX444503)以及5¢调控区序列(GenBank登录号:100134955),首先设计引物(表1引物:5′-FAM231B),引物由广州英骏公司合成,下同。扩增获得猪FAM213B基因启动子区2 261 bp(-2178/+83),将此构建至T载体,测序后,命名为T-FAM213B-P。设计7对引物(P1- P7),以T-FAM213B-P质粒为模板,用于扩增猪FAM213B基因不同的启动子片段,见表1。反应程序为:98℃预变性1 min;98℃变性30 s,57—62℃退火30 s,72℃延伸0.5—2.5 min(根据PCR产物的长度进行调整,1 kb·min-1),循环数为33;72℃后延伸10 min。
将上述PCR扩增获得DNA片段用DNA凝胶回收试剂盒进行回收纯化后,用I和I进行双酶切,同时对pGL-Basic载体进行酶切,酶切体系为:10×Buffer 10 μL,PCR产物或者载体50 μL,I和I各5 μL,ddH2O 30 μL,37℃反应3 h。然后将双酶切后的DNA片段和pGL-Basic载体分别回收纯化后,各DNA片段分别与pGL-Basic载体进行连接,连接反应体系成分为:1 μL Ligation Buffer,2 μL pGL3- basic 载体双酶切产物,6.8 μL各DNA片段,0.2 μL T4 DNA 连接酶,22℃保持4 h。将连接产物转化大肠杆菌DH5α,涂布氨苄青霉素琼脂平板,37℃过夜培养,挑取单克隆进行测序,阳性质粒依次命名为P1、P2、P3、P4、P5、P6和P7。用OMEGA无内毒素试剂盒提取构建好的各个载体,与pRL-TK质粒用阳离子脂质体法转染细胞,48 h后,用双荧光素酶报告基因系统进行Luciferase活性检测,比较各启动子片段转录活性。
反应体系为:10 μL SYBR /RoX qPCR Master Mix(2 x),上下游引物各0.6 μL(10 μmol·L-1),cDNA模板1 μL,补充灭菌双蒸水7.8—20 μL。
1.2.3 CHIP试验证实猪FAM213B基因启动子与转录因子NFκB相互作用 通过在线软件(MatIspector (Search for IF binding siets:http://www. genomatix.de/;http://www.cbrc.jp/research/db/TFSEARCH. html)对猪FAM213B基因启动子进行生物信息学分析,发现启动子区域存在2个潜在的核转录因子NFκB(nuclear transcription factor κB, NFκB)结合位点。在此基础上,通过ChIP试验验证FAM213B基因启动子与转录因子NFκB的相互作用,试验过程按染色质免疫共沉淀试剂盒(EZ-CHIP,MILLIPORE)说明书操作,用于扩增两个结合位点的引物见表1:CHIP-NFκB1和CHIP-RelA引物。
1.2.4 转录因子NFκB对猪FAM213B基因启动子的调控作用 根据NCBI公布的NFκB1(p50,前体为p105,Gene ID: 751869)和RelA(p65,Gene ID: 100135665)mRNA序列设计引物扩增带酶切位点的CDS片段,构建超表达载体,引物序列见表1:pcDNA-NFκB1和pcDNA-RelA。以子宫内膜组织mRNA为模板扩增NFκB1和RelA的CDS序列,经测序鉴定后连接至真核表达载体pcDNA3.1/mcy-His(-)B中,得到的载体分别命名为O-P-NFκB1和O-P-RelA。
根据GenBank上猪NFκB1(NM_001048232.1)和RelA(NM_001114281.1)基因已知序列,按siRNA序列设计原则,结合Ambion公司提供的网上在线设计工具进行设计,设计NFκB1和RelA的siRNA引物。将siRNA序列进行BLAST比对,以确定和其它基因没有同源性,由广州锐博公司合成,引物序列见表1:siRNA-N1、siRNA-N2、siRNA-N3和siRNA-R1、siRNA-R2、siRNA-R3。干扰片段的转染按Invitrogen公司的Lipofectamine™ LTX and PLUS™ Reagents试剂盒说明书进行操作,转染50 nmoL的siRNA片段。将siRNA转染猪子宫内膜细胞后48 h,PBS漂洗1次,抽提总RNA后进行qRT-PCR检测NFκB1和RelA的表达量(引物:q-NFκB1、q-RelA),验证siRNA的干扰效果,同时用qRT-PCR(SYBR Green Realtime PCR Mix)检测siRNA干扰两个转录因子后FAM213B基因表达情况(q-FAM213B)。本试验用于验证、NFκB表达量的荧光定量PCR的引物以及内参基因的引物见表1,所用模板是长大二元杂母猪子宫内膜组织的cDNA。反应体系为:10 μL SYBR /RoX qPCR Master Mix(2 x),上下游引物各0.6 μL(10 μmol·L-1),cDNA模板1 μL,补充灭菌双蒸水7.8 μL至20 μL。反应的条件为:预变性:94℃,5 min;变性:94℃,30 s,退火:60℃,30 s,延伸:72℃,30 s,循环数为40个;后延伸:72℃,40 s。在PCR反应的过程中,设置获得熔解曲线的程序。样品设置相同的阈值线,用CFX Manager软件输出扩增的Ct值,在Excel表格中,采用2-ΔΔCt法分析组织相对表达量,选择GADPH基因作为内标基因进行均一化处理,以长大二元杂母猪中作为参照因子分析超表达或干扰NFκB核转录因子后FAM213B基因的相对表达量,并且进行-test检验分析各组间是否存在显著差异。

表1 猪FAM213B基因启动子5¢缺失片段、ChIP、NFκB1和RelA超表达与干扰表达以及mRNA定量分析引物信息
下划线表示保护碱基,斜体表示限制性酶切位点,上游酶切位点I:,下游酶切位点I:;上游酶切位点I:下游酶切位点I:
Italic type: protective bases; Underline type:I (),I ()I()I ()
1.2.5 生物信息学常用网站 基因序列查询:GenBank:http://www.ncbi.nlm.nih.gov;Ensembl:http://asia.ensembl.org/index.html;转录因子结合位点分析:MatInspector (http://www.genomatix.de/);PCR引物设计的软件:primer5.0;核酸序列比对、拼接的软件:DNASTAR、Vector NTI.10。
2 结果
2.1 猪FAM213B基因启动子5'缺失片段报告基因重组载体的构建
将猪启动子区序列通过在线生物学软件进行分析,预测启动子区潜在的顺式作用元件和结合反式作用因子,发现FAM213B基因启动子区存在潜在的转录因子结合位点(图1-A),如cAMP应答元件结合蛋白(cAMP-response element binding protein, CREB)、CCAAT增强子结合蛋白(CCAAT/ enhancer binding protein, C/EBP)、E-box结合因子(E- box binding factors)、OCT-1(Octamer transcription factor-1)等因子的潜在结合位点。核因子κB (nuclear factor κB,NFκB)结合位点分别位于-1143/-1132和-664/-655区间,具体见图1-B。根据在线预测结果,扩增启动子7个5'端缺失片段(大小见表1,P1-P7引物扩增片段大小),并构建报告基因重组载体,扩增结果和重组载体的酶切鉴定结果见图1-C、D。
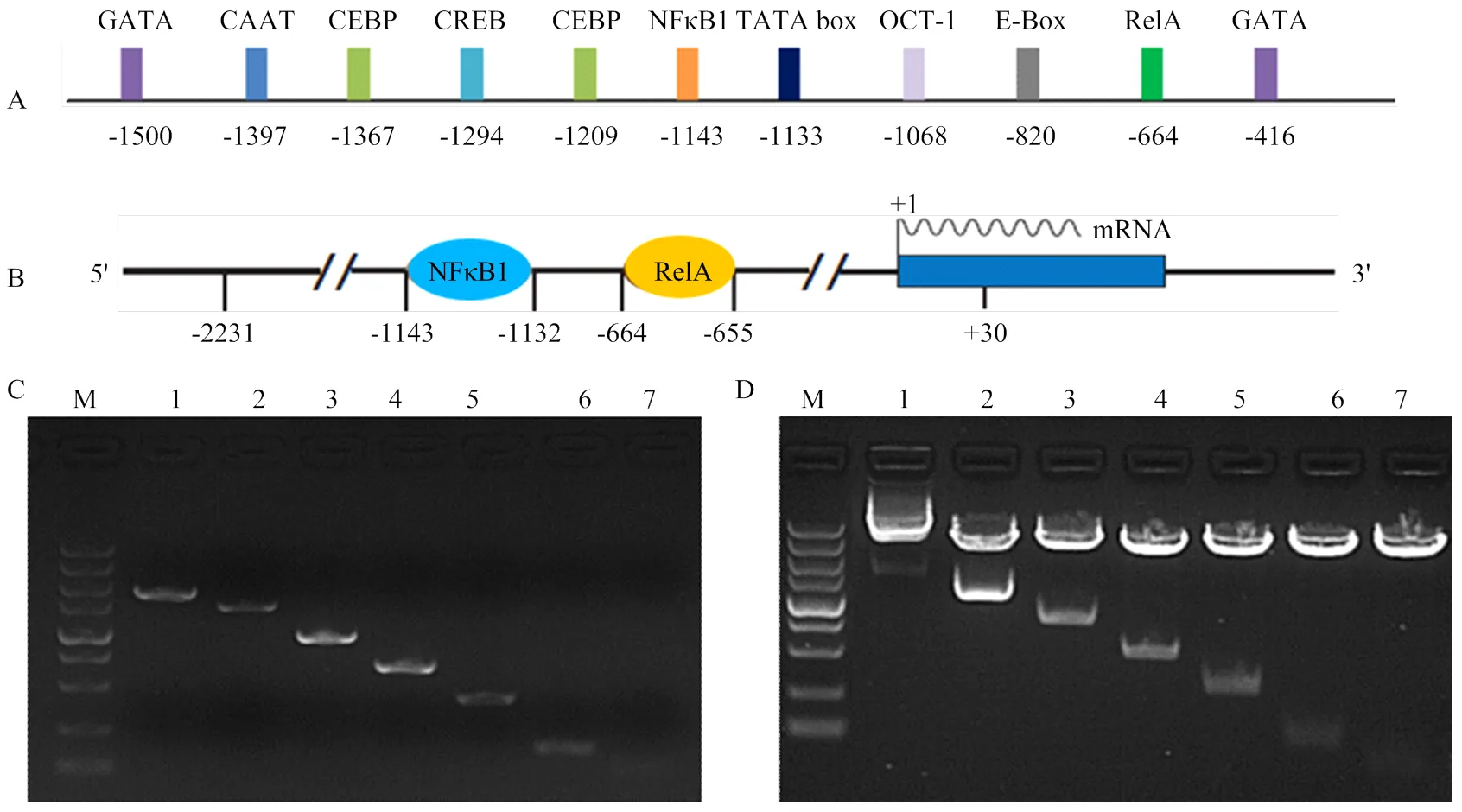
M:DNA分子量标准(DL5 000 Marker),从上到下依次为:5 000、3 000、2 000、1 500、1 000、750、500、250和100 bp. A:猪FAM213B 基因启动子区重要顺式作用元件及结合因子预测结果;B:猪FAM213B 基因启动子区NFκB1和RelA结合预测结果;C:猪FAM213B基因启动子各缺失片段扩增结果(1-7);D:猪FAM213B基因启动子各缺失片段重组载体双酶切鉴定结果(1-7)
2.2 猪FAM213B基因5'缺失片段转录活性分析
培养猪子宫内膜细胞,采用瞬时转染方法,将猪FAM213B基因启动子各缺失片重组载体分别转染细胞,同时共转染内参pGL-TK质粒,启动子报告基因活性检测结果见图2。结果表明:重组载体P2(-1352/+30)荧光活性最高,而且极显著高于P1(-1760/+30),推测在-1760/-1352区域存在负调控元件;而P2显著高于P3(-919/+30),推测在-1352/- 919区域存在正调控元件;P3(-919/+30)活性极显著高于P4(-604/ +80),推测在-919/-604区域存在正调控元件。P4、P5、P6和P7活性差异不显著,综合分析,-1350/-604对于维持该启动子较高转录活性起着重要的作用。
2.3 猪FAM213B基因启动子结合核转录因子NFκB的鉴定
生物信息学预测转录因子结合位点,发现在FAM213B基因启动子上存在2个潜在的NFκB结合位点,分别是-1143处的NFκB1因子结合位点以及-664处的RelA结合位点(图1-A)。
采用NFκB1和RelA的特异性抗体,通过免疫共沉淀的方式把怀孕12 d的母猪子宫内膜NFκB-DNA复合体沉淀下来,从而特异性地富集结合NFκB1和RelA因子的DNA片段。同时在潜在2个NFκB结合位点附近设计引物,以富集的DNA为模板进行扩增,其结果见图3。可以看到,富集NFκB1-DNA和RelA- DNA的片段分别被引物ChIP-NFκB1和ChIP-RelA扩增到了预期的DNA片段(120 bp和102 bp,图3中NFκB1和RelA5泳道);用IgG特异性抗体对DNA进行富集,然后用ChIP-NFκB1和ChIP-RelA引物扩增进行扩增,并没有获得DNA片段(图3中2个IgG泳道);扩增经RNA聚合酶II特异性抗体富集DNA,则获得了预期大小的DNA片段(图3中2个RNA-polymerase II泳道);同时用ChIP-NFκB1和ChIP-RelA扩增没有经过富集的DNA,也扩增到了预期大小DNA片段(图3中2个Input泳道)。该结果表明NFκB1和RelA可通过相应的DNA顺式作用元件与猪FAM213B基因启动子区结合,结合位置分别位于:-1143和-664附近。

图2 猪FAM213B基因不同启动子片段在猪子宫内膜细胞转录活性

M: DL2000,从上到下为:2000,1000,750,500,250,100 bp;IgG: 阴性对照;Input和RNA-polymerase II:阳性对照
2.4 NFκB对猪FAM213B基因表达的调控作用
2.4.1 超表达NFκB对猪FAM213B基因表达影响 采用共转染的方式,将NFκB1超表达载体pcDNA3.1- NFκB1与P2(-1352/+30)启动子片段重组体共转染猪子宫内膜细胞,以检测NFκB1对FAM213B基因启动子活性的影响,同时将pcDNA3.1-NFκB1单独转染猪子宫内膜细胞,转染48 h后加入Trizol裂解细胞用于RNA提取,反转录成cDNA后采用实时荧光定量PCR检测FAM213B基因的表达量。结果表明:共转染pcDNA3.1-NFκB1的启动子活性极显著高于对照组(<0.01),结果如图4-A所示,表明NFκB1可通过结合FAM213B基因启动子的相应位点,显著提高荧光素酶报告基因的活性。而且,转染pcDNA3.1-NFκB1载体后(浓度为100、200 ng),FAM213B基因mRNA表达量显著高于对照组(<0.05,图4-B)。
同样,将pcDNA3.1-RelA与P3(-919/+30)启动子片段重组体共转染猪子宫内膜细胞的活性检测结果见图4-C:共转染pcDNA3.1-RelA的启动子活性极显著低于对照组(<0.01),表明RelA可通过结合FAM213B基因启动子的NFκB相应位点,抑制其表达,从而显著降低荧光素酶报告基因的活性(图4-C)。单独将pcDNA3.1-RelA载体转染猪子宫内膜细胞后,FAM213基因mRNA表达水平如图4-D所示,当pcDNA3.1-RelA浓度为100和200 ng时,FAM213B基因的mRNA表达量显著低于对照组(<0.05),表明FAM213B基因的mRNA水平在RelA的作用下显著性降低。
2.4.2 干扰NFκB对猪FAM213B基因mRNA表达影响 采用siRNAs干扰子宫内膜细胞内源性的NFκB1和RelA,检测两者对启动子及表达的影响。各设计3条干扰NFκB1(表1:siRNA-N1,siRNA-N2和siRNA-N3)和RelA(表1:siRNA-R1,siRNA-R2和siRNA-R3)的siRNAs,转染浓度为50 nmol siRNA,利用qRT-PCR检测干扰NFκB1和RelA的效率发现,转染后的siRNA-N1相比于对照组在转录水平上显著降低内源性NFκB1的表达量;转染siRNA-R2相比于对照组在转录水平上显著降低内源性RelA的表达量(结果略)。siRNA-N1和siRNA-R2均能很好地干扰子宫内膜细胞内源性NFκB1和RelA的表达,可用于后续的干扰试验。
对子宫内膜细胞转染siRNA-N1和P2质粒,检测NFκB1被干扰后猪FAM213B基因启动子(P2,-1143/-1132)活性的变化;转染siRNA-R1和P3,检测RelA被干扰后猪FAM213B基因启动子(P3,-664/-655)活性的变化。结果见图5-A:干扰NFκB1后,启动子活性显著低于对照组(<0.05),表明干扰NFκB1后,FAM213B基因启动子P2显著降低荧光素酶报告基因活性;干扰RelA后,则启动子P3活性显著高于对照组(<0.05),表明干扰RelA后,FAM213B基因启动子P3可显著提高荧光素酶报告基因活性。因此,NFκB1对FAM213B基因启动子转录活性具有正调控作用,RelA则具有负调控作用。
将siRNA-N1和siRNA-R2分别转染猪子宫内膜细胞后,荧光定量PCR检测猪FAM213B基因的表达量,结果见图5-B:干扰NFκB1后,FAM213B基因的mRNA表达量显著低于对照组(<0.05),而干扰RelA后,FAM213B基因的mRNA表达量显著高于对照组(<0.05),因此,进一步验证NFκB1可促进FAM213B基因的转录,RelA可抑制FAM213B基因的转录。
3 讨论
PGE2/PGF2α的比例对于母猪的发情周期、妊娠建立和维持具有重要的作用[6-7],而FAM213B基因与PGE2/PGF2α的比例、生成有关,进而可能影响母猪的妊娠、胚胎发育等繁殖活动,因此揭示FAM213B基因表达规律对于深入阐释影响母猪繁殖性能分子机制具有积极的意义。本研究在前期获得FAM213B基因完整mRNA序列基础上,获得2 261 bp的启动子片段,初步检测其具有转录活性[18],而且预测获得启动子上具有潜在的典型转录因子结合位点。进而克隆其不同长度的启动子片段,并分析不同的片段转录活性,确定转录起始位点上游的-1352/-604区域对于维持FAM213B基因较高的启动子活性具有重要作用。在这个区域包括了预测的NFκB1和RelA因子的结合位点,分别是-1143和-664位点。P2启动子(-1352/+30)活性最高,而且显著高于P3(-919/+30),即在缺少了-1352/-919区域后,转录活性下降(图2),表明-1352/-919含有正向调控元件。通过ChIP已经证实NFκB1能够结合到启动子上相应的位置(图3),而且超表达NFκB1后,启动子P2活性、FAM213B的mRNA表达均表现增加(图4-A和B),干扰后两者均表现下降趋势,这充分说明了NFκB1与启动子上的顺式作用元件结合,起到了正向调控的作用。同理,P3启动子活性(-9191/+30)显著高于P4(-604/+30)(图2),表明缺少了-919/-604区域后启动子活性也表现下降,这个区域同样含有正向调控元件。RelA也能够结合该区域预测的位点(图3),但是超表达与干扰RelA后,则呈现与NFκB1相反的结果(图4-C和D),这样看似与-919/-604区域存在正向调控元件相矛盾。但是,可以看出,表现最高转录活性的P2同时包含了-1352/-919和-919/-604两个区域,因此可以推测,在猪子宫内膜细胞中,NFκB1与RelA可能并非同时发挥作用,或者NFκB1对启动子的正向调控作用削弱了RelA的负向调控作用。本课题组研究人员发现在猪的颗粒细胞中,NFκB1 (p50)的过表达能够促进miR-34c(其靶基因是叉头框因子FoxO3a)的转录活性及表达水平,而RelA(P65)的过表达则抑制miR-34c的转录活性及表达水平[19],表明NFκB1在猪颗粒细胞中对miR-34c启动子起正向调控作用,而RelA则具有负向调控作用。虽然针对不同的基因启动子,但是NFκB1和RelA表现了一致的调控作用。
NFκB1与RelA均属于NFκB家族,该家族包括:p50(NFκB1)、p52(NFκB2)、p65 (RelA, NFκB3)、Rel (cRel)和RelB[20]。参与免疫反应的早期和炎症反应各阶段的许多分子都受NF-κB的调控,因此NF-κB又被称为炎性因子。其实,NFκB也是一种可被诱导表达的转录因子,可以调节多种与细胞存活与增殖、细胞生长与分化、炎症等相关基因的表达[17, 21]。NFκB一般结合在基因特异的位点(κB位点,5′-GGGRNNYYCC-3′;R,嘌呤;Y,嘧啶;N,任意碱基),并增强基因的表达[22]。有研究表明,在人子宫分泌期NFκB1和RelA表达量上升[23],在胚胎植入窗口期RelA表达量也很高[24]。猪的胚胎附植类似于一种炎性反应,并且被依赖于NFκB调节的一些基因的调控;在发情周期、怀孕母猪子宫内膜中,发现NFκB被激活,进而进一步调控母猪繁殖相关基因的表达[25];有文献报道,在母猪胚胎植入前NFκB就开始被激活[26]。在猪的子宫内膜中,一些与炎性相关基因白细胞介素-6和白细胞抑制因子等也受到了NFκB的调控[27]。虽然有研究表明,NFκB经常以NFκB1/RelA(p50/p65)二聚体形式激活基因的转录[22],但是其他形式二聚体也发挥着相应的作用。在猪卵巢颗粒细胞中,NFκB1二聚体促进了PGF2α的升高,但不影响PGE2;但是RelA二聚体则能够增强PGE2和PGF2α两者的释放[28];在猪颗粒细胞中,NFκB能够调控颗粒细胞的增殖,凋亡以及雌激素、孕酮等激素的分泌过程[28]。在人子宫内膜基质细胞和羊膜间充质中,NFκB能够促进PGF2α的生成[29],相反,在大鼠黄体细胞中,NFκB能够下调孕激素(P4)的分解[30]。可以看出,NFκB家族成员关乎着PGE2和PGF2α两者的生成,NFκB调控FAM213B基因可能是其中的一种方式或者机制。实际上,PGE2/PGF2α的比例还受到其他一些酶的调控,受到严格控制,如猪羰基还原酶1(CBR1)作为催化PGE2向/PGF2α转化的限速酶可以影响两者的比例[31]。因此,在猪子宫内膜中PGE2/PGF2α的精细比例受到多个基因或者酶的控制。而FAM213B基因作为其中的一种限速酶,可能是受到NFκB调控作用进而调节PGE2/PGF2α比例,但是仍需要进一步验证。
4 结论
成功克隆了猪FAM213B基因的启动子片段,并构建5'缺失片段的荧光素酶报告基因重组载体,确定-1352/-919区域为核心启动子区;在-1143/-1132和-664/-655分别存在NFκB1和RelA结合位点,而且NFκB1和RelA分别对FAM213B基因启动子活性和mRNA的表达起调控作用。
[1] SUZUKI-YAMAMOTO T, TOIDA K, SUGIMOTO YISHIMURA K. Colocalization of prostaglandin F(2alpha) receptor FP and prostaglandin F synthase-I in the spinal cord., 2009, 50(10): 1996-2003.
[2] KOMOTO J, YAMADA T, WATANABE K, WOODWARD D FTAKUSAGAWA F. Prostaglandin F2alpha formation from prostaglandin H2 by prostaglandin F synthase (PGFS): crystal structure of PGFS containing bimatoprost., 2006, 45(7): 1987-1996.
[3] CHRISTENSON L K, FARLEY D B, ANDERSON L HFORD S P. Luteal maintenance during early pregnancy in the pig: role for prostaglandin E2., 1994, 47(1): 61-75.
[4] ZIECIK A J. Old, new and the newest concepts of inhibition of luteolysis during early pregnancy in pig., 2002, 23(1/2): 265-275.
[5] GADSBY J E, LOVDAL J A, BRITT J HFITZ T A. Prostaglandin F2 alpha receptor concentrations in corpora lutea of cycling, pregnant, and pseudopregnant pigs., 1993, 49(3): 604-608.
[6] WACLAWIK AZIECIK A J. Differential expression of prostaglandin (PG) synthesis enzymes in conceptus during peri-implantation period and endometrial expression of carbonyl reductase/PG 9-ketoreductase in the pig.ogy 2007, 194(3): 499-510.
[7] WEEMS C W, WEEMS Y SRANDEL R D. Prostaglandins and reproduction in female farm animals., 2006, 171(2): 206-228.
[8] MORIUCHI H, KODA N, OKUDA-ASHITAKA E, DAIYASU H, OGASAWARA K, TOH H, ITO S, WOODWARD D FWATANABE K. Molecular characterization of a novel type of prostamide/ prostaglandin F synthase, belonging to the thioredoxin- like superfamily., 2008, 283(2): 792-801.
[9] WACLAWIK A, RIVERO-MULLER A, BLITEK A, KACZMAREK M M, BROKKEN L J, WATANABE K, RAHMAN N AZIECIK A J. Molecular cloning and spatiotemporal expression of prostaglandin F synthase and microsomal prostaglandin E synthase-1 in porcine endometrium., 2006, 147(1): 210-221.
[10] UENISHI H, EGUCHI T, SUZUKI K, SAWAZAKI T, TOKI D, SHINKAI H, OKUMURA N, HAMASIMA NAWATA T. PEDE (Pig EST Data Explorer): construction of a database for ESTs derived from porcine full-length cDNA libraries., 2004, 32(Database issue): D484-488.
[11] TANIKAWA N, OHMIYA Y, OHKUBO H, HASHIMOTO K, KANGAWA K, KOJIMA M, ITO SWATANABE K. Identification and characterization of a novel type of membrane-associated prostaglandin E synthase., 2002, 291(4): 884-889.
[12] BAZER F WTHATCHER W W. Theory of maternal recognition of pregnancy in swine based on estrogen controlled endocrine versus exocrine secretion of prostaglandin F2alpha by the uterine endometrium., 1977, 14(2): 397-400.
[13] FRANCZAK A, KUROWICKA B, OPONOWICZ A, PETROFF B KKOTWICA G. The effect of progesterone on oxytocin-stimulated intracellular mobilization of Ca2+and prostaglandin E2 and F2alpha secretion from porcine myometrial cells., 2006, 81(1-2): 37-44.
[14] DAVIS D LBLAIR R M. Studies of uterine secretions and products of primary cultures of endometrial cells in pigs., 1993, 48: 143-155.
[15] BAZER F W, THATCHER W W, MATINAT-BOTTE F, TERQUI M, LACROIX M C, BERNARD S, REVAULT MDUBOIS D H. Composition of uterine flushings from Large White and prolific Chinese Meishan gilts., 1991, 3(1): 51-60.
[16] 王首奇. 母猪怀孕11-12天子宫内膜差异表达基因的筛选与分析[D]. 广州:华南农业大学, 2011.
Wang S Q. Screening and analysis of differential gene expression in endometrum on pregnant days 11-12[D]. Guangzhou: South China Agricurial University, 2011. (in Chinese)
[17] SETHI G, SUNG BAGGARWAL B B. Nuclear factor-kappaB activation: from bench to bedside., 2008, 233(1): 21-31.
[18] 张爱玲,孙显月,卢孝璋,李加琪,张豪. 猪FAM213B基因mRNA和启动子的克隆及序列分析.华南农业大学学报, 2017, 38(3): 1-8.
ZHANG A L, SUN X Y, LU X Z, LI JQ, ZHANG H. Cloning and sequence analysis of mRNA and promoer of pig FAM213B gene., 2017, 38(3): 1-8. (in Chinese)
[19] XU Y, ZHANG A L, XIAO G, ZHANG Z, CHEN Z M, ZHANG H, LI J Q. p53 and NFκB regulate microRNA-34c expression in porcine ovarian granulosa cells., 2015, 15(8): 1816-1824.
[20] LINDSTROM T MBENNETT P R. The role of nuclear factor kappa B in human labour., 2005, 130(5): 569-581.
[21] SHISHODIA SAGGARWAL B B. Nuclear factor-kappaB activation: a question of life or death., 2002, 35(1): 28-40.
[22] INOUE J, GOHDA J, AKIYAMA TSEMBA K. NF-kappaB activation in development and progression of cancer., 2007, 98(3): 268-274.
[23] LAIRD S M, TUCKERMAN E M, CORK B ALI T C. Expression of nuclear factor kappa B in human endometrium; role in the control of interleukin 6 and leukaemia inhibitory factor production., 2000, 6(1): 34-40.
[24] KING A E, COLLINS F, KLONISCH T, SALLENAVE J M, CRITCHLEY H OSAUNDERS P T. An additive interaction between the NFkappaB and estrogen receptor signalling pathways in human endometrial epithelial cells., 2010, 25(2): 510-518.
[25] ROSS J W, ASHWORTH M D, MATHEW D, REAGAN P, RITCHEY J W, HAYASHI K, SPENCER T E, LUCY MGEISERT R D. Activation of the transcription factor, nuclear factor kappa-B, during the estrous cycle and early pregnancy in the pig., 2010, 8: 39.
[26] MATHEW D J, SELLNER E M, GREEN J C, OKAMURA C S, ANDERSON L L, LUCY M CGEISERT R D. Uterine progesterone receptor expression, conceptus development, and ovarian function in pigs treated with RU 486 during early pregnancy., 2011, 84(1): 130-139.
[27] GEISERT R DYELICH J V. Regulation of conceptus development and attachment in pigs., 1997, 52: 133-149.
[28] PAVLOVA S, KLUCSKA K, VASICEK D, KOTWICA JSIROTKIN A V. Transcription factor NF-kappaB (p50/p50, p65/p65) controls porcine ovarian cells functions., 2011, 128(1-4): 73-84.
[29] SUGINO N, KARUBE-HARADA A, TAKETANI T, SAKATA ANAKAMURA Y. Withdrawal of ovarian steroids stimulates prostaglandin F2alpha production through nuclear factor-kappaB activation via oxygen radicals in human endometrial stromal cells: potential relevance to menstruation., 2004, 50(2): 215-225.
[30] TELLERIA C M, GOYENECHE A A, STOCCO C OGIBORI G. Involvement of nuclear factor kappa B in the regulation of rat luteal function: potential roles as survival factor and inhibitor of 20alpha- hydroxysteroid dehydrogenase., 2004, 32(2): 365-383.
[31] WACLAWIK A, JABBOUR H N, BLITEK AZIECIK A J. Estradiol-17beta, prostaglandin E2 (PGE2), and the PGE2 receptor are involved in PGE2 positive feedback loop in the porcine endometrium., 2009, 150(8): 3823-3832.
(责任编辑 林鉴非)
Regulation of the Promoter of FAM213B Gene in Porcine Endometrial Cells
ZHANG AiLing1,2, SUN XianYue2, LU XiaoZhang2, WU Qi2, LI JiaQi2, ZHANG Hao2
(1Development Center of Applied Ecology and Ecological Engineering in Universities/Biology and Food Engineering Institute, Guangdong University of Education, Guangzhou 510310;2Guangdong Provincial Key Lab of Agro-animal Genomics and Molecular Breeding/College of Animal Science, South China Agricultural University, Guangzhou 510642)
To interpret partially the role of FAM213B gene expression in prostaglandin synthetise and sow pregnancy through the identification of the transcription region of porcine FAM213B gene promoter and the effection of NFκB on the promoter.The porcine endometrium from the uterus in follicular phase was digested by collagenase and the isolated endometrial cells were cultured for the detection of thepromoter activity. Based on the mRNA and promoter sequences of FAM213B gene obtained in our former work (GenBank ID: KX444503 and 100134955), the longer 5′ regulationary sequence was amplified and sequenced. Then, seven promoter fragments with 5′ terminal deletion, containingI andI sites, were linked into the Dual-luciferase Reporter vectors. Seven constructed vectors treated by endotoxin free and pRL-TK plasmid were co-transfected into endometrial cells through liposome method. The core region of transcriptional activity of the gene promoter was identified through the Dual-luciferase Reporter Assay System. The putative transcription factors binding sites were analyzed by bioinformatics, and the binding of NFκB withpromoter were detected by ChIP (Chromatin immunoprecipitation). The over-expression vectors of NFκB1and RelA and interference fragments of their own were transfected into endometrial cells. Then, the transcription activity of the promoter and mRNA expression of the gene were detected by the Dual-luciferase Reporter system and fluorescent quantitative, respectively.Through the PCR and sequencing, one fragment of 2 261 bp (-2178/+83) of porcine FAM213Bgene were obtained. The bioinformatics analysis showed that there were putative binding sites of CREB, CCAAT, E-box, and NFκB in the promoter. And the putative binding sites of NFκB were found in -1143/-1132 and -664/-655 regions. The result of the Dual-luciferase Reporter showed the region of P2 (-1352/+30) exhibited the strongest transcriptional activity, and it was significantly higher than that of P1 (-1760/+30) (<0.01), which showed there were negative regulation elements in -1760/-1352 region. And the transcriptional activity of P2 (-1352/+30) was significantly higher than that of P3(-919/+30) (<0.05), implying the existence of positive elements in -1352/- 919 region. The significant stronger activity of P3 (-919/+30) than P4(-604/+80) (<0.01) meant the existence of positive elements in -919/-604 region. No significant differences were observed between P4, P5, P6, and P7. The region of -1352/-919 was the core element of the promoter. The results of Chromatin Immunoprecipitation (ChIP) demonstrated that NFκB1 binds to one site around -1143/-1132, and RelA site around -664/-655. The co-transfection of the over expression of pcDNA3.1-NFκB1 and P2 vector into endometrial cells increased the activity of the promoter (<0.01), and the transfection of pcDNA3.1-NFκB1 enhanced the mRNA expression of(<0.05). While the co-transfection of the over expression of pcDNA3.1-RelA and P3 vector into endometrial cells decreased the activity of the promoter (<0.05), and the transfection of pcDNA3.1-RelA weakened the mRNA expression of the gene. At the same time, the transfection of inference siRNA fragments of NFκB1 and RelA into endometrial cells led the contrary results for the activity of the promoter and the mRNA expression of the gene.The core region of porcine FAM213B gene promoter was identified round -1352/-919. NFκB was the trancription factor of FAM213B gene. NFκB1 and RelA, two members of NFκB family, regulate the expression of FAM213B gene in endometrial cells.
pig; FAM213B gene; promoter; NFκB; endometrial cells
2017-03-10;
2017-10-30
国家自然科学基金(31201771)、国家现代农业产业技术体系建设专项(CARS-35)、广州市科学研究专项一般项目(201707010001)
联系方式:张爱玲,Tel:020-85285159;E-mail:zhangmeixial@163.com
