β防御素104a在不同日龄雄性山羊睾丸与 附睾中的定位及表达特性
2017-12-16郭丽娜张国林任有蛇姜玉锁刘文忠张春香
郭丽娜,张国林,任有蛇,姜玉锁,刘文忠,张春香
(山西农业大学 动物科技学院,山西 太谷 030801)
β防御素104a在不同日龄雄性山羊睾丸与 附睾中的定位及表达特性
郭丽娜,张国林,任有蛇,姜玉锁,刘文忠,张春香*
(山西农业大学 动物科技学院,山西 太谷 030801)
[目的]为了研究不同发育阶段晋兰绒山羊睾丸及附睾中β防御素104a (goat Beta-Defensins 104a, gBD104a)表达的特性。[方法]采用免疫组化法对绒山羊公羊睾丸和附睾中的gBD104a进行表达定位。[结果]免疫组化染色结果显示:在山羊睾丸的支持细胞、精母细胞、生精细胞、精子细胞中检测到的gBD104a阳性信号非常弱,且在120日龄以前,随着日龄的增加,山羊睾丸的gBD104a表达量逐渐增加,之后则随着日龄的增加而逐渐降低;在山羊附睾的柱状上皮细胞、附睾管腔游离端的纤毛细胞、管腔液中检测到的gBD104a阳性信号较强。 对免疫组化结果进行光密度值分析显示不同发育阶段附睾不同片段表达量顺序均是:附睾体 > 附睾头 > 附睾尾,且差异显著(P<0.05)。附睾体中gBD104a表达随着月龄的增加而增加,而附睾头中gBD104a表达则是在150日龄是达到高峰,随后日龄增加而降低;附睾尾gBD104a表达趋势与睾丸表达趋势的相似即:是在150日龄是达到高峰,随后日龄增加而降低。附睾精子免疫荧光结果显示,gBD104a定位在精子头部顶体、颈部和尾部主段。[结论]山羊睾丸和附睾中gBD104a表达具有时空特异性。附睾体可能是gBD104a与精子发生作用的部位。包裹在精子顶体部位的gBD104a可能与精子获能或顶体反应相关,其gBD104a功能需进一步深入研究。
gBD104a; 不同发育阶段; 免疫组化; 山羊

1 材料和方法
1.1 试验试剂
生物素/HRP标记的Mouse Anti-Rabbit二抗、DAB显色试剂盒(黄色)、即用型SABC免疫组化试剂盒购自武汉博士德;Rabbit Anti-gBD104a多克隆抗体购自北京天成新脉;其他试剂均为国产分析纯。
1.2 试验动物及组织样本制备
选用健康的、体重相近的刚出生的24只晋岚绒山羊公羔,随着日龄变化,分别为出生后7 d、30 d、60 d、90 d、120 d、150 d、180 d、270 d共8组,每组3只采样,供试山羊均由山西农业大学动物科技试验站羊场提供。将山羊阉割处理,从每只山羊的睾丸、附睾头、附睾体和附睾尾的相同部位采集组织样品,4%多聚甲醛固定12~24 h后进行浓度梯度脱水、石蜡包埋、切片,将切片置于-20 ℃保存备用。3只成年公羊附睾精子采集:将附睾用剪刀剪碎置于0.01 mol·L-1(pH 7.4)PBS中,3 000 g离心20 min,弃上清,4%多聚甲醛固定沉淀30 min,3 000 g离心20 min,弃上清,PBS洗涤2次,3 000 g离心20 min,弃上清,PBS重悬,调整精子浓度至40×109~50×109后涂片,室温晾干,用于免疫荧光。
1.3 试验方法
1.3.1 免疫组化分析
将上述8个不同发育阶段的附睾和睾丸组织的石蜡切片从-20 ℃冰箱取出,60 ℃烤片60 min后脱蜡至水,切片至于枸缘酸中加热煮沸修复,冷却至室温后加3%H2O2室温封闭20 min去除内源性过氧化物酶,滴加一抗Rabbit Anti-gBD104a,滴加PBS用作阴性对照,4 ℃过夜孵育12 h,37 ℃复温45 min,滴加二抗37 ℃孵育30 min,DAB显色,苏木素复染,封片,镜检。
1.3.2 精子免疫荧光
4%多聚甲醛固定精子涂片30~45 min,按免疫组化步骤到复温,滴加绿色荧光二抗孵育,镜鉴。
1.3.3 图像观察与分析
每张组织石蜡切片选择在400倍视野(Olympus BX52)下成像,采用Image Pro Plus 6.0软件对图像进行分析,测量计算阳性染色的组织区域(AOI)的光密度值(OD),根据计算公式:Mean density=(OD SUM)/(AOI SUM),计算阳性染色的平均光密度,进行定量分析。
1.3.4 统计分析
平均光密度值用Mean±SEM表示,gBD104在不同月龄山羊睾丸和附睾中中的表达强度采用LSD进行显著性比较,差异显著用P<0.05表示。
2 结果与分析
2.1 gBD104在睾丸和附睾中的定位
gBD104在不同发育时期山羊附睾头、体、尾中的免疫组化阳性结果呈现棕黄色(图1),在正常山羊附睾头、体、尾和睾丸中均有不同程度表达。从图1中可以看出,在7 d的附睾头、体、尾上皮细胞未分化的低柱状细胞和凹凸不平的游离端检测到阳性信号,此时没有微纤毛,细胞核在整个胞浆中所占的比例较大。60 d和90 d的附睾管上皮细胞开始出现明显的分化,细胞呈杆柱状,游离端出现少量短而粗的微纤毛,管腔增大,90 d的附睾尾管腔出现精子,在柱状上皮细胞、游离端纤毛和管腔液中检测到阳性信号。120 d时附睾上皮层明显增厚,上皮细胞呈现单层高柱状,游离端微纤毛发达,较60、90 d时细长而弯曲,胞浆大量增加,管腔明显增大且出现大量精子,管腔液增多,管壁外层被薄层平滑肌环绕,在柱状上皮细胞、游离端纤毛和管腔液中检测到阳性信号。150 d时附睾上皮又变薄,上皮细胞也呈单层柱状,管腔继续增大,管腔内的精子量较120 d时更多,结缔组织也变得致密,管腔内阳性信号较强。180、270 d时附睾上皮继续变薄,顶部纤毛清晰可见,管腔进一步变大,腔内存有附睾分泌物及精子。在柱状上皮细胞、纤毛和管腔液中的阳性信号减弱。
gBD104在山羊不同发育时期睾丸中的定位结果见图1。由图1可知,7 d时睾丸曲细精管呈现空心管状,只有单层精原细胞构成,60 d时睾丸曲精细管增厚、直径变大,在这两个时期的支持细胞、原始生精细胞和间质细胞中检测到阳性信号。90 d时睾丸曲精细管继续增厚、直径继续变大,在精原细胞、支持细胞和间质细胞中检测到阳性信号。120 d时睾丸曲精细管内靠近管腔处出现初级精母细胞,且在初级精母细胞上检测到阳性信号。150 d时管内空腔化更加明显,睾丸曲精细管直径进一步增大,靠近管腔处出现圆形精子细胞,管腔内出现长形的精子,阳性信号减弱。180 d时曲精细管直径及生精细胞组成类型与150 d时类似。270 d时睾丸的曲精管直径和管内细胞类型与180 d时相似,阳性信号微弱。
2.2 图像分析结果
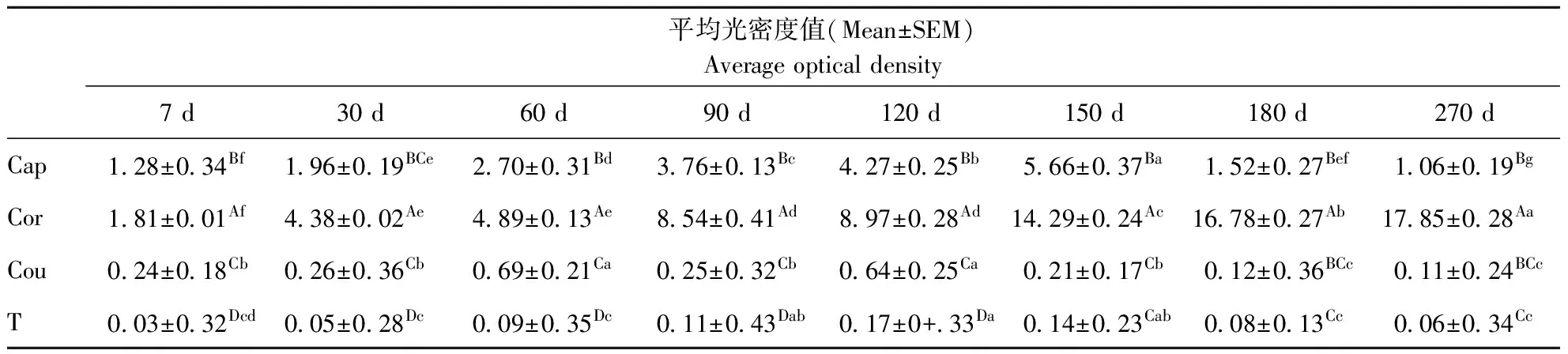
gBD104在不同发育时期附睾头、体、尾和睾丸中的免疫组化染色结果使用图像分析软件Image Pro Plus 6.0分析免疫反应阳性产物的光密度值,结果如表1所示:不同月龄山羊附睾体中gBD104蛋白表达量显著高于附睾头、附睾尾和睾丸中的表达量(P<0.05)。附睾体中gBD104蛋白的表达随着发育阶段表达量逐渐增加的现象(P<0.05)。而附睾头中gBD104a表达则是在5月龄是达到高峰,随后月龄增加而降低;附睾尾gBD104a表达趋势与睾丸表达趋势的相似。且对不同组织进行比较可以看出:附睾体和附睾头中的表达量较多,而附睾尾和睾丸中的表达量极微弱,即附睾体>附睾头>附睾尾>睾丸。
2.3 gBD104在附睾精子中的定位
黄绿色荧光为阳性表达(图2)。gBD104结合于精子头部顶体、颈部和尾部主段,呈现较强的绿色荧光(图2A)。
3 讨论
防御素是宿主执行免疫防御能力的细胞所分泌的、具有杀灭微生物活性和消除细胞毒性的小分子多肽的作用。近来,研究发现β-防御素在雄性生殖系统大量表达且与精子成熟过程相关。Scott等[28]研究发现β-防御素家族的成员中有29个基因在大鼠和小鼠的睾丸和附睾不同部分的呈现出区域特异表达特性。Morrison等[14]研究发现Defb13、Defb15、Defb35在小鼠睾丸和附睾呈区域性表达的特性,且这种表达特性与附睾上皮的成熟及相关基因调控因子的表达密切相关。Yenu等[16]的研究表明,大鼠β-防御素基因Defb21、Defb24、Defb27、Defb30 和Defb36在附睾头、体、尾均有表达。人β-防御素hBD5、hBD6、hBD105、hBD114、hBD118、hBD119、hBD120、hBD121、hBD123、hBD125、hBD128在睾丸和附睾中表达[23~25]。 Anastasiadou M等[29]在研究沙门氏菌对鸡β-防御素和Toll样受体在生长周期中的影响及附睾中β-防御素的表达规律时发现,在性成熟前后,β-防御素在鸡附睾中的表达都受不同程度的调控。绵羊β-防御素Deft124 mRNA在睾丸、附睾中的表达也呈现区域特异性其中在附睾头和附睾尾中大量表达,附睾体和睾丸中表达量很少,且在2、3、6、12月龄附睾头中的表达量呈现出递增的趋势,说明其在绵羊生殖组织中的表达表现出明显的组织依赖性和时间依赖性[26]。本课题组前期在研究gBD104amRNA在成年山羊全身个组织的表达特性时发现,gBD104a在全身个组织中均有不同程度的表达,且在附睾体和附睾头中的表达量最高,此外在分泌活动旺盛的上皮组织气管和消化道中表达量也较高。同时用免疫荧光对其在成年山羊生殖组织中的定位结果显示gBD104a在附睾柱状上皮细胞和纤毛中检测到大量阳性信号,在睾丸中只有微弱的阳性信号,且包裹在精子头部顶体和尾部中端线粒体表面。说明了gBD104a具有β-防御素的生殖和免疫调节的双重作用,在生殖器官中的高表达说明了gBD104a可能参与了精子成熟过程[27]。本研究免疫组化结果显示:不同日龄山羊附睾体中gBD104蛋白表达量显著高于附睾 头、附睾尾和睾丸中的表达量(P>0.05)。附睾体中gBD104蛋白的表达随着发育阶段表达量逐渐增加的现象(P>0.05)。而附睾头中gBD104a表达则是在5月龄是达到高峰,随后月龄增加而降低;附睾尾gBD104a表达趋势与睾丸表达趋势的相似。且对不同组织进行比较可以看出:附睾体和附睾头中的表达量较多,而附睾尾和睾丸中的表达量极微弱,即附睾体>附睾头>附睾尾>睾丸。与之前本课题组在mRNA表达水平上和免疫荧光定位的研究结果一致[27],且在不同的发育时期山羊附睾头、体、尾中均有阳性信号产物,也显示区域表达的特异性,说明其可能在精子成熟过程中发挥重要的作用。短尾猴DEFB126/ESP13.2结合在整个精子头部并参与精子获能[15],还具有保护精子免受精子抗体识别和结合的作用[20]。大鼠Bin1b结合在精子头部使精子获得向前运动的能力[15]。下调大鼠Defb15可以引起精子运动能力缺陷而导致雄性大鼠生育力下降[17]。本研究采用免疫荧光法检测了gBD104a在山羊附睾精子中的定位,结果与本课题组前期在山羊射到体外的精子上的定位结果一致[27]。在精子不同部位的表达特点表明了其在附睾头、体、尾运行中的各种变化与gBD104a相关,它与附睾内微环境之间通过相互作用,改变了精子表面的结构,对精子获得运动和受精能力起调控作用。
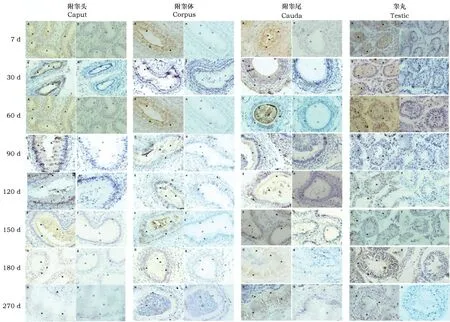
图1 gBD104在不同发育时期附睾头、体、尾和睾丸中的免疫组化定位Fig.1 Immunohistochemical localization of gBD104 in caput, corpus, cauda of epididymis and testis from different developmental stages 注:Caput、Corpus、Cauda、Testis分别为附睾头、体、尾和睾丸。 A-H:代表7、30、60、90、120、150、180、270 d 8个不同发育时期附睾头、体、尾和睾丸免疫组化阳性结果(400×,图中以▲表示阳性表达产物),a-h: 代表7、30、60、90、120、150、180、270 d 8个不同发育时期附睾头、体、尾和睾丸免疫组化阴性结果(400×,图中以△表示阴性表达产物)。Note: Caput, Corpus, Cauda, and Testis were epididymis head, body, tail, and testis. A-H stands for 8 different developmental stages from 7, 30, 60, 90, 120, 150, 180 to 270 d of of the caput, corpus, cauda of the epididymis and testis immunohistochemistry positive results on the left (Size: 400×, the positive expression product showed with ▲ in the picture). a-h stands for 8 different developmental stages from 7, 30, 60, 90, 120, 150, 180 to 270 d of of the caput, corpus, cauda of the epididymis and testis immunohistochemistry negative results on the right (Size: 400×, the negative expression product showed with △ in the picture).
Table1 Coparison of sataing intensity of gBD104 immunoreaction in caput, corpus, cauda of epididymis and testis from different developmental stages (Mean±SEM)
平均光密度值(Mean±SEM)Averageopticaldensity7d30d60d90d120d150d180d270dCap128±034Bf196±019BCe270±031Bd376±013Bc427±025Bb566±037Ba152±027Bef106±019BgCor181±001Af438±002Ae489±013Ae854±041Ad897±028Ad1429±024Ac1678±027Ab1785±028AaCou024±018Cb026±036Cb069±021Ca025±032Cb064±025Ca021±017Cb012±036BCc011±024BCcT003±032Dcd005±028Dc009±035Dc011±043Dab017±0+33Da014±023Cab008±013Cc006±034Cc
注:Cap:附睾头 Cor:附睾体 Cau:附睾尾 T:睾丸. 同一列上不同大写字母差异显著(P<0.05);同一行上不同小写字母差异显著(P<0.05)。
Note: Cap: Epididymidal caput, Cor: Epididymidal corpus, Cau: Epididymidal cauda, T: Testes The different captical letters were significantly different in the same line; the different small letters were significantly different in the same row
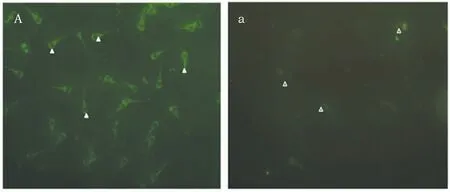
图2 gBD104在附睾精子中的表达Fig.2 Immunofluorescence of gBD104 in Epididymal sperm 注:A:为阳性结果 a:为阴性结果(400×)Note:A:The positive result a:The negative results(Size: 400×)
4 结论
gBD104a在出生后7、30、60、90、120、150、180、270 d不同发育时期的山羊睾丸和附睾中均有表达,具有时空特异性。gBD104a在附睾体中的高表达揭示附睾体可能是gBD104a与精子发生作用的主要部位。包裹在精子顶体部位的gBD104a可能与精子获能或顶体反应相关,但gBD104a的具体功能需进一步深入研究。
[1]Lehrer R I,Ganz T.Antimicrobial peptides in mammalian and insect host defence[J].Current opinion in immunology,1999,11(1):23-27.
[2]Lehrer R I.Primate defensins[J].Nature reviews.Microbiology,2004,2(9):727.
[3]Ganz T.Defensins: antimicrobial peptides of innate immunity[J].Nature reviews immunology,2003,3(9):710-720.
[4]Hall S H,Yenugu S,Radhakrishnan Y,et al.Characterization and functions of beta defensins in the epididymis[J].Asian journal of andrology,2007,9(4):453-462.
[5]Zhang J S,Liu Q,Li Y M,et al.Genome-wide profiling of segmental-regulated transcriptomes in human epididymis using oligo microarray[J].Molecular and cellular endocrinology,2006,250(1):169-177.
[6]Jelinsky S A,Turner T T,Bang H J,et al.The rat epididymal transcriptome: comparison of segmental gene expression in the rat and mouse epididymides[J].Biology of reproduction,2007,76(4):561-570.
[7]Yamaguchi Y,Nagase T,Makita R,et al.Identification of multiple novel epididymis-specific β-defensin isoforms in humans and mice[J].The Journal of Immunology,2002,169(5):2516-2523.
[8]Selsted M E,Tang Y Q,Morris W L,et al.Purification, primary structures, and antibacterial activities of beta-defensins, a new family of antimicrobial peptides from bovine neutrophils[J].Journal of Biological Chemistry,1993,268(9):6641-6648.
[9]Yount N Y,Yuan J,Tarver A,et al.Cloning and expression of bovine neutrophil beta-defensins. Biosynthetic profile during neutrophilic maturation and localization of mature peptide to novel cytoplasmic dense granules[J].Journal of Biological Chemistry,1999,274(37):26249-26258.
[10]Choi M K,Le M T,Nguyen D T,et al.Genome-level identification, gene expression,and comparative analysis of porcine β-defensin genes[J].BMC genetics,2012,13(1):98.
[11]张春香,杜海燕,张彩霞,等.山羊睾丸和附睾头β防御素家族的表达特点及生物信息学分析[J].畜牧兽医学报,2015,46(7):1122-1133.
[12]Oh J,Lee J,Woo J M,et al.Systematic identification and integrative analysis of novel genes expressed specifically or predominantly in mouse epididymis[J].BMC genomics,2006,7(1):314.
[13]Yudin A I,Tollner T L,Treece C A,et al.β-defensin 22 is a major component of the mouse sperm glycocalyx[J].Reproduction,2008,136(6):753-765.
[14]Morrison G M,Rolfe M,Kilanowski F M,et al.Identification and characterization of a novel murine beta-defensin-related gene[J].Mammalian Genome,2002,13(8):445-451.
[15]Zhou C X,Zhang Y L,Zheng M,et al.An epididymis-specific-defensin is important for the initiation of sperm maturation[J].Nature Cell Biology,2004,6(5):458.
[16]Yenugu S,Chintalgattu V,Wingard C J,et al.Identification, cloning and functional characterization of novel beta-defensins in the rat (Rattus norvegicus)[J].Reproductive Biology and Endocrinology,2006,4(1):7.
[17]张永莲,赵越,刁华.大鼠附睾特异抗菌肽β-防御素15及其用途.CN201010129861.1[P].2013-10-09.
[18]Zhao Y,Diao H,Ni Z,et al.The epididymis-specific antimicrobial peptide β-defensin 15 is required for sperm motility and male fertility in the rat (Rattus norvegicus)[J].Cellular and molecular life sciences,2011,68(4):697-708.
[19]Yudin A I,Tollner T L,Li M W,et al.ESP13. 2, a member of the β-defensin family, is a macaque sperm surface-coating protein involved in the capacitation process[J].Biology of reproduction,2003,69(4):1118-1128.
[20]Yudin A I,Generao S E,Tollner T L,et al.Beta-defensin 126 on the cell surface protects sperm from immunorecognition and binding of anti-sperm antibodies[J].Biology of reproduction,2005,73(6):1243-1252.
[21]Tollner T L,Yudin A I,Treece C A,et al.Macaque sperm release ESP13. 2 and PSP94 during capacitation: The absence of ESP13. 2 is linked to sperm-zona recognition and binding[J].Molecular reproduction and development,2004,69(3):325-337.
[22]Tollner T L,Yudin A I,Tarantal A F,et al.Beta-defensin 126 on the surface of macaque sperm mediates attachment of sperm to oviductal epithelia[J].Biology of reproduction,2008,78(3):400-412.
[23]Yenugu S,Hamil K G,Radhakrishnan Y,et al.The androgen-regulated epididymal sperm bingding protein, human β-defensin 118(DEFB118) (formerly ESC42),is an antimicrobial β-defensin[J].Endocrinology,2004,145(7):3165-3173.
[24]Rodríguez-Jiménez F J,Krause A,Schulz S,et al.Distribution of new human β-defensin genes clustered on chromosome 20 in functionally different segments of epididymis[J].Genomics,2003,81(2):175-183.
[25]Yu H,Dong J,Gu Y,et al.The novel human β-defensin 114 regulates lipopolysaccharide (LPS)-mediated inflammation and protects sperm from motility loss[J].Journal of Biological Chemistry,2013,288(17):12270-12282.
[26]李振,张国林,郭丽娜,等.Ddfb124基因在绵羊睾丸、附睾不同发育时期表达特性研究[J].中国草食动物科学,2014,34(4):5-8.
[27]任有蛇,张国林,郭丽娜,等.公山羊β防御素104a生物信息学分析及表达特性研究[J].畜牧兽医学报,2015,46(2):219-227.
[28]Jelinsky S A,Turner T T,Bang H J,et al.The rat epididymal transcriptome: comparison of segmental gene expression in the rat and mouse epididymides[J].Biology of reproduction,2007,76(4):561-570.
[29]Anastasiadou M,Avdi M,Michailidis G.Expression of avian β-defensins and Toll-like receptor genes in the rooster epididymis during growth and Salmonella infection[J].Animal reproduction science,2013,140(3):224-231.
LocalizationandexpressioncharacterofBeta-Defensins104aindifferentdaysofmalegoattestisandepididymis
GuoLi′na,ZhangGuolin,RenYoushe,JiangYusuo,LiuWenzhong,ZhangChunxiang*
(CollegeofAnimalScienceandVeterinaryMedicine,ShanxiAgriculturalUniversity,Taigu030801,China)
[Objective]This study was conducted to investigate the protein expression level of gBD104a in testis and epididymis of Jinlan Cashmere Goat at different developmental stages.[Methods]Immunohistochemical staining was used to analyze the location of gBD104a both in testis and epididymis of Cashmere Goat.[Results]Immunohistochemistry result showed that a positive reaction was found in Sertoli cells, spermatogenic cells, spermid and columnar epithelial cells, ciliated cells and luminal fluid of epididymis; The result of immunohistochemistry were analyzed by optical density value showed that the order of the expression level of different parts of epididymis in different development stages was corpus>caput>cauda of epididymis, which had a significant difference (P<0.05). The expression of gBD104a in corpus increased with the days of age, and the expression level of gBD104a in caput reached the peak in 150 days old bucks. The expression of gBD104a cauda had same tendency with that in the testis: the expression level of gBD104a in caput reached the peak in 150 days old bucks. Immunofluorescence result showed that the acrosome of sperm head, neck, and the principal piece of end had positive reaction.[Conclusion]gBD104a differentially expressed in testis and epididymis of goats by the spatio-temporal. specificity. Corpus could be the functional part between gBD104a and spermatogenesis. gBD104a coated in the sperm acrosome site could associate with capacitation or acrosome reaction of sperm, which studies on gBD104a’s function still need to be done.
gBD104a, Different developmental stages, Immunohistochemistry, Goat
S81
A
1671-8151(2017)12-0866-06
2017-08-11
2017-09-04
郭丽娜(1987-),女(汉),河南安阳人,博士研究生,研究方向:动物繁殖调控
*通信作者:张春香,副教授,Tel:0354-6285990;E-mail:zhchx66@126.com
山西省科技攻关计划项目(20110311029;20130311025-2)
张莉)
