小麦胚乳充实与颖果运输组织的解剖学研究
2017-12-16王兵陈昕钰徐德利李国权许光辉王礼焦李筠董召娣余徐润熊飞
王兵,陈昕钰,徐德利*,李国权,许光辉,王礼焦,李筠,董召娣,余徐润,熊飞*
(1.连云港市农作物技术指导站,江苏 连云港 222000; 2.扬州大学 生物科学与技术学院, 江苏 扬州 225009; 3.连云港市农业委员会,江苏 连云港 222000)
小麦胚乳充实与颖果运输组织的解剖学研究
王兵1,陈昕钰2,徐德利1*,李国权1,许光辉3,王礼焦1,李筠3,董召娣2,余徐润2,熊飞2*
(1.连云港市农作物技术指导站,江苏 连云港 222000; 2.扬州大学 生物科学与技术学院, 江苏 扬州 225009; 3.连云港市农业委员会,江苏 连云港 222000)
[目的]探明小麦胚乳物质充实状况与颖果养分运输组织在结构发育方面的关系。[方法]以连云港地区的主推品种连麦8号、连麦7号和山农20为材料,精确标记颖花的开花时间,运用树脂切片和显微技术研究了小麦胚乳物质充实与维管束和传递细胞等养分运输组织发育的结构特征。[结果]在颖果发育过程中,连麦8号的千粒重日增加量最多,充实最快,其次是连麦7号,山农20最慢;3个品种相比,连麦8号胚乳淀粉体和蛋白体结合最紧密,淀粉体和蛋白体充实度最高,连麦7号次之,山农20最低。连麦8号颖果维管束最发达,传递细胞分化最早,养分运输能力最强。[结论]连麦8号养分运输组织发育好,有利于灌浆物质的输入,导致胚乳细胞淀粉和蛋白积累增多,这可能是连麦8号胚乳物质充实好的结构基础。
小麦胚乳; 物质充实; 养分运输组织; 显微结构
小麦作为世界上最重要的粮食作物之一,在全球范围内广泛种植。统计数据表明,小麦的种植面积位于全球粮食作物第一位,产量仅次于玉米和水稻,位居第三位。颖果是小麦营养物质储藏的重要器官,其发育状况直接决定了小麦的产量和品质。小麦颖果主要由母体组织果皮和子代组织胚及胚乳构成,它们的发育彼此不同却又密切关联,两者相互协调,共同影响颖果的发育[1]。前人对发育中颖果的基因表达进行了系统的空间分析[2],并发现了一些母性以及合子的基因和转录因子等调控颖果的发育[3]。胚乳是颖果的主要部位,其重量占颖果总重量的85%以上[4]。胚乳细胞经核分裂形成合胞体,后经细胞化实现胚乳细胞的增殖[5],之后随着颖果的发育,胚乳细胞体积增大,淀粉和蛋白质逐渐充实。淀粉和蛋白质作为胚乳的主要储藏物质,分别积累在淀粉体和蛋白体这2种细胞器中,而淀粉体和蛋白体的发育状况直接影响小麦的产量和品质[6]。
小麦颖果养分运输组织由母体养分运输组织和子代养分运输组织组成,其中母体养分运输组织主要包括果皮维管束、合点、珠心突起传递细胞,子代养分运输组织主要包括传递细胞、胚乳输导细胞和糊粉层[7]。随着颖果的发育和灌浆进程,维管束附近的珠被和部分珠心组织形成合点,靠近合点的珠心组织形成珠心突起,而珠心突起又逐步分化为珠心突起传递细胞。同时,胚乳表层细胞分化为糊粉层和传递细胞,糊粉层位于胚乳的最外层,而传递细胞正对胚乳腔,由外向内可分为糊粉层传递细胞和胚乳传递细胞。前人对小麦颖果养分运输组织的形成进行了大量的研究。熊飞等人系统地观察了小麦穗部和果皮维管束的发育过程并探究了颖果中维管束的数目及其与颖果发育的关系[8],Radchuk等人发现了在珠心突起细胞的形态建成中起决定作用的基因[9],此外还有一些研究证实了糊粉层传递细胞和胚乳传递细胞具有吸收和运输养分的功能[10, 11]。
小麦灌浆其实就是胚乳物质充实的过程,被认为是小麦产量和品质形成的关键阶段[12]。小麦籽粒灌浆的快慢受自身遗传因素的限制,同时在灌浆过程中也会受到生理和环境条件的影响[13]。光合作用产生的光合产物先后通过小麦穗茎部和小穗基部的维管束运送到颖果,进而依次经过合点、珠心突起传递细胞等母体养分运输组织运输到质外体腔中,之后再经过糊粉层传递细胞、胚乳传递细胞、胚乳输导细胞等子代养分运输组织运向胚乳[14]。因此,颖果养分运输组织的发育状况会影响小麦胚乳的物质充实。然而,有关小麦胚乳物质充实与颖果养分运输组织发育之间联系的解剖学研究鲜有报道。本研究以连云港地区生产中大面积应用的主体品种连麦8号、连麦7号和山农20这3个小麦品种为材料,在系统观察颖果结构发育的基础上,分析了胚乳淀粉和蛋白的充实以及养分运输组织的结构发育特征,探究了胚乳物质充实与养分运输组织结构发育的关系,以期从细胞学角度阐明不同小麦品种间胚乳充实差异的形态学机制,旨在为提高小麦灌浆速率,选育高产品种,筛选出适合稻麦周年生产的偏早熟小麦品种提供理论依据。
1 材料与方法
1.1 供试材料
本试验选用的小麦品种为连麦8号、连麦7号由连云港农科所提供,山农20由山东农业大学提供,于2015-2016年种植于江苏(连云港)现代农业(稻麦)科技综合示范基地实验田内。在小麦生长期进行常规化管理,及时防控病虫害;小麦开花季节采用记号笔点颖和植株挂牌相结合的方法准确标定穗上小花的开花日期,标记的颖花均为穗中部小穗基部的两朵小花。
1.2 小麦灌浆速度差异的鉴定
从花后5 d开始,每隔2 d采集3种小麦的新鲜颖果,测定其千粒重,根据千粒重的增加情况,比较不同小麦品种间灌浆的快慢。
1.3 颖果的显微结构观察
取不同发育时期的颖果,用洁净的剃须刀片横向切取颖果中部2 mm厚的样品片段并迅速置于2.5%戊二醛(25%戊二醛溶于pH 7.2 磷酸缓冲液稀释)中前固定48 h(4 ℃)。固定后的样品再次用磷酸缓冲液漂洗(共3次,每次10 min),后经梯度乙醇 (20%,40%,60%,70%,80%,90%,95%和100% 3次,每次10 min)脱水,环氧丙烷置换,Spurr低粘度树脂浸透与包埋,于70 ℃下聚合12 h。聚合好的样品先用玻璃刀在超薄切片机(Leica Ultracut R)上切1 μm的半薄切片,并用0.5%甲基紫染色,在光学显微镜(DMLS, Leica)下观察并拍照。每个品种选取3个颖果作为重复,每个颖果来自不同麦穗。
1.4 筛管和导管细胞直径和面积的测量以及胚乳细胞淀粉体和蛋白体相对面积的统计
参照余徐润等[15]的方法,对胚乳中的一些结构进行定量的统计分析。具体步骤如下:先使用Photoshop中的魔棒和画笔工具对筛管和导管细胞以及胚乳中的淀粉体和蛋白体进行颜色填充处理,然后用Image-Pro Plus软件分析显微图像。利用软件中的工具测定导管和筛管细胞的直径以及填色区域的面积,并计算淀粉体和蛋白体所占的相对面积。每个样品统计3个颖果作为重复,每个颖果统计3张显微图片。
1.5 数据统计
用Microsoft Excel(Version 2016, Microsoft, USA)统计试验结果,并用SPSS (Version 19.0, International Business Machines Corporation, USA)进行显著性检验,数据的显著性检验在0.05水平上利用LSD法进行。采用Photoshop图像处理软件(Version CS6, Adobe, USA)制作图版,并用Origin函数绘图软件(Version 9.1, OriginLab, USA)绘制统计图。
2 结果与分析
2.1 小麦颖果的千粒重和灌浆速度
3个小麦品种在颖果发育期间千粒重的增长情况见图1。在整个发育过程中,连麦8号的千粒重要始终大于连麦7号和山农20,其中山农20的千粒重最小(图1A)。从千粒重的日增长量来看,连麦8号千粒重的增加速度较快,特别是在花后5~7 d,增长量最高,在花后25 d之后,千粒重基本保持不变,这说明连麦8号在早期灌浆速度快,充实完成早。连麦7号和山农20的颖果千粒重增长相对较慢,其中连麦7号的千粒重日增长量略高于山农20,在花后21~29 d,2种小麦的千粒重仍表现出缓慢的增长趋势,表明这2个小麦品种灌浆速度慢,充实完成时间略长(图1B)。

图1 小麦颖果灌浆期千粒重的变化Fig.1 Changes of 1 000-grain weight during wheat grain filling
2.2 小麦胚乳细胞中淀粉和蛋白的充实
淀粉和蛋白质是小麦胚乳的主要储藏物质,随着颖果的灌浆,淀粉体和蛋白体在胚乳细胞中开始形成、发育和充实。我们对3种小麦不同发育时期的胚乳细胞的充实进行了显微结构观察(图2),同时采用Image-Pro Plus软件统计了胚乳细胞中淀粉体和蛋白体的相对面积(图3)。花后10 d,连麦8号的胚乳细胞中积累了一定数量的淀粉颗粒,包括圆球型的小淀粉粒和不规则形状的大淀粉粒,连麦7号的胚乳细胞中也积累了许多淀粉体且其体积大,而山农20的胚乳细胞中淀粉体充实程度低,只能观察到一些纺锤形的淀粉体零星地分布在细胞壁周围(图2A, D, G),统计数据也表明连麦8号胚乳细胞中淀粉体的相对面积显著高于其它2个小麦品种(图3A)。同时在连麦8号和连麦7号的胚乳细胞中还能观察到一些蛋白体,但连麦8号胚乳中蛋白体的体积明显比连麦7号的大,蛋白体的相对面积也显著高于连麦7号(图2A, D; 图3B)。而山农20胚乳细胞中只积累了少量小的蛋白体,并且蛋白体的相对面积在3个小麦品种也是最低(图2G; 图3B)。这些结果说明,在花后10 d,连麦8号胚乳中淀粉和蛋白的充实最好,连麦7号胚乳中淀粉体积累多而蛋白体积累少,山农20胚乳淀粉体和蛋白体的充实程度较低。花后15 d,胚乳细胞进一步充实,淀粉体和蛋白体体积增大。

图2 小麦颖果胚乳的显微结构Fig.2 Microstructure of wheat endosperm filling 注:(A-C) 连麦8号胚乳;(D-F) 连麦7号胚乳;(G-I) 山农20胚乳。A、D、G,花后10天;B、E、H,花后15天;C、F、I,花后25天.。SG,淀粉体;PB,蛋白体。标尺:40 μmNote:(A-C) endosperm of Lianmai 8; (D-F) endosperm of Lianmai 7; (G-I) endosperm of Shannong 20. A, D, G, 10 days after anthesis; B, E, H, 15 days after anthesis; C, F, I, 25 days after anthesis. SG, starch granules; PB, protein bodies. Scale bar: 40 μm
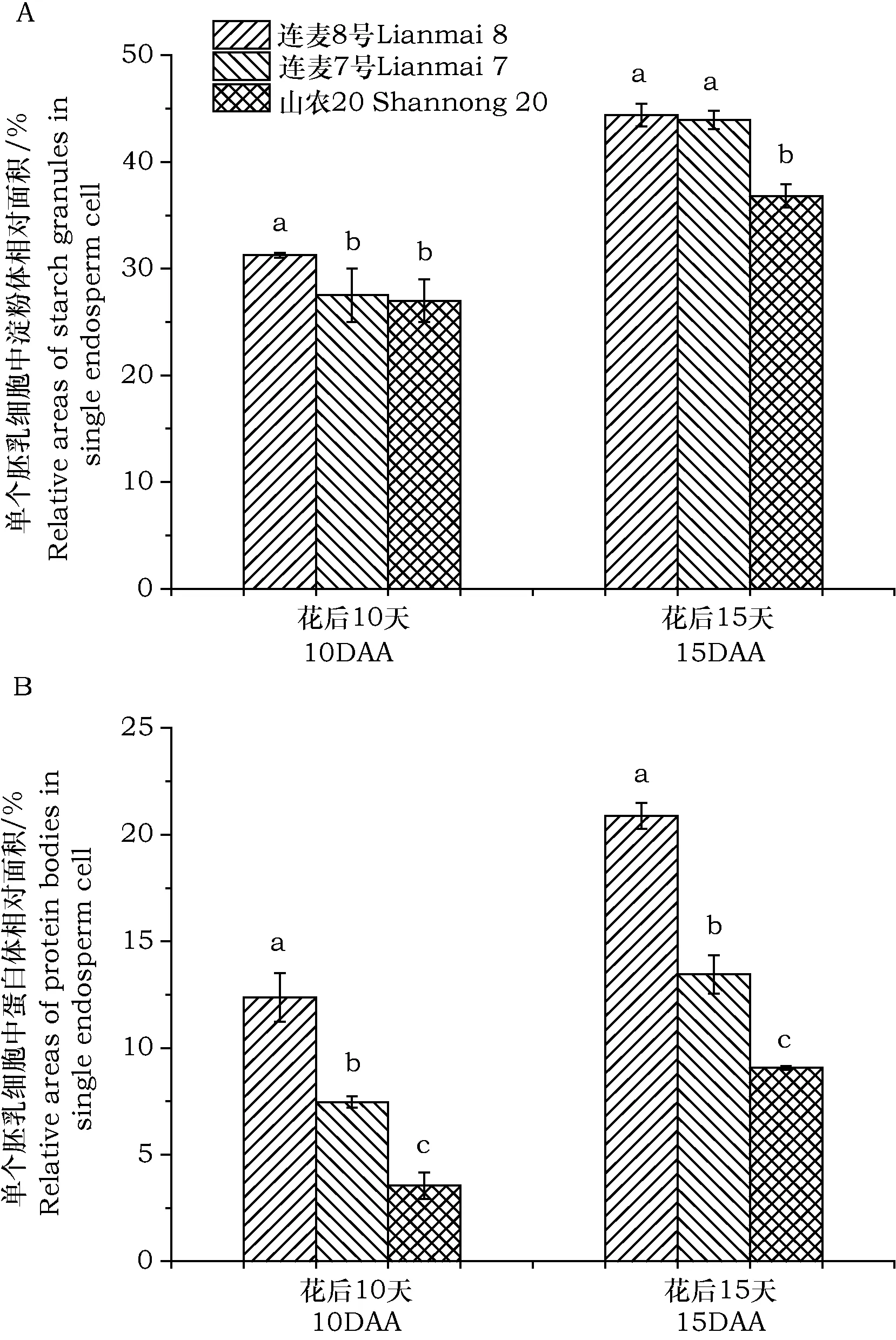
图3 小麦胚乳细胞中淀粉体和蛋白体的充实情况Fig.3 Filling degree of starch granule and protein body in wheat endosperm 注:(A) 3种小麦单个胚乳细胞中淀粉体相比面积;(B) 3种小麦单个胚乳细胞中蛋白体相对面积。柱形图上方不同小写字母表示不同小麦品种间存在显著差异(P< 0.05)。Note: (A) relative areas of starch granules in three wheat cultivars endosperm cell; (B) relative areas of protein bodies in three wheat cultivars endosperm cell. Different lowercase letters above histogram indicate significant difference between wheat cultivars at the P< 0.05 level.
连麦8号和连麦7号的胚乳细胞基本被淀粉体和蛋白体所充实,淀粉体相对面积高,但是连麦8号胚乳细胞中蛋白体的数量明显比连麦7号多、体积大,蛋白体相对面积明显高于连麦7号(图2B, E; 图3)。然而,山农20胚乳细胞的淀粉和蛋白充实仍然不高,能观察到一些小蛋白体积累在细胞中央,周围积累有一定数量的淀粉体,同时山农20胚乳细胞中淀粉体和蛋白体的相对面积显著低于其它2个小麦品种(图2H, 图3B)。到了花后25 d,连麦8号和连麦7号的胚乳细胞完全被淀粉体充实,并且出现了大量的小淀粉体,同时,积累的大蛋白体填充在淀粉体空隙间,被挤压变形(图2C, F)。此时,山农20的胚乳细胞才基本被淀粉体和蛋白体充实,但是蛋白体体积小(图2I)。综合以上结果表明,随着颖果的灌浆,连麦8号胚乳中淀粉体和蛋白体积累多,充实快,而山农20胚乳的淀粉和蛋白充实程度最低,充实慢。
2.3 小麦颖果养分运输组织的结构发育
对3种小麦颖果的维管束进行树脂切片和显微观察,结果见图4。花后15 d,颖果维管束发育成熟,具有养分运输的能力。连麦8号维管束的筛管和导管发达,细胞大且数目多;筛管和导管周围的维管薄壁细胞中已经积累了少量的淀粉体,细胞核开始变淡解体(图4 A, B),这些都表明连麦8号维管束发育得早,已经开始运输灌浆物质。连麦7号和山农20小麦颖果维管束中筛管和导管的细胞数量少,维管薄壁细胞中还未积累淀粉体(图4C, D)。同时,山农20筛管周围的维管薄壁细胞被挤压变形,导管周围的维管薄壁细胞细胞核明显,还没解体。这表明连麦7号和山农20的维管束发育较晚,阻碍了胚乳的物质充实(图4E, F)。此外,利用Image-Pro Plus软件统计3种小麦颖果维管束中筛管和导管的细胞直径和面积,结果如表1。从表中可以看出连麦8号筛管和导管细胞的直径和面积都要显著高于其它2个小麦品种,其次是连麦7号,最低的是山农20,这就从结构上保证了连麦8号在养分运输的通道上有较为明显的优势。

图4 小麦颖果维管束显微结构Fig.4 Microstructure of vascular bundles in wheat caryopsis 注:(A, B) 连麦8号筛管和导管;(C, D) 连麦7号筛管和导管;(E, F) 山农20筛管和导管。Nu, 细胞核;SG,淀粉体;ST, 筛管;Ve, 导管;VP, 维管薄壁细胞。标尺:20 μmNote: (A, B) sieve tube and vessel of Lianmai 8; (C, D) sieve tube and vessel of Lianmai 7; (E, F) sieve tube and vessel of Shannong 20. Nu, nucleus; SG, starch granules; ST, sieve tube; Ve, vessel; VP, vascular parenchyma. Scale bar: 20 μm
3种小麦不同发育时期颖果的珠心突起传递细胞、糊粉层传递细胞和胚乳传递细胞显微结构见图5。珠心突起细胞位于合点和胚乳腔之间的区域,随着颖果的发育,珠心突起细胞会分化成珠心突起传递细胞,将养分从合点细胞卸载到胚乳腔中。从微观结构上看,3种小麦的珠心突起传递细胞的发育存在差异。花后10 d,连麦8号珠心突起细胞的细胞壁明显加厚,分化成珠心突起传递细胞,而且细胞形状较规则,排列紧密。而连麦7号和山农20珠心突起细胞的细胞壁加厚不明显,未出现分化(图5 A, E, I)。花后25 d,绝大多数珠心突起细胞分化为珠心突起传递细胞,细胞壁增厚明显,并向内突起生长形成细胞壁内突(图5C, G, K)。连麦8号珠心突起传递细胞的层数、细胞壁加厚程度以及细胞壁内突的数量均要大于其余两个小麦品种,这表明连麦8号珠心突起传递细胞发达,其发育状况要好于其他两种小麦,养分运输的能力更强。
经由珠心突起传递细胞卸载到胚乳腔中的养分之后通过子代养分运输组织(糊粉层传递细胞和胚乳传递细胞)运输到胚乳中。糊粉层传递细胞由靠近胚乳腔的最外面的1~2层胚乳细胞分化而来,与之相邻的1~2层细胞分化为胚乳传递细胞。传递细胞的发育,为胚乳中储藏物质的充实提供了结构基础。花后10 d,糊粉层传递细胞和胚乳传递细胞壁加厚,形成细胞壁内突,胚乳传递细胞中开始积累淀粉体(图5B, F, J)。到了花后25 d,传递细胞壁进一步加厚,细胞壁厚度大,细胞壁内突明显且数量多,胚乳传递细胞中积累的淀粉体数量变多,体积变大(图5D, H, L)。从传递细胞的结构发育来看,连麦8号传递细胞壁的厚度以及细胞壁内突的数量和突出程度都要高于其他两个小麦品种,同时胚乳传递细胞中积累了更多的淀粉体。这些结果都表明,连麦8号的珠心突起传递细胞、糊粉层传递细胞和胚乳传递细胞的发育都要好于连麦7号和山农20,细胞发育的进程,利于连麦8号胚乳的物质充实。

表1 花后15天三种小麦筛管和导管的直径及面积Table 1 Diameters and areas of sieve tubes and vessels in three wheat cultivars caryopses at 15 days after anthesis
注:同列不同小写字母表示存在显著差异(P<0.05)
Note: Different lowercase letters indicate significant difference at theP< 0.05 level in the same column.

图5 小麦颖果珠心突起传递细胞、糊粉层传递细胞和胚乳传递细胞显微结构Fig.5 Microstructure of wheat nucellar projection transfer cell, aleurone transfer cells and endosperm transfer cell of wheat caryopsis 注:(A-D) 连麦8号;(E-H) 连麦7号;(I-L) 山农20。A、B、E、F、I、J,花后10天;C、D、G、H、K、L,花后25天。ATC, 糊粉层传递;EC, 胚乳腔;ETC, 胚乳传递细胞;NP, 珠心突起;NPTC, 珠心突起传递细胞;SG,淀粉体;TW, 加厚的细胞壁。黑色箭头指示的为细胞壁内突。标尺:20 μmNote: (A-D) Lianmai 8; (E-H) Lianmai 7; (I-L) Shannong 20. A, B, E, F, I, J, 10 days after anthesis; C, D, G, H, K, L, 25 days after anthesis. ATC, aleurone transfer cells; EC, endosperm cavity; ETC, endosperm transfer cell; NP, nucellar projection; NPTC, nucellar projection transfer cell; SG, starch granules; TW, thickened wall. Black arrowheads in the figure indicate the wall ingrowths. Scale bar: 20 μm
综合以上结果可以发现,相比于其它2种小麦,连麦8号的养分运输组织更为发达,结构发育更完善,从而具有更强的养分运输能力,利于灌浆物质向胚乳的输入,这可能是连麦8号灌浆速度快、胚乳充实程度高的原因之一。
3 讨论与结论
小麦胚乳作为颖果的主要成分,它的充实是颖果体积和粒重增大的主要原因,直接决定了颖果的发育和小麦最终的产量。淀粉和蛋白是胚乳中主要的充实物质,其积累状况取决于胚乳细胞的数目和大小,并受颖果灌浆速度和持续时间的影响[16]。本研究中,连麦8号千粒重日增加量高,灌浆快,其胚乳在灌浆过程中淀粉和蛋白的充实程度都明显高于其它2个小麦品种,淀粉体和蛋白体积累得最多。在前人的研究中也有类似的报道,刘大同等人发现灌浆快的小麦品种扬麦16,其胚乳细胞中淀粉体和蛋白体发育好,胚乳充实饱满[17]。与之不同的是,我们统计了胚乳细胞中淀粉体和蛋白体的相对面积,从数量上更直观地表明胚乳的物质充实情况。此外,连麦8号具有产量高,籽粒饱满,容重高的特点[18]。在灌浆过程中,连麦8号的千粒重始终高于连麦7号和山农20,籽粒体积大,库容大。显微结构也显示,连麦8号的维管束发达,养分运输组织的发育与胚乳的物质充实相适应。因而,连麦8号“源—库—流”的协调[19],可能是其灌浆快、胚乳充实程度高的原因。
小麦胚乳中充实的储藏物质来源于经颖果养分运输组织运送的养分,维管束作为胚乳充实物质输入的重要通道,对颖果的灌浆和储藏物质的积累具有重要作用[20]。本研究中,我们通过树脂切片观察到连麦8号颖果的维管束发达,韧皮部分布广,筛管细胞数量多、直径大,这使得养分向周围组织运输的方向更多,避免维管束周围养分浓度过高而造成卸载速率下降。来自维管束的养分通过合点和珠心突起传递细胞之后,卸载到胚乳腔中。前人研究证明了珠心突起传递细胞质膜表面积的增加与颖果干物质的积累呈正相关的关系[21]。我们观察到连麦8号珠心突起传递细胞壁的增厚要早于其它2个小麦品种,细胞层数多,壁内突发达、数量多,细胞排列紧密,这种结构特点能够使维管束运输来的物质被更多、更高效地卸载到胚乳腔中。与珠心突起传递细胞隔着胚乳腔相对的最外面2~3层胚乳细胞分化为糊粉层传递细胞和胚乳传递细胞,它们是胚乳腔中的养分输入胚乳的重要途径[22]。本研究表明,连麦8号传递细胞的发育要好于连麦7号和山农20,其细胞壁增厚程度明显,细胞壁内突数量多,这扩大了灌浆物质向胚乳运输的接触面和通道,提高了胚乳腔中的养分输入胚乳的速度。总之,连麦8号颖果养分运输的结构发育特征与胚乳中物质快速而大量的充实相适应,这可能是造成其灌浆快、胚乳充实程度高的结构学基础。
[1]Garcia D,Fitz Gerald J N,Berger F.Maternal control of integument cell elongation and zygotic control of endosperm growth are coordinated to determine seed size in Arabidopsis[J].Plant Cell,2005,17(1):52-60.
[2]Drea S,Leader D J,Arnold B C,et al.Systematic spatial analysis of gene expression during wheat caryopsis development[J].Plant Cell,2005,17(8): 2172-2185.
[3]Li N,Li Y.Maternal control of seed size in plants[J].Journal of Experimental Botany,2015,66(4):1087.
[4]张传辉,姜东,戴廷波,等.谷物籽粒淀粉合成与品质改良研究进展[J].中国粮油学报,2006,21(6):87-91.
[5]Brown R C,Lemmon B E,Olsen O A.Endosperm development in barley:microtubule involvement in the morphogenetic pathway[J].Plant Cell,1994,6(9):1241-1252.
[6]王忠,顾蕴洁,李卫芳,等.小麦胚乳发育及其养分输入的途径[J].作物学报,1998,24(5):536-543.
[7]余徐润.小麦颖果发育及其对氮素和干旱胁迫响应的研究[D].扬州:扬州大学,2016.
[8]熊飞,孔妤,孟秀蓉,等.小麦穗部和颖果维管束系统的发育解剖学研究[J].麦类作物学报,2009,29(1):93-99.
[9]Radchuk V,Borisjuk L,Radchuk R,et al.Jekyllencodes a novel protein involved in the sexual reproduction of barley[J].Plant Cell,2006,18(7):1652-1666.
[10]王慧慧,王峰,刘大同,等.小麦胚乳传递细胞发育的结构观察[J].麦类作物学报,2011,31(5):944-952.
[11]Wang H L,Offler C E,Patrick J W.Nucellar projection transfer cells in the developing wheat grain[J].Protoplasma,1994,182(1-2):39-52.
[12]李世清,邵明安,李紫燕,等.小麦籽粒灌浆特征及影响因素的研究进展[J].西北植物学报,2003,23(11):2031-2039.
[13]刘源霞,王文文,张保望,等.小素籽粒灌浆特性与千粒重的相关性分析[J].东北农业大学学报,2014,45(4):12-17.
[14]Yu X R,Chen X Y,Zhou L,et al.Structural development of wheat nutrient transfer tissues and their relationships with filial tissues development[J].Protoplasma,2015,252(2):605-617.
[15]余徐润,周亮,荆彦平,等.Image-Pro Plus软件在小麦淀粉粒显微图像分析中的应用[J].电子显微学报,2013,32(4):344-351.
[16]Egli D B.Seed biology and the yield of grain crops[M].New York:CAB International,1998:178-179.
[17]刘大同,余徐润,朱冬梅,等.扬麦16“灌浆快”与颖果显微结构和内源生长素的关系[J].麦类作物学报,2017,37(6):739-749.
[18]胡曙鋆,郑燕,陈云明,等.小麦新品种连麦8号的选育及应用[J].江苏农业科学,2015,43(1):95-96.
[19]王忠.植物生理学(第2版)[M].北京:中国农业出版社,2009:238-272.
[20]王忠,顾蕴洁,李卫芳,等.小麦胚乳发育及其养分输入的途径[J].作物学报,1998,24(5):536-543.
[21]Wang H L,Offler C E,Patrick J W.The cellular pathway of photosynthate transfer in the developing wheat grain.II.A structural analysis and histochemical studies of the pathway from the crease phloem to the endosperm cavity[J].Plant Cell and Environment,1995,18(4):373-388.
[22]Thompson R D,Hueros G,Becker H,et al.Development and functions of seed transfer cells[J].Plant Science an International Journal of Experimental Plant Biology,2001,160(5):775.
Anatomicalstudyonfillingofwheatendospermanddevelopmentoftransfertissuesincaryopsis
WangBing1,ChenXinyu2,XuDeli1*,LiGuoquan1,XuGuanghui3,WangLijiao1,LiYun3,DongZhaodi2,YuXurun2,XiongFei2*
(1.LianyungangCorpTechnicalGuidanceStation,Lianyungang222000,China; 2.CollegeofBioscienceandBiotechnology,YangzhouUniversity,Yangzhou225000,China; 3.LianyungangAgricultureCommittee,Lianyungang222000,China)
[Objective]To clarify the structural relationship between wheat endosperm filling and caryopsis nutrient transfer tissues development.[Methods]Three main wheat cultivars in Lianyungang (Lianmai 8, Lianmai 7 and Shannong 20) were selected as materials and anthesis dates were labeled during the growth of wheat. Endosperm substance filling and structural characteristics of caryopsis nutrients transfer tissues were investigated by using resin slicing and microscopic observation technology.[Results]During the development of caryopsis, the increased weight of Lianmai 8 caryopses per day was the highest and its filling rate was the fastest followed by Lianmai 7 and Shannong 20. Among three wheat cultivars, starch granules and protein bodies were closely integrated in Lianmai 8 endosperm whose filling degree was the highest followed by Lianmai 7 and Shannong 20. Moreover, the nutrient transfer tissues development of Lianmai 8 was better than that of the other two wheat cultivars. Its vascular bundles were the strongest and transfer cells differentiated earliest,Resulting in strongest nutrient transport ability.[Conclusion]Nutrient transfer tissues of Lianmai 8 was well developed, which was beneficial to the input of grouting substance, leading to enhancement of starch and protein accumulation in endosperm. This may be the structural basis for better endosperm substance filling of Lianmai 8.
Wheat endosperm, Substance filling, Nutrient transfer tissues, Microstructure
S512.1
A
1671-8151(2017)12-0841-08
2017-09-09
2017-10-09
王兵(1965-),男(汉),江苏启东人,高级农艺师,研究方向:作物栽培学
*通信作者:徐德利,研究员,Tel: 0518-86090528;E-mail: lyg5527156@163.com;熊飞,教授,博士生导师,Tel: 0514-87979354;E-mail:feixiong@yzu.edu.cn
国家自然科学基金项目(31571573,31701351);江苏省农业三新工程项目(SXGC[2016]128);江苏省农业三新工程项目(SXGC[2017]089)
(编辑:韩志强)
