一氧化氮参与调控镧诱导的拟南芥主根生长的生理与分子机理
2017-12-16孙亮亮刘阳阳张苹王如玲马金虎徐进
孙亮亮,刘阳阳,张苹,王如玲,马金虎,徐进*
(1.山西农业大学 农学院,山西 太谷 030801; 2.中国科学院 西双版纳热带植物园,云南 勐腊 666303)
一氧化氮参与调控镧诱导的拟南芥主根生长的生理与分子机理
孙亮亮1,2,刘阳阳2,张苹2,王如玲2,马金虎1*,徐进2*
(1.山西农业大学 农学院,山西 太谷 030801; 2.中国科学院 西双版纳热带植物园,云南 勐腊 666303)
[目的]镧 (La)是一种稀土元素,La诱导了根尖ROS的累积,从而抑制了主根 (PR)生长。本研究旨在探明NO是否也参与调控了La诱导的根系结构重排 (RSA)。[方法]采用植物生理学和遗传学等研究方法,分析了La诱导的根尖NO累积及其生理学影响。[结果]研究表明,抑制NO的累积显著缓解了La对根尖分生区细胞分裂势的抑制,因而缓解了La诱导的PR生长抑制;进一步的遗传学分析中,我们使用NO缺陷突变体noa1证实了NO参与调控了La诱导的PR生长。抑制根尖NO的累积并不影响ROS的水平;同样抑制ROS的累积也不影响NO的水平。[结论]结果表明,La诱导的根尖NO和ROS的累积是通过相互独立的途径参与调节PR生长,因而导致了RSA。
镧; 一氧化氮; 活性氧; 主根生长; 拟南芥
作为一种作物生长调节剂,稀土元素镧 (La)已经在农业生产上使用近50年[1~3]。La影响植物的生长、发育和逆境耐受等诸多过程。大量生理学研究表明,La参与调节了植物体内抗氧化酶活性、光合作用效率、矿质元素的吸收和运输,以及激素平衡等许多方面[4,5]。低浓度的La促进了植物生长,高浓度La则显著抑制了作物生长发育[5]。研究发现,高浓度La抑制了主根 (PR)生长的同时,显著诱导侧根 (LR)发生,因而调节了植物的根系结构[3]。进一步的研究发现,La诱导的根尖活性氧 (ROS)参与调控了这一过程,但其中详细的分子机理尚不完全清楚。
一氧化氮(NO)是一种小分子、无色无味的气体。大量研究表明,NO参与调控了植物和动物体的各项生理活动。在动物体中,NO合成酶NOS催化合成NO。在高等植物体内,研究者确实探测到了NOS活性,但是,植物NOS却一直没有鉴定出来[6]。使用外源NO处理,显著抑制了植物PR生长,但却诱导了LR发生[7]。然而,NO缺失突变体noa1的PR生长却显著低于野生型对照。进一步研究发现,noa1突变体中的ROS含量显著高于野生型,因而导致了植物体内的氧化伤害和PR生长抑制的表型。这表明NO参与调控了植物体内ROS含量的动态平衡和根尖干细胞龛的活性,因而调节了PR生长[8]。NO参与调控了生长素诱导的LR发育[9]、不定根生长,以及根毛的发育过程[10]。NO在植物响应重金属毒害中的生理机理研究已有广泛报导[7,11~13]。然而,目前我们还不清楚NO是否还参与调节了稀土元素La诱导的根系构型变化过程。在本研究中,分析了La诱导的根尖NO水平,以及其对PR生长的生理作用。
1 材料与方法
1.1 植物材料与药物处理
拟南芥野生型和突变体种子分别经50%花王消毒水进行表面消毒处理5 min后,用灭菌水清洗5次,播种至1/2 MS培养基 (1%,10%蔗糖,pH 5.75)中。置于4 ℃冰箱中黑暗春化处理2 d后,取出置于温室垂直培养 (22 ℃, 16 h/8 h光周期)。药物处理包括:150 μmol·L-1La(NO3)3(Sangon, China),500 μmol·L-1L-NAME (Beyotime, China),1 mM KI (Sangon, China)。每个处理至少取20株幼苗进行分析,每实验重复3次。
1.2 GUS染色
带有GUS报告基因的转基因株系,在进行药物处理结束后,将幼苗取出置于GUS染液中[3],在37 ℃水浴锅中温浴染色3~5 h后,进行显微观察并拍照。
1.3 NO和ROS荧光探针标记和显微观察
使用NO特异荧光探针DAF-2 DA和ROS特异荧光探针植物根尖DCFH-DA (Beyotime, China)进行根尖NO和ROS含量分析。染色方法具体参考说明书。染色结束后,将根取出用磷酸缓冲液PBS冲洗2~3遍后,置于激光共聚焦显微镜下观察 (Zeiss, NO: 激发波长 495 nm,发射波长 515 nm;ROS: 激发波长488 nm,发射波长525 nm)。
2 结果与分析
2.1 La诱导根尖NO的累积参与调控PR生长
研究发现,La诱导了根尖ROS的累积[3]。已有研究表明,NO在植物根系响应重金属等非生物逆境胁迫中具有重要作用[7]。因此,我们分析了La处理下,根尖NO的水平。NO探针DAF-2 DA染色结果表明,La处理明显诱导了根尖NO的累积。La处理6 h后,NO含量明显升高,并一直维持较高的水平 (图1A)。

图1 NO参与了La诱导的PR生长抑制. A. 5 d龄拟南芥幼苗经150 μmol·L-1 La(NO3)3处理3 h~2 d. NO荧光探针DAF-2 DA染色结果。B. 500 μmol·L-1 L-NAME 处理3 d后PR生长. C. 500 μM L-NAME 处理3 d后相对PR生长.Fig.1 Involvement of NO in the La-mediated inhibition of primary root growth. A. Detection of NO production in the roots of 5-day-old wild-type seedlings exposed to 150 μM La(NO3)3 for periods of up to 2 d using the NO-specific fluorescence probe DAF-2 DA. B. Primary root length of col-0 seedlings treated with or without 150 μM La(NO3)3 in the presence or absence of 500 μM L-NAME for 3 d. C. The relative root length of col-0 seedlings treated with or without 150 μM La(NO3)3 in the presence or absence of 500 μM L-NAME for 3 d.
分析了La诱导的NO累积在PR生长中的生理作用。使用NOS抑制剂L-NAME处理后,La诱导的PR生长抑制作用得到显著缓解 (图1B)。为了进一步确认该药理学分析的结果,使用NO缺陷突变体noa1进行了遗传学验证。如图1C所示,在noa1突变体中,La诱导的PR生长抑制作用显著低于野生型对照。这些结果表明,La诱导的NO累积参与调控了PR生长。
2.2 La诱导的根尖NO和ROS累积是两条相互独立的途径
NO与ROS协同作用调控根系发育已有报导[7]。因此,我们进一步分析了La诱导的NO和ROS累积的上下游关系。使用外源NOS抑制剂L-NAME处理后,根尖ROS水平未受影响 (图2A),同样,使用ROS清除剂KI处理后,根尖NO水平也未受影响 (图2B)。遗传学分析结果表明,La处理后,与野生型相比,NO缺陷的noa1突变体中ROS水平并无明显差异 (图3A);同样,La处理下的ROS缺陷的rbohC、rbohD、rbohF突变体中NO的水平也与野生型无明显差异 (图3B)。这些结果表明,La诱导的根尖NO和ROS的累积是通过两条相互独立的途径。
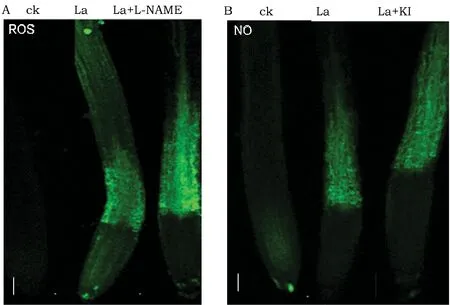
图2 根尖ROS和NO含量分析. 注:A. ROS荧光探针检测. B. NO荧光探针检测.Fig.2 Root of Ros and No content andysis. Note: Detection of ROS (A) and NO (B) production in the roots of 5-day-old wild-type seedlings exposed to 150 μM La(NO3)3 in the presence or absence of 500 μM L-NAME or 1 mM KI for 12 h using the ROS-specific fluorescent probe DCFH-DA and the NO-specific fluorescence probe DAF-2 DA.
2.3 外源NOS抑制剂处理缓解了La对根尖分生区细胞分裂势的抑制作用
研究发现,La抑制了根尖分生区细胞分裂势,因而抑制了PR生长[3]。因此使用了一个用于检测细胞周期的proCYCB1、1:CYCB1、1-GUS转基因株系,分析了La诱导的NO累积对根尖分生区细胞分裂势的影响。La处理抑制了根尖CYCB1;1-GUS活性,补充以外源NOS抑制剂L-NAME,增加了根尖GUS活性 (图4)。这些结果表明,La诱导的NO累积通过对分生区细胞的影响,参与调控了PR生长。
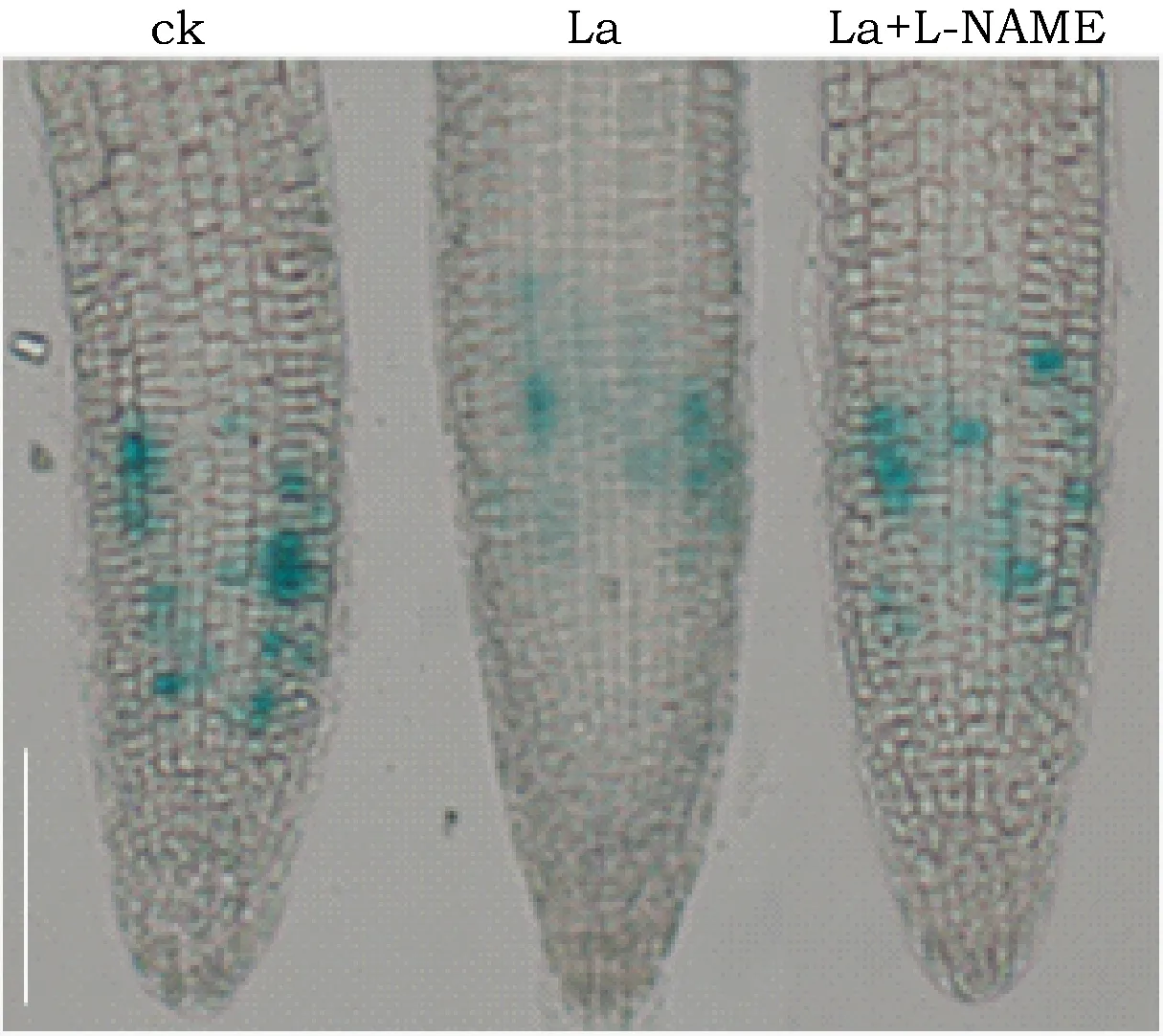
图4 proCYCB1;1:CYCB1;1-GUS幼苗经150 μM La(NO3)3处理后根尖GUS 染色分析.Fig.4 GUS staining of proCYCB1;1:CYCB1;1-GUS roots exposed to 150 μM La(NO3)3 in the presence.
3 结论与讨论
植物NO和ROS的累积, 以及它们的相互作用调控根系生长发育的机理已有报导[14,15]。La诱导了根系ROS的累积,因而影响了细胞的氧化还原状态[16,17]。La诱导了根尖ROS的累积,影响了根尖生长素的累积和分布,最终抑制了PR生 长[3]。在本研究中,进一步发现,La诱导的根系NO累积参与调控了根系构型的改变。
本研究发现,La不能诱导noa1突变体中NO的累积,表明La诱导的NO累积是通过NOA1途径。遗传学分析发现,noa1 突变体的PR生长表现出对La的不敏感表型;而且,药理学实验通过使用L-NAME抑制NO的累积,减轻了La对分生区细胞分裂的抑制作用。这些结果表明,升高的NO水平,通过对分生区细胞分裂的抑制,从而抑制了PR生长。NO可通过多种途径调控细胞的生长。在动物细胞中,NO通过氧化应激、损伤DNA、破坏Ca2+平衡等途径诱导细胞凋亡 (PCD)[18]。Cd毒害诱导的NO累积导致烟草BY2细胞出现PCD,但其中详细的分子机制尚不完全清楚。研究表明,在Zn毒害和病原菌诱导的植物细胞PCD中,是NO与ROS协同作用的结果[7,19]。NO和ROS的协同作用调控了植物生长发育和逆境响应的过程[7,18]。在拟南芥悬浮细胞系中,镉 (Cd)诱导的NO累积促进了ROS的累积[19]。锌 (Zn)毒害诱导了NO的累积促进了H2O2的累积,因而调节了根系构型[7]。本研究中我们发现,La诱导了根系NO和ROS的累积;抑制NO的累积并未影响La诱导的ROS水平,同时抑制ROS的累积也并未影响La诱导的NO的水平,遗传学分析也支持了这个结果。这些结果表明,NO和ROS参与调控了La诱导的根系发育可能通过两个相互独立的过程。
[1]He Z,Li J,Zhang H,et al.Different effects of calcium and lanthanum on the expression of phytochelatin synthase gene and cadmium absorption in Lactuca sativa[J].Plant Science,2005,168(2):309-318.
[2]Feng R,Wei C,Tu S.The roles of selenium in protecting plants against abiotic stresses[J].Environmental and Experimental Botany,2013(87):58-68.
[3] Liu Y Y,Wang R L,Zhang P,et al.Involvement of reactive oxygen species in lanthanum-induced inhibition of primary root growth[J].Journal of experimental botany,2016,67(21):6149-6159.
[4] Ruíz-Herrera L F,Sánchez-Calderón L,Herrera-Estrella L,et al.Rare earth elements lanthanum and gadolinium induce phosphate-deficiency responses in Arabidopsis thaliana seedlings[J].Plant and soil,2012,353(1-2):231-247.
[5] Wang L,Li J,Zhou Q,et al.Rare earth elements activate endocytosis in plant cells[J].Proceedings of the National Academy of Sciences,2014,111(35):12936-12941.
[6] Liu W,Li R J,Han T T,et al.Salt stress reduces root meristem size by nitric oxide-mediated modulation of auxin accumulation and signaling in Arabidopsis[J].Plant physiology,2015,168(1):343-356.
[7] Xu J,Yin H,Li Y,et al.Nitric oxide is associated with long-term zinc tolerance in Solanum nigrum[J].Plant Physiology,2010,154(3):1319-1334.
[8] Sanz L,Fernández-Marcos M,Modrego A,et al.Nitric oxide plays a role in stem cell niche homeostasis through its interaction with auxin[J].Plant physiology,2014,166(4):1972-1984.
[9] Correa-Aragunde N,Graziano M,Lamattina L.Nitric oxide plays a central role in determining lateral root development in tomato[J].Planta,2004,218(6):900-905.
[10]Tewari RK,Kim S,Hahn EJ,et al.Involvement of nitric oxide-induced NADPH oxidase in adventitious root growth and antioxidant defense inPanaxginseng[J].Plant Biotechnology Reports,2008,2(2):113-122.
[11]Yang JD,Yun JY,Zhang TH,et al.Presoaking with nitric oxide donor SNP alleviates heat shock damages in mung bean leaf discs[J].Bot Stud,2006,47:129-136.
[12]Zhang LP,Mehta SK,Liu ZP,et al.Copper-induced proline synthesis is associated with nitric oxide generation inChlamydomonasreinhardtii[J].Plant Cell Physiology,2008,49(3):411-419
[13]Xu J,Yin HX,Li X.Protective effects of proline against cadmium toxicity in micropropagated hyperaccumulator,SolanumnigrumL[J].Plant Cell Reports,2009,28(2):325-333.
[14]Foreman J,Demidchik V,Bothwell JHF,et al.Reactive oxygen species produced by NADPH oxidase regulate plant cell growth[J].Nature,2003,422(6930):442-446.
[15]Cheng NH,Liu JZ,Liu X,et al.ArabidopsisMonothiol Glutaredoxin,AtGRXS17,Is Critical for Temperature-dependent Postembryonic Growth and Development via Modulating Auxin Response[J].Journal of Biological Chemistry,2011,286(23):20398-20406.
[16]冯文新,张玉娥,王玉国,等.氯化镧对玉米幼苗渗透胁迫的减缓作用[J].河南科学,1999,17(S1):45-46.
[17]Xu CM,Zhao B,Wang XD,et al.Lanthanum relieves salinity-induced oxidative stress inSaussureainvolucrata[J].Biologia plantarum,2007,51(3):567-570.
[18]王晓健.NO与细胞凋亡[J].国外医学:生理病理科学与临床分册,2001,21(2):97-99.
[19]DeMichele R,Vurro E,Rigo C,et al.Nitric oxide is involved in cadmium-induced programmed cell death inArabidopsissuspension cultures[J].Plant Physiology,2009,150(1):217-228.
PhysiologicalandmolecularmechanismsofnitricoxideinLanthanum-modulatedprimaryrootgrowthinArabidopsis
SunLiangliang1,2,LiuYangyang2,ZhangPing2,WangRuling2,MaJinhu1*,XuJin2*
(1.CollegeofAgriculture,ShanxiAgriculturalUniversity,Taigu030801,China; 2.KeyLaboratoryofTropicalPlantResourcesandSustainableUse,XishuangbannaTropicalBotanicalGarden,ChineseAcademyofSciences,Mengla666303,China)
[Objective]Lanthanum (La) is one of rare earth elements that La represses primary root (PR) elongation by inducing ROS accumulation in root tips. The aim of the present study was to elucidate whether and how NO was also involved in La-mediated root system architecture remodeling (RSA) remain unclear.[Methods]For this purpose, we analyzed La-induced NO accumulation and its roles in modulating PR growth by integrating physiological studies and genetic analyses.[Results]Ourresult indicated that inhibition of NO accumulation alleviated the inhibitory effects of La on PR elongation. Genetics analysis using NO-defective mutantnoa1 supported theresult . Inhibition of NO production did not affect the ROS levels, and inhibition of ROS production did not affect the NO levels.[Conclusion]The result indicated that NO and ROS signaling pathways function to modulate RSA through mutually independent pathways.
Lanthanum, Nitric oxide, Reactive oxygen species, Primary root growth,Arabidopsis
S143.7+2
A
1671-8151(2017)12-0849-05
2017-07-24
2017-08-20
孙亮亮(1989-),男(汉),河南周口人,硕士研究生,研究方向:种子逆境生理
*通信作者:马金虎,教授,Tel:0871-65140420;E-mail: mjh109@126.com;徐进,教授,Tel:0871-65140420;E-mail: xujin@xtbg.ac.cn
国家自然科学基金 (31272239);国家重点研发计划 (2016YFC0501901);云南省中青年学术带头人后备人才项目(2014HB043)
(编辑:张莉)
