致犊牛腹泻肠道原虫的分子生物学鉴定
2017-12-15于正青胡瑞思王莎莎赵光辉宋军科
于正青,胡瑞思,王莎莎,赵光辉,宋军科
(西北农林科技大学动物医学院,陕西杨凌 712100)
致犊牛腹泻肠道原虫的分子生物学鉴定
于正青,胡瑞思,王莎莎,赵光辉*,宋军科*
(西北农林科技大学动物医学院,陕西杨凌 712100)
为确定导致犊牛腹泻的寄生原虫种类及分子学特性,利用基于隐孢子虫核糖体小亚基RNA、蓝氏贾第虫β-贾第素和毕氏肠微孢子虫内转录间隔区的分子生物学技术对腹泻犊牛的粪便样品进行鉴定。结果表明,引起犊牛腹泻的寄生原虫包括微小隐孢子虫、安氏隐孢子虫、瑞氏隐孢子虫、E型蓝氏贾第虫和多种基因型的毕氏肠微孢子虫,并且存在多种原虫混合感染。说明原虫是引起犊牛腹泻的重要病原,畜牧业临床中应加强原虫病的防控。
犊牛;腹泻;原虫;鉴定
腹泻是引起犊牛生长发育不良甚至死亡的重要疾病,严重威胁着养牛业的发展,其病因复杂,不仅有环境、营养等因素,还有细菌、病毒及寄生虫等病原因素。其中,寄生性肠道原虫是犊牛腹泻常见的病原[1-2]。隐孢子虫(Cryptosporidiumspp.)、蓝氏贾第虫(Giardialamblia)、毕氏肠微孢子虫(Enterocytozoonbieneusi)作为重要的牛机会性肠道原虫,不仅引起犊牛水样腹泻,严重阻碍着畜牧业发展,这些原虫还是重要的人兽共患病原,严重威胁着人类健康[3-9]。目前对于这些肠道寄生虫的检测方法主要包括病原学检测、免疫学检测及分子生物学检测。免疫学方法检测包括免疫荧光分析(immunofluorescence assay,IFA)[10-15]、酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)[16]等方法,虽然其特异性强和敏感性高,但它的检测不直接,且无法区分现症感染和既往感染。病原学检测虽可直接检测病原,提供感染的直接证据,但其费时、费力,检出率低,并需要专业人员进行种类鉴定[14]。近年来,分子生物学技术的发展为这些病原检测提供了基于PCR的直接、快速、敏感、特异的检测方法[17]。
2016年11月,陕西关中地区某牛场多数犊牛出现了严重的水样腹泻,牛场先后饲喂了痢菌净、卡那霉素、吡喹酮等,并给予口服补液盐,但没有明显效果。为明确犊牛腹泻的原因,本研究分别利用基于核糖体小亚基RNA(small sub-unit ribosomal RNA,SSU rRNA)、β-贾第素(beta-giardin,bg)和核糖体RNA基因内部转录间隔区(internal transcribed spacer,ITS)基因位点的分子生物学技术对犊牛腹泻样品进行检测,以确定Cryptosporidiumspp.、G.lamblia和E.bieneusi在此次犊牛腹泻中的作用,为犊牛腹泻的治疗和防控提供理论依据。
1 材料与方法
1.1 材料
1.1.1 临床粪便样本 采集5头腹泻犊牛的新鲜粪便,置于25 g/L重铬酸钾溶液中,混匀并放冰盒中运回实验室,置4℃保存备用。
1.1.2 试剂 粪便基因组EZNA®DNA提取试剂盒为OMEGA公司产品;10×ExTaqbuffer(不含Mg2+)、ExTaqDNA聚合酶、2.5 mmol/L dNTP、25 mmol/L MgCl2、6×Loading buffer、DNA Marker DL 2 000、溴化乙锭均为TaKaRa公司产品;引物由西安擎科泽西生物科技有限责任公司合成;琼脂糖为上海英潍捷基贸易有限公司产品;双蒸水为本实验室自制。
1.1.3 仪器设备 HC3018型台式高速离心机,安徽中科中佳科学仪器有限公司产品;SW-CJ型超净工作台,苏州安泰空气技术有限公司产品;HH-4型恒温水浴锅,国华电器有限公司产品;C-XP-D型PCR扩增仪,杭州博日科技有限公司;DYY-12型电泳仪,北京市六一仪器厂产品;ChampGel 5000型紫外凝胶成像系统,北京赛智创业科技有限公司产品;AUY220型精密电子天平,上海光学仪器一厂产品;高压蒸汽灭菌锅,上海人和科学仪器有限公司产品;微量移液器,北京大龙兴创公司产品。
1.2 方法
1.2.1 粪便DNA的提取 分别取每个粪便样品200 mg置于1.5 mL离心管中,加入蒸馏水,混匀,12 000 r/min离心1 min,弃上清,重复以上步骤直至洗净重铬酸钾溶液;然后严格按照粪便基因组EZNA®DNA 提取试剂盒说明书提取粪样基因组DNA。
1.2.2 PCR扩增及电泳 分别参照Xiao L等[18]、Cacciò S M等[19-20]及Sulaiman I M等[21]的方法进行隐孢子虫、G.lamblia和E.bieneusi的检测,使用基于SSU rRNA、bg及ITS的套式PCR,引物序列见表1,引物均由西安擎科泽西生物科技有限责任公司合成。3种原虫套式PCR第1轮PCR均在25 μL反应体系中进行,包括2.5 μL 10×ExTaqPCR buffer,2 μL dNTP(2.5 mmol/L),2 μL MgCl2(25 mmol/L),0.625 U ExTaq,1 μL基因组模板及1 μL上、下游引物(10 pmol/μL),第2轮PCR除了使用1 μL第1轮PCR产物为模板,1 μL第2轮上、下游引物外,其他反应体系与第1轮完全相同。Cryptosporidiumspp.及E.bieneusi2种原虫的PCR反应条件基本相同,94 ℃ 5 min;94 ℃,45 s,35个循环,退火温度见表1,45 s,延伸72 ℃ 1 min;最后72 ℃延伸10 min。G.lamblia的PCR反应条件为:95 ℃ 15 min,95 ℃ 30 s,35个循环,退火温度见表1,30 s,延伸72℃ 1 min;最后72 ℃延伸7 min。取4 μL第2轮PCR反应产物与0.8 μL上样缓冲液(6×loading buffer)充分混匀小心加入到含溴化乙锭的10 g/L琼脂糖凝胶中,110 V电泳30 min,利用凝胶成像分析系统中观察结果。

表1 三种原虫巢式PCR引物
1.2.3 测序及序列分析 将电泳检测阳性的第2轮PCR反应产物送至西安擎科泽西生物科技有限责任公司进行测序。应用ClustalX 1.83软件,将获得的序列的核苷酸进行比对校正,将校准序列用BLAST进行相似性分析。对于Cryptosporidiumspp.的样本使用Mega 5.1软件,以Plasmodiumovale(GenBank号码:KP050371)作为外群,采用邻接法(Neighbor-joining,NJ法),选取Kimura 2-parameter模型,bootstrap值设定为1 000,构建种系发育进化树进行种类鉴定。G.lamblia和E.bieneusi的鉴定直接采用ClustalX 1.83和BLAST比对分析。
2 结果
2.1 腹泻犊牛的症状
该牛场出现剧烈水样腹泻的犊牛以6月龄以内的犊牛为主,病犊牛的精神沉郁,食欲下降,多卧少立、被毛粗乱。腹泻发生后,牛场先后给予犊牛饲喂了痢菌净、卡那霉素、吡喹酮等,期间穿插饲喂口服补液盐,但没有明显效果,有犊牛发生死亡。
2.2 PCR扩增结果
5份送检样品(Y1-Y5)中,4份样品扩增出约392 bp的E.bieneusi的ITS基因位点(图1A),4份样品扩增出约830 bp的Cryptosporidium的 SSU rRNA基因位点(图1B),1份样品扩增出约511 bp的G.lamblia的bg基因位点(图1C)。其中,样品Y5同时扩增出了E.bieneusi、Cryptosporidium和G.lamblia的目的条带,样品Y1和Y4同时出现了E.bieneusi和Cryptosporidium的扩增条带,而Y2和Y3仅分别扩增出Cryptosporidium和E.bieneusi。
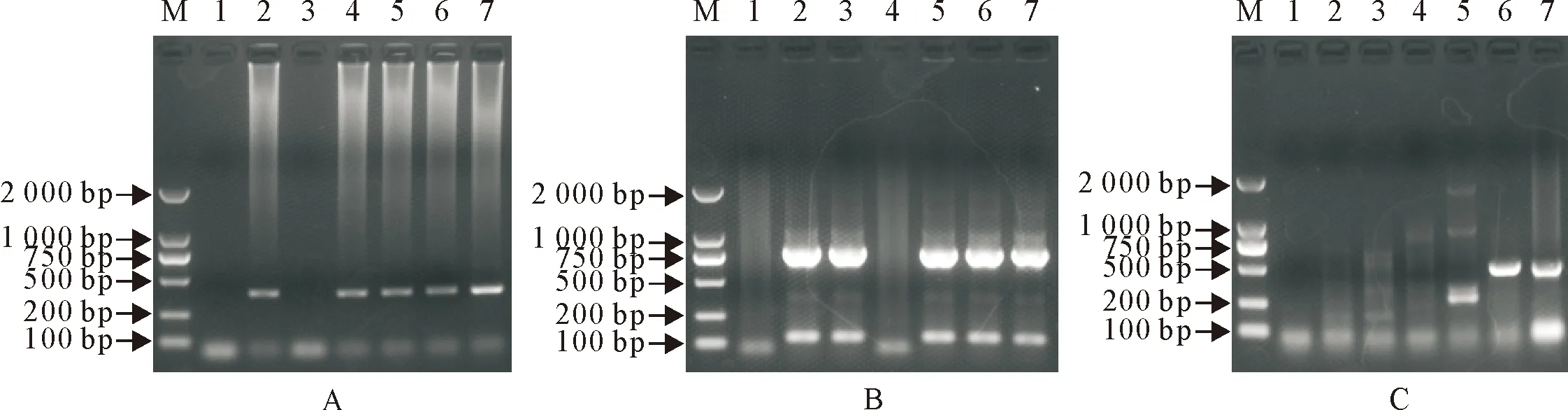
M.DNA标准 DL 2 000;1.阴性对照;2~6.样品Y1-Y5;7.阳性对照M.DNA Marker DL 2 000; 1.Negative control; 2-6.Samples Y1-Y5; 7.Positive control
2.3 致病原虫种类鉴定
为了确定致病原虫的种类,首先构建了基于SSU rRNA基因的Cryptosporidium遗传进化树(图2),样品Y1与C.andersoni位于同一进化支,样品Y2和Y4与C.parvum聚在同一进化支,样品Y5与C.ryanae位于同一进化支,且具有较高的节点支持值(>95%),说明引起本次犊牛腹泻的隐孢子虫种类为C.andersoni、C.parvum和C.ryanae。G.lamblia特异性PCR的扩增片段经测序和序列比对发现样品Y5与G.intestinalis(JN812335,基因型为E)的同源性为99%。基于E.bieneusi的ITS基因扩增的基因片段比对分析发现,样品Y1与E.bieneusi(KP262386,基因型J)同源性为100%,样品Y3与E.bieneusi(KP262380,基因型E)同源性为99%,样品Y4与E.bieneusi(KP262374,基因型CHG19)相似性为99%,样品Y5与E.bieneusi(JF776170,基因型J)同源性为100%。

图2 基于SSU rRNA基因位点的隐孢子虫的遗传进化树
3 讨论
腹泻是犊牛常见的多发性胃肠疾病,一年四季均可发生,主要危害断奶前犊牛,严重影响其生长、发育及成活;康复后的犊牛往往生长迟缓、发育不良,影响后期培育及出栏。畜牧业临床犊牛发生腹泻时,常主观判断病因为大肠埃希菌、弯曲菌等细菌感染,以及轮状病毒等病毒感染,大量应用抗生素,造成疾病延误及抗生素的耐药性、残留等问题。事实上,腹泻病因复杂,除了细菌、病毒,还可由寄生虫感染、饲养管理及应激等因素引起[22-23]。本研究的奶牛场犊牛发生大面积腹泻后,未进行病因的彻底分析及病原鉴定,先后饲喂了痢菌净、卡那霉素、吡喹酮等,并给予口服补液盐,腹泻症状不仅未能减轻,反而出现了死亡病例。经过对送检样品的分子生物学分析,发现此次腹泻的病因包括Cryptosporidium、E.bieneusi和G.lamblia的感染,而且我们根据此结果对牛场制定了相应的防控措施,犊牛病情逐渐好转,未再出现死亡病例。本研究结果提示,犊牛发生腹泻时应综合考虑各种致病因素,对疑似病原均应进行鉴定,针对性的制定相应的防治措施。
本研究的5头腹泻犊牛均感染了寄生原虫,并且3头犊牛存在混合感染,其中1头甚至同时感染了Cryptosporidium、E.bieneusi和G.lamblia3种原虫,其中的Cryptosporidium又含有C.parvum、C.andersoni和C.ryanae3个种类,E.bieneusi又含有基因型E、J和CHG19等多种基因型,结合前人的研究[25-26],提示在目前临床上,犊牛感染的寄生原虫非常复杂,而且多种原虫感染并存。基于此,在临床防控犊牛腹泻时应采取综合性防控措施以有效阻断多种原虫混合感染及发病。
Cryptosporidium、G.lamblia和E.bieneusi均为人兽共患原虫,不仅危害动物的健康,还威胁人类生活。研究发现,犊牛隐孢子虫是人隐孢子虫病的重要感染源[18],如1993年美国密尔沃基市的饮用水源密歇根湖遭到奶牛场隐孢子虫卵囊污染,导致约40多万名的市民(占城市总人口的26%)罹患该病。本研究发现,5例腹泻犊牛病例中有2例感染了人兽共患隐孢子虫种C.parvum,提示该奶牛场犊牛有传播隐孢子虫给人的风险,后续需要进一步对奶牛场的工作人员及周边居民进行隐孢子虫病的流行病学调查,以确定其危害,制定相应的防控措施,阻断该地区人、牛及其他动物隐孢子虫病的再次发生。
[1] Fayer R,Santin M,Macarisin D.Detection of concurrent infection of dairy cattle withBlastocystis,Cryptosporidium,Giardia,andEnterocytozoonby molecular and microscopic methods [J].Parasitol Res,2012,111(3):1349-1355.
[2] Matsuura Y,Matsubayashi M,Nukata S,et al.Report of fatal mixed infection withCryptosporidiumparvumandGiardiaintestinalisin neonatal calves [J].Acta Parasitol,2017,62(1):214-220.
[3] Santín M,Fayer R.Microsporidiosis:Enterocytozoonbieneusiin domesticated and wild animals [J].Res Vet Sci,2011,90(3):363-371.
[4] Xiao L,Fayer R.Molecular characterisation of species and genotypes ofCryptosporidiumandGiardiaand assessment of zoonotic transmission [J].Int J Parasitol,2008,38(11):1239-1255.
[5] Hingole A C,Gudewar J G,Pednekar R P,et al.Prevalence and molecular characterization ofCryptosporidiumspecies in cattle and buffalo calves in Mumbai region of India [J].J Parasit Dis,2017,41(1):131-136.
[6] Swapna L S,Parkinson J.Genomics of apicomplexan parasites [J].Crit Rev Biochem Mol Biol,2017,(22):1-20.
[7] Chellan P,Sadler P J,Land K M.Recent developments in drug discovery against the protozoal parasitesCryptosporidiumandToxoplasma[J].Bioorg Med Chem Lett,2017,27(7):1491-1501.
[8] Peng X Q,Tian G R,Ren G J,et al.Infection rate ofGiardiaduodenalis,Cryptosporidiumspp.andEnterocytozoonbieneusiin cashmere,dairy and meat goats in China [J].Infect Genet Evol,2016,(41):26-31.
[9] Zhao G H,Du S Z,Wang H B,et al.First report of zoonoticCryptosporidiumspp.,GiardiaintestinalisandEnterocytozoonbieneusiin golden takins (Budorcastaxicolorbedfordi) [J].Infect Genet Evol,2015,(34):394-401.
[10] Chalmers R M,Katzer F.Looking forCryptosporidium:the application of advances in detection and diagnosis [J].Trends Parasitol,2013,29(5):237-251.
[11] Josko D.Updates in immunoassays:parasitology [J].Clin Lab Sci,2012,25(3):185-190.
[12] McHardy I H,Wu M,Shimizu-Cohen R,et al.Detection of intestinal protozoa in the clinical laboratory [J].J Clin Microbiol,2014,52(3):712-720
[13] Plutzer J,Ongerth J,Karanis P.Giardiataxonomy,phylogeny and epidemiology:Facts and open questions [J].Int J Hyg Environ Health,2010,213(5):321-333.
[14] 邓明俊,肖西志,孙 敏,等.隐孢子虫检测技术研究进展 [J].动物医学进展,2013,34(7):89-95.
[15] Bandyopadhyay K,Kellar KL,Moura I,et al.Rapid microsphere assay for identification ofCryptosporidiumhominisandCryptosporidiumparvumin stool and environmental samples [J].J Clin Microbiol,2007,45(9):2835-2840.
[16] 何宏轩,张西臣,尹继刚,等.应用间接ELISA检测微小隐孢子虫抗体的研究 [J].中国兽医科技,2003,33(6):24-27.
[17] Checkley W,White A C Jr,Jaganath D,et al.A review of the global burden,novel diagnostics,therapeutics,and vaccine targets forCryptosporidium[J].Lancet Infect Dis,2015,15(1):85-94.
[18] Xiao L,Escalante L,Yang C,et al.Phylogenetic analysis ofCryptosporidiumparasites based on the small-subunit rRNA gene locus [J].Appl Environ Microbiol,1999,65(4):1578-1583.
[19] Cacciò SM,De Giacomo M,Pozio E.Sequence analysis of the beta-giardin gene and development of a polymerase chain reaction-restriction fragment length polymorphism assay to genotypeGiardiaduodenaliscysts from human faecal samples [J].Int J Parasitol,2002,32(8):1023-1030.
[20] Lalle M,Pozio E,Capelli G,et al.Genetic heterogeneity at the beta-giardin locus among human and animal isolates ofGiardiaduodenalisand identification of potentially zoonotic subgenotypes [J].Int J Parasitol,2005,35(2):207-213.
[21] Sulaiman I M,Bern C,Gilman R,et al.A molecular biologic study ofEnterocytozoonbieneusiin HIV-infected patients in Lima,Peru [J].J Eukaryot Microbiol,2003,50(Suppl):591-596.
[22] 王 静,何生虎,葛 松,等.犊牛腹泻的发病原因及治疗的研究进展 [J].农业科学研究,2013,34(3):59-62.
[23] 曹明泽,朱 阵,王 磊,等.犊牛腹泻概述 [J].黑龙江畜牧兽医,2016,(14):116-119.
[24] Abeywardena H,Jex A R,Koehler A V,et al.First molecular characterization ofCryptosporidiumandGiardiafrom bovines (BostaurusandBubalusbubalis) in Sri Lanka:unexpected absence of C.parvum from pre-weaned calves [J].Parasit Vectors,2014,7:75.
[25] Wang X T,Wang R J,Ren G J,et al.Multilocus genotyping ofGiardiaduodenalisandEnterocytozoonbieneusiin dairy and native beef (Qinchuan) calves in Shaanxi province,northwestern China [J].Parasitol Res,2016,115(3):1355-1361.
[26] Xiao L,Feng Y.Zoonotic cryptosporidiosis [J].FEMS Immunol Med Microbiol,2008,52(3):309-323.
IdentificationofIntestinalProtozoaCausingDiarrheainCalvesbyMolecularBiology
YU Zheng-qing,HU Rui-si,WANG Sha-sha,ZHAO Guang-hui,SONG Jun-ke
(CollegeofVeterinaryMedicine,NorthwestA&FUniversity,Yangling,Shaanxi,712100,China)
To determine the protozoan species that cause calf diarrhea,molecular techniques based on the small sub-unit ribosomal RNA ofCryptosporidium,β-giardin ofGiardialamblia,and internal transcribed spacer ofEnterocytozoonbieneusiwere used to identify the fecal samples of diarrheal calves.The protozoa causing diarrhea of calves includedC.parvum,C.andersoni,C.ryanae,type EG.lamblia,and several genotypes ofE.bieneusi,and mixed infection of several protozoa were also observed.The protozoa were the important pathogens causing diarrhea of calves,and controlling the protozoan diseases should be strengthened in the clinic of animal husbandry.
calf; diarrhea; protozoa; identification
2017-05-24
国家自然科学基金项目(31572509);陕西省科学技术研究发展规划资助项目(2016NY-113);中国博士后面上项目(2016M592848);陕西省博士后科研项目资助特别资助
于正青(1992-),男,山东威海人,硕士研究生,主要从事动物寄生虫病研究。*
S852.72
A
1007-5038(2017)11-0048-05