周围血管分型对不同病理类型亚实性结节的诊断价值
2017-12-15李淑静张晨光李建科朱振龙
李淑静 张晨光 李建科 朱振龙
·论著·
周围血管分型对不同病理类型亚实性结节的诊断价值
李淑静 张晨光 李建科 朱振龙
目的对不同病理类型肺内单发亚实性结节与周围血管关系进行分型,探讨其对SSNs良恶性的诊断价值。方法回顾性分析88例临床病理证实的肺内单发SSNs的CT图像。将SSNs与周围血管的关系分为四型,对不同病理类型SSNs与周围血管分型进行统计学分析。结果良性结节46例中,周围血管分型Ⅱ型最多(28/46)。癌前病变组、微浸润腺癌组、浸润性腺癌组,周围血管分型均未表现为Ⅰ型。浸润性腺癌组周围血管分型Ⅲ+Ⅳ型比例为93.3%(28/30)。病理类型与周围血管分型比较有统计学意义(χ2=39.259,Plt;0.01)。结论不同病理类型SSNs与周围血管分型不同,对SSNs性质的判定有一定帮助。表现为Ⅰ型,提示良性可能性大;表现为Ⅲ或Ⅳ型,提示恶性可能性大。
亚实性结节;血管;肺腺癌;病理;计算机体层摄影术,X线
肺癌是目前世界上病死率最高的癌症[1],且作为肺癌主要病理类型的肺腺癌发病率逐年增加[2]。在CT上肺腺癌可表现为实性结节(solid nodule,SN)及亚实性结节(subsolid nodules,SSNs)[3]。肺SSNs包括纯磨玻璃结节(pure ground-glass nodule,pGGN)和部分实性磨玻璃结节(part-solid ground-glass nodule)[4]。尽管SSNs的发病率低于实性结节,但恶性的可能性大于实性结节[5]。众多周知,早期诊断早期治疗是提高肺癌患者生存率的关键[6,7]。如能对CT检查中发现的SSNs准确定性并合理干预,对改善疾病的预后非常重要。本研究拟对不同病理类型SSNs及周围血管进行分型及相关性研究,以期提高诊断准确性。
1 资料与方法
1.1 一般资料 回顾性分析河北医科大学第一医院2011年7月至2016年7月手术病理证实或按照Fleischner学会2013版亚实性结节随诊推荐方案[8]证实的结节共计88例。男35例,女53例;年龄39~78岁,平均(58.14±8.85)岁;胸痛2例,咳嗽、咳痰8例,痰中带血2例,78例无症状。
1.2 纳入标准 (1)年龄30~80岁;(2)无原发恶性肿瘤病史;(3)无慢性肺部疾病病史;(4)无肺部疾病过敏史;(5)无石棉、粉尘及药物过敏史。
1.3 检查方法 采用美国LightSpeed 64层螺旋CT。患者仰卧,双手上举,于深吸气末屏气行螺旋CT扫描,扫描范围自胸廓入口至后肋膈角。扫描参数为管电压120 kV,管电流为噪声系数为8的智能毫安自动控制,螺距0.938,层厚5 mm、间隔5 mm,矩阵512×512,所有患者行层厚1.25 mm间隔1.25 mm高分辨肺算法重建。
1.4 CT图像观察与分析 病灶大小在肺窗进行测量,用平均直径进行量化,即病灶最大层面最大径与垂直径之和除2。并将其分为3组:lt;1.0 cm组,1.0~2.0 cm组,gt;2.0 cm组。用径线法对实性成分进行量化。分别测量整个病灶及实性成分的最大长泾、最大短径及上下径,分别求其体积,二者相除即为实性成分比例。按实性成分比例(实性部分gt;50%及≤50%)将mGGN(mixed ground-glass nodule,mGGN )分为A、B两类。SSNs与周围血管之间关系类型分为四型[9]:Ⅰ型:周围血管从SSNs旁绕行;Ⅱ型:无扭曲扩张的周围血管穿过SSNs;Ⅲ型:扭曲扩张的周围血管穿过SSNs;Ⅳ型:更为复杂的周围血管征象。
1.5 病理诊断 病理诊断采用2011年国际肺癌研究协会/美国胸科学会/欧洲呼吸学会分类标准[10]。将浸润性腺癌、微浸润腺癌及浸润前病变归为恶性结节。手术切除后肉眼可见的病灶全部取材,HE染色及免疫组化染色。所有病理诊断由2名具有高级职称的病理医师讨论后确定。
1.6 统计学分析 应用SPSS 19.0统计软件,计数资料采用χ2检验,若有理论数lt;1或所得概率接近检验水平时,用Fisher确切概率算法检验,Plt;0.05为差异有统计学意义。
2 结果
2.1 病理分型 入选病例共88例,手术病理70例,其中原位腺癌4例,不典型腺瘤样增生2例,微浸润腺癌6例;高分化浸润性腺癌7例,中分化浸润性腺癌23例,良性结节28例,包括肺泡组织慢性炎症18例,平滑肌组织瘤样增生3例,胶原纤维组织增生5例,干酪样坏死2例,其余18例为随访证实。所有病例未发现转移。
2.2 不同病理类型SSNs与病变部位、大小及周围血管类型的关系
2.2.1 病理类型与病变部位及大小关系:病理类型与病变部位之间无统计学意义(χ2=9.700,P=0.882)。病理类型与病变大小差异有统计学意义(χ2=119.134,Plt;0.01),不同大小SSNs组间比较差异均有统计学意义(χ2=29.103,Plt;0.01,χ2=60.000,Plt;0.01;χ2=47.267,Plt;0.01)。见表1。
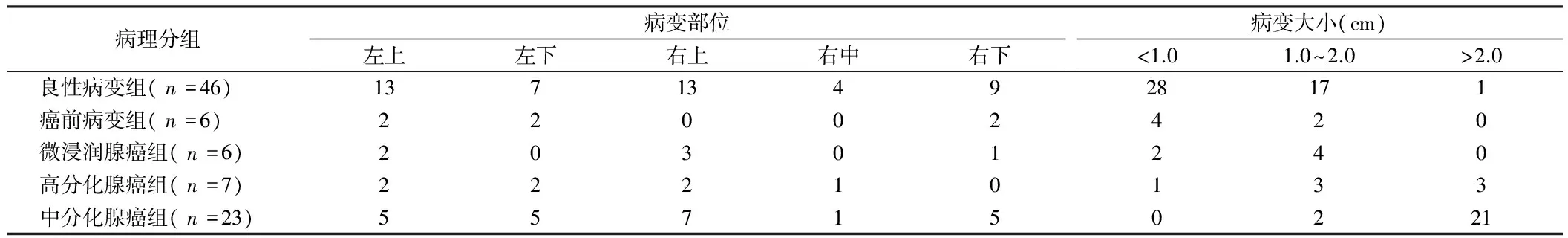
表1 病理类型与病变部分及大小 个
2.2.2 病理类型与周围血管分型及关系:病理类型与周围血管类型比较有统计学意义(χ2=39.259,Plt;0.01)。良性病变组与癌前病变组、高分化腺癌组及中分化腺癌组之间比较差异有统计学意义(χ2=10.199,P=0.017;χ2=9.636,P=0.022;χ2=34.617,Plt;0.01)。癌前病变组与中分化腺癌组之间比较差异有统计学意义(χ2=8.363,P=0.015)。微浸润腺癌组及高分化腺癌组与中分化腺癌组之间比较差异均有统计学意义(χ2=18.335,Plt;0.01;χ2=7.042,P=0.030)。见表2。

表2 不同病理类型SSNs与充气支气管关系的类型 个
2.3 典型病例 见图1~5。

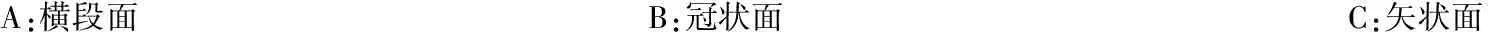
A:横段面B:冠状面C:矢状面
图1 女,60岁,周围血管类型Ⅰ型,病理:慢性炎症伴纤维组织增生
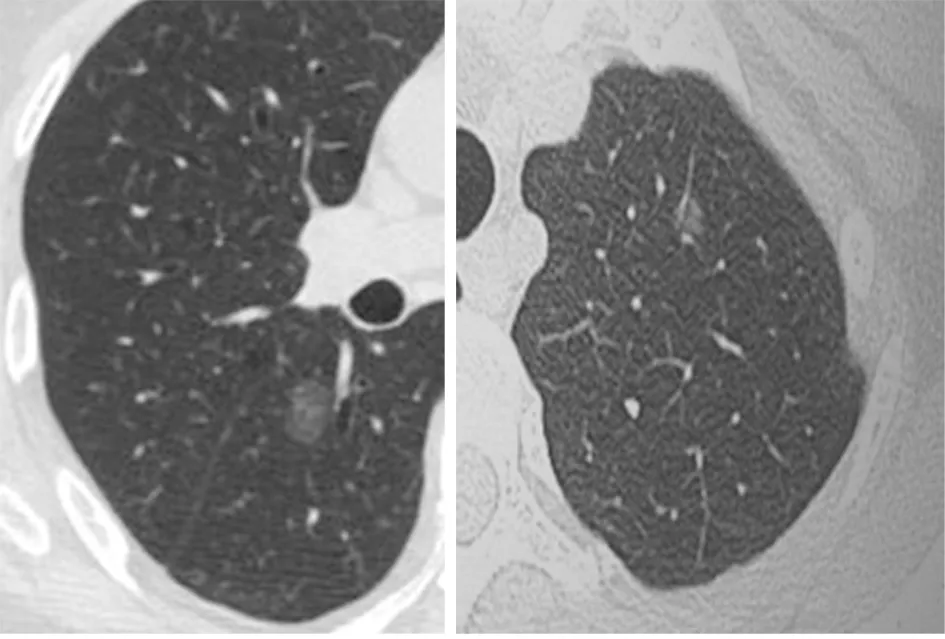
图2 男,75岁,周围血管类型Ⅱ型,病理:不典型腺瘤样增生图3 女,49岁,周围血管类型Ⅱ型,病理:原位腺癌
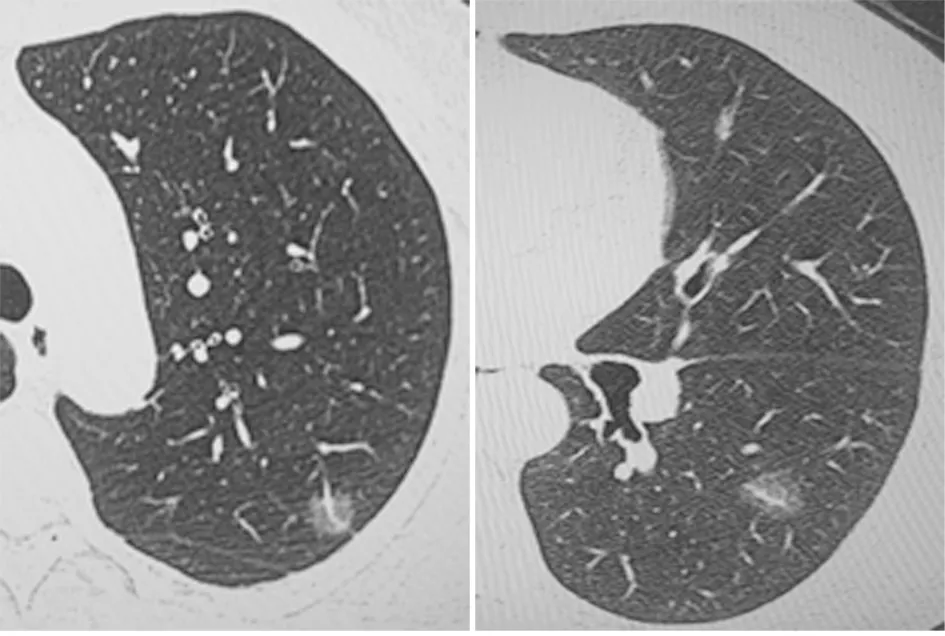
图4 女,55岁,周围血管类型Ⅲ型,病理:微浸润腺癌图5 女,50岁,周围血管类型Ⅲ型,病理:中分化腺癌
3 讨论
本研究发现良性结节46例中,与周围血管类型Ⅱ型最多(28/46),Ⅲ型其次(13/46),Ⅰ型最少(4/46),但癌前病变组、微浸润腺癌组、浸润性腺癌组均未表现为Ⅰ型。浸润性腺癌组30例中Ⅲ型最多(17/30),Ⅳ型其次(11/30),Ⅱ型最少(2/30),Ⅲ+Ⅳ型比例为93.3%(28/30)。病理类型与周围血管类型比较有统计学意义(χ2=39.259,Plt;0.01)。良性病变组与癌前病变组、高分化腺癌组及中分化腺癌组之间比较有统计学意义(χ2=10.199,P=0.017;χ2=9.636,P=0.022;χ2=34.617,Plt;0.01)。癌前病变组与中分化腺癌组之间比较有统计学意义(χ2=8.363,P=0.015)。微浸润腺癌组及高分化腺癌组与中分化腺癌组之间比较均有统计学意义(χ2=18.335,Plt;0.01;χ2=7.042,P=0.030)。笔者认为如结节与周围血管关系类型表现为Ⅰ型,提示良性可能性大,如为Ⅲ或Ⅳ型,提示恶性可能性大,而Ⅱ型则良恶性均有可能。最初肿瘤细胞营养主要由所在组织内毛细血管以弥散方式提供,生长至1~2 mm时,如无其他方式血液供应,肿瘤难以继续生长[20]。目前已知的肺癌血液供应方式包括新生血管生成及血管生成拟态(vasculogenic mimicry,VM)[11]。众所周知,肿瘤新生血管生长是无序的,导致其形态多样、管径粗细不等,分支数目不同,走行扭曲扩张,在CT上多数表现为Ⅲ型及Ⅳ型。本研究发现SSNs与血管关系类型表现为Ⅱ型36例中,良性结节28例,癌前病变2例,微浸润腺癌4例,高分化腺癌2例。其原因可能为微浸润腺癌及高分化腺癌的血液供应可能来源于VM,无肉眼可见新生血管形成,故尚未出现CT上周围血管形态学改变。Yao等[12]对205例非小细胞肺癌研究中发现28例存在VM,133例DKK-1蛋白阳性表达,二者呈正相关,Plt;0.5。DKK-1蛋白通过诱导上皮间质转化(epithelial-mesenchymal transition,EMT)和定向干细胞相关蛋白的表达,促进VM形成,从而明显增强了非小细胞肺癌增殖、侵袭及转移。Wu等[13]对305例非小细胞肺癌患者研究中发现CD133和VM阳性率分别为48.9%和35.7%,明显高于正常组织(Plt;0.05),且VM与CD133、肿瘤分期、淋巴结转移及临床分期均呈正相关(Plt;0.05)。CD133及VM阳性表达患者平均生存时间短于阴性表达患者,故他们认为可以考虑将其作为靶向治疗标记物。武世伍等[14]对160例非小细胞肺癌患者研究中发现乳腺丝氨酸蛋白酶抑制物和VM阳性率分别为48.1%和36.9%,正常组织分别为100%和0,二者比较明显不同(Plt;0.05),VM、乳腺丝氨酸蛋白酶抑制物表达与肿瘤分化程度、淋巴结转移、临床分期、术后生存时间均呈具有相关性(Plt;0.05)。乳腺丝氨酸蛋白酶抑制物表达与VM呈负相关,其低表达提示预后不良[14]。
不同病理类型SSNs与周围血管及充气支气管分型不同,对SSNs性质的判定有一定帮助。SSNs与周围血管分型表现为Ⅰ型,与充气支气管分型为Ⅴ型时,提示良性可能性大;与周围血管分型为Ⅲ或Ⅳ型,与充气支气管分型为Ⅰ或Ⅱ型,提示恶性可能性大,提倡采用积极的干预措施。
1 Siegel R,Naishadham D,Jemal A.Cancer statistics,2013.CA Cancer J Clin,2013,63:11-30.
2 de Groot P,Munden RF.Lung cancer epidemiology,risk factors,and prevention.Radiol Clin North Am,2012,50:863-876.
3 Godoy MC,Naidich DP.Subsolid pulmonary nodules and the spectrum of peripheral adenocarcinomas of the lung:recommended interim guidelines for assessment and management.Radiology,2009,253:606-622.
4 Kim H,Park CM,Koh JM,et al.Pulmonary subsolidnodules:what radiologists need to know about the imaging features and management strategy.Diagn Interv Radiol,2014,20:47-57.
5 Jacobs C,van Rikxoort EM,Twellmann T,et al.Automatic detection of subsolid pulmonary nodules in thoracic computed tomography images.Med Image Anal,2014,18:374-384.
6 Asamura H,Hishida T,Suzuki K,et al.Radiographically determined noninvasive adenocarcinoma of the lung:survival outcomes of Japan Clinical Oncology Group0201.J Thorac Cardiovasc Surg,2013,146:24-30.
7 Tsutani Y,Miyata Y,Nakayama H,et al.Appropriate sublolar resection choice for ground glass opacity-dominant clinical stage IA lung adenocarcinoma:wedge resection or segmentectomy.Chest,2014,145:66-71.
8 Naidich DP,Bankier AA,MacMahon H,et al.Recommendations for the management of subsolid pulmonary nodules detected at CT:Astatement from the Fleischner Sociery,2013,266:304-317.
9 Gao F1,Li M,Ge X,Zheng X,et al.Multi-detector spiral CT study of the relationships between pulmonary ground-glass nodules and blood vessels.Eur Radiol,2013,23:3271-3277.
10 Travis WD,Brambilla E,Noguchi M,et al.International association for the study of lung cancer/american thoracic Society/european respiratory society international muhidisciplinary classification of lung adenocarcinoma.J Thorac Oncol,2011,6:244-285.
11 Jackson AL,Zhou B,Kim WY.HIF,hypoxia and the role of angiogenesis in non-small cell lung cancer.Expert Opin Ther Targets,2010,14:1047-1057.
12 Yao L,Zhang D,Zhao X,et al.Dickkopf-1-promoted vasculogenic mimicry in non-small cell lung cancer is associated with EMT and development of a cancer stem-like cell phenotype.J Cell Mol Med,2016,31:415-421.
13 Wu S,Yu L,Wang D,et al.Aberrant expression of CD133 in non-small cell lung cancer and its relationship to vasculogenic mimicry.BMC Cancer,2012,12:535.
14 武世伍,俞岚,承泽农,等.Expression of maspin in non-small cell lung cancer and its relationship to vasculogenic mimicry.中华科技大学学报·医学英德文版,2012,32:346-352.
10.3969/j.issn.1002-7386.2017.24.026
项目来源:河北医学科学研究重点课题(编号:20160685)
050031 石家庄市,河北医科大学第一医院放射科(李淑静、张晨光),胸外科(李建科),病理科(朱振龙)
李建科,050031 石家庄市,河北医科大学第一医院胸外科;E-mail:18633889881@163.com
R 734.2
A
1002-7386(2017)24-3772-03
2017-05-29)
